重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中毒性表皮坏死松解症的临床疗效观察
陆晓君 经晶 施辛 戴彩红 苏玉华 闫志华徐丰 杨志刚 凌昕 缪文进 陈玲玲
1苏州大学附属第二医院皮肤科215004;2江苏盛泽医院皮肤科,苏州215227;3苏州市第七人民医院皮肤科215151;4苏州市中西医结合医院皮肤科215101;5联勤保障部队第904 医院皮肤科,无锡214000;6苏州市第九人民医院皮肤科215200;7张家港市第三人民医院皮肤科215611;8苏州市立医院本部皮肤科215002
陆晓君现在苏州高新区人民医院215129
中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)是一种严重的皮肤药物不良反应[1],起病急,发展迅速,皮肤黏膜广泛受累,侵犯重要脏器,甚至危及生命。早期诊断并采取积极有效的治疗措施对控制病情、降低病死率及提高患者的生存质量尤为重要。至今该病的治疗方案尚未达成专家共识,目前多采用糖皮质激素和静脉注射丙种球蛋白治疗,但存在增加机会感染、并发症等风险。肿瘤坏死因子(TNF)-α广泛存在于Stevens-Johnson综合征(SJS)/TEN患者的疱液及血清中,在诱导角质形成细胞凋亡过程中发挥重要作用[2]。近年来TNF-α 拮抗剂逐渐给重症药疹的治疗带来新希望。我们联合多个中心开展TNF-α 拮抗剂重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(recombinant human tumor necrosis factor-α receptorⅡ:IgG Fc fusion protein,rhTNFR:Fc)治疗TEN 的临床观察。
临床资料
2009—2018 年苏州大学附属第二医院、江苏盛泽医院、联勤保障部队第904 医院、苏州市立医院本部、苏州市第七人民医院、苏州市第九人民医院、苏州市中西医结合医院、张家港市第三人民医院收集TEN 患者。纳入标准:①符合TEN 诊断标准:药物使用史;一定的潜伏期(5 ~35 d);弥漫性红斑、丘疹、水疱,表皮剥脱超过30%体表面积;②自愿参与本次研究并签署知情同意书。排除标准:①对本次研究的药物过敏;②伴有各种活动性皮肤疾病影响病情评估;③孕妇、哺乳期患者;④伴有活动性结核、病毒性肝炎等各种感染性疾病;⑤伴有各种肿瘤性疾病;⑥发病过程中使用过糖皮质激素;⑦其他自身免疫性大疱类疾病。
本研究共顺序纳入22 例患者,男10 例,女12 例,年龄22 ~75 岁,中位年龄50 岁。致敏药物分别为卡马西平7 例,丙戊酸钠6 例,别嘌醇4 例,柳氮磺吡啶2 例,正清风痛宁、氨苯砜及阿莫西林各1 例。潜伏期15 ~34 d,中位潜伏期23 d。所有患者入院时均已出现大面积的红斑、水疱、糜烂和渗出,其中黏膜受累者达21 例,累及眼、口、鼻、外阴及肛周,其中累及1 处者2 例,累及2 处者12 例,累及3 处者5 例,累及4 处、5 处者各1 例。合并症情况:神经外科术后9例,痛风4例,癫痫3例,青光眼1 例,高血压3 例,糖尿病2 例,炎症性肠病2 例,十二指肠溃疡、消化道出血各1 例,部分患者同时有多种合并症。22 例患者入院时体温38.3 ~40.1 ℃(39.2 ± 0.5)℃;SCORTEN(score of toxic epidermal necrolysis)评分:2 例1 分、6 例2 分、6 例3 分、6例4分、2例5分,中位数3分;药疹面积和严重程度指数(drug eruption area and severity index,DASI)评分31.30 ~64.00 分(53.64 ± 8.67);血清TNF-α 水平2.10 ~88.20 ng/L(33.95 ± 27.90 ng/L,参考值1.50 ~3.50 ng/L)。19例(86.40%)丙氨酸转氨酶84.20 ~1 794.30 U/L(548.84±634.64 U/L)、天冬氨酸 转 氨酶82.50 ~1 688.20 U/L(514.51 ±585.64 U/L),另3例正常。7例(31.80%)肌酐、尿素氮至少1项升高,肌酐137.50 ~321.40 μmol/L(223.24±64.00 μmol/L,参考值59.00 ~104.00 μmol/L),尿素氮10.70 ~78.60 mmol/L(39.70±25.35 mmol/L,参考值3.10 ~9.50 mmol/L)。
治疗与评价方法
1.治疗方法:停用可疑致敏药物,完善相关检查后接受rhTNFR:Fc[商品名益赛普,三生国健药业(上海)股份有限公司]治疗,方案:25 mg/次皮下注射,首剂加倍,每3天1次,连续治疗6 ~8次。上述治疗方案经苏州大学附属第二医院伦理委员会批准(伦理项目编号:2009029),经患者及其家属知情同意并签署知情同意书(各医院专属知情同意书)。一般支持和对症治疗:复方甘草酸苷注射液60 ~100 ml/d;维持水电解质及酸碱平衡,营养支持;同时注意皮肤黏膜护理,尤其是眼及生殖器部位;不予预防性应用抗生素。
2.评价指标:①患者总体情况:体温、皮疹变化及肝肾功能;②DASI 评分、DASI 改善指数[3]:治疗前及治疗后第4、7、10、13、16、19、22、25 天评估患者DASI 评分及DASI 改善指数[(治疗前DASI 值-治疗后DASI 值)/治疗前DASI 值×100%],计算达到DASI 评 分50% 改 善(DASI50)、75% 改 善(DASI75)、90%改善(DASI90)的患者例数和比例;③外周血及疱液TNF-α水平:采用微量样本多指标流式蛋白定量技术及试剂盒Human Th1/Th2 cytokine kit 2(美国BD Biosciences 公司)检测患者外周血及疱液TNF-α水平,其中外周血TNF-α水平每3天测1次,疱液TNF-α水平仅治疗前测量1次,局部疱液选取新发、紧张、无血污染的水疱;④监测患者的各种不适及血尿常规、肝肾功能和心电图等,并记录各种不良事件。
结 果
1.患者总体情况变化:入院时22 例患者均发热,其中2 例合并感染,分别为单纯疱疹和上呼吸道感染,予相应抗病毒治疗后好转。未合并感染的20例患者在初次rhTNFR:Fc 治疗24 ~72 h后体温停止升高,中位时间为48 h,48 ~120 h(中位数72 h)体温恢复正常。见图1。
皮疹变化:22 例患者均在初次治疗24 ~48 h(中位数36 h)控制水疱新发,48 ~96 h(中位数72 h)皮肤颜色由鲜红色转为暗紫色,2周后皮疹基本恢复正常。
肝功能:19 例异常者治疗后转氨酶水平逐渐下降,至25 d 时均恢复正常(中位时间16 d)。见图2。
肾功能:7 例肾功能异常者治疗4 ~13 d 后肌酐、尿素氮停止上升,并逐渐下降,其中5例至25 d时恢复正常,另2 例至治疗结束后2 个月恢复正常。见图3。
患者发病后1 ~6 d 接受治疗,中位数为3 d。22例均完成了6 ~8次治疗,无中途终止治疗者,其中17例治疗6次,3例治疗7次,2例治疗8次。
2.治疗前后血清TNF-α 水平比较:经重复测量方差分析,22 例患者不同时间点外周血TNF-α水平差异有统计学意义(F=24.76,P<0.01),且第4、7、10、13、16、19、22、25天及恢复期外周血TNF-α水平均显著低于治疗前(t = 5.48、5.39、5.38、5.32、5.32、5.33、5.06、5.33、5.37,均P <0.001),TNF-α 水平从治疗前(33.95 ± 27.90)ng/L(范围2.10 ~88.20 ng/L)降至第25 天时的(2.38±0.79)ng/L(范围1.10 ~3.50 ng/L)。治疗前22 例中17 例外周血TNF-α水平升高,随治疗的延长TNF-α水平逐渐降低至正常范围;另5 例TNF-α 水平正常者,治疗后TNF-α水平无明显变化,仍处于正常范围。见表1。

图1 中毒性表皮坏死松解症患者22 例治疗前后体温变化其中2 例合并感染,未合并感染的20 例在初次rhTNFR:Fc 治疗24 ~72 h后体温停止升高,48 ~120 h恢复正常。图中22条不同颜色曲线代表22例患者
治疗前,22 例外周血TNF-α 水平与SCORTEN评分成正相关(r = 0.608,P = 0.003),17 例TNF-α水平升高者SCORTEN 评分、丙氨酸转氨酶、天冬氨酸转氨酶、尿素氮水平均显著高于5 例外周血TNF-α正常者(均P <0.05),但两组体温、肌酐水平差异无统计学意义(均P >0.05)。治疗后,外周血TNF-α水平升高者与TNF-α正常者注射次数、体温恢复时间、水疱控制时间差异均无统计学意义(均P >0.05)。
治疗前,共采集15例患者新发水疱疱液,其疱液TNF-α 水平为(111.99 ± 99.41)ng/L(暂无参考值),外周血TNF-α 水平为(27.78±28.78)ng/L,疱液/外周血TNF-α 比值1.83 ~28.21(中位比值4.51)。治疗前外周血TNF-α水平与疱液TNF-α水平呈正相关(r=0.95,P <0.01)。15例采集疱液患者中,外周血TNF-α升高10例、TNF-α正常5例,外周血TNF-α 升高者疱液TNF-α 水平(152.72 ±98.03 ng/L)显著高于外周血TNF-α正常者(30.54±10.28 ng/L;t=2.70,P=0.02)。
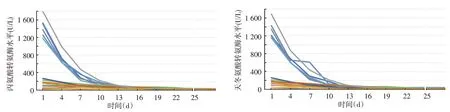
图2 中毒性表皮坏死松解症患者22例治疗前后丙氨酸转氨酶、天冬氨酸转氨酶水平变化 其中19例肝功能异常者治疗后转氨酶水平逐渐下降,至25 d 时均恢复正常。图中22条不同颜色曲线代表22例患者

图3 中毒性表皮坏死松解症患者22例治疗前后肌酐、尿素氮水平变化 其中7例肾功能异常者治疗4 ~13 d后肌酐、尿素氮停止上升并逐渐下降。图中22条不同颜色曲线代表22例患者
3.DASI 评分和DASI 改善指数:重复测量方差分析显示,22 例患者不同时间点DASI 评分差异有统计学意义(F = 532.81,P<0.01),且第4、7、10、13、16、19、22、25 天DASI 评分均显著低于治疗前(t = 16.10、17.59、22.54、23.94、24.40、27.11、27.08、26.60,均P <0.001),见表1。
治疗第10 天22 例(100%)改善达DASI50,治疗第19 天22 例(100%)改善达DASI75,治疗第25 天20 例(90.90%)改善达DASI90,见表2。治疗前,22 例患者血清TNF-α 水平与DASI 评分无明显相关性(P = 0.10),15 例患者疱液TNF-α 水平与DASI评分呈正相关(r=0.59,P=0.02)。
治疗前,外周血TNF-α 水平升高者DASI 评分(54.70±9.30)与TNF-α 正常者(50.10±5.60)差异无统计学意义(t = 1.03,P >0.05)。治疗后,两组DASI50、DASI75、DASI90 的比例差异亦无统计学意义(均P >0.05)。见表2。
4.安全性评价及随访:治疗过程中,22例患者对rhTNFR:Fc耐受性好,无明显急性不良反应。出院后随访6个月未见复发及各种并发症。
讨 论
依那西普作为人源化单克隆抗体受体融合蛋白,通过中和TNF-α,阻断其结合受体,下调单核细胞产生促炎细胞因子的能力并诱导产生更多炎性Th2细胞因子[4]。Paradisi 等[5]采用单剂量50 mg依那西普治疗10 例TEN 患者,所有患者7 ~20 d(中位数8.5 d)皮肤完成上皮化。一项随机对照试验[6]显示,依那西普能缩短SJS-TEN患者皮肤黏膜愈合时间,降低胃肠道出血的发生和基于SCORTEN 预测的死亡率。依那西普治疗TEN虽是标签外使用,但该方案是我们在国内外一些相关研究(多数是个案报道)已取得满意疗效及我们前期的一些研究工作基础上形成的。本研究共纳入22例TEN确诊患者,采用rhTNFR:Fc治疗6 ~8次,所有患者均完成治疗并痊愈出院,并随访至出院后6个月。我们观察了TEN 患者皮肤黏膜愈合情况,详细监测了体温、重要脏器、外周血及疱液TNF-α 水平等。这22 例患者在初次治疗后24 ~48 h 控制水疱新发,48 ~96 h 皮肤颜色由鲜红色转为暗紫色,2 周后皮疹基本恢复正常。体温在初次治疗后24 ~72 h 停止升高,转氨酶升高患者治疗2 ~4 周基本恢复正常,肾功能异常者治疗4 ~13 d 肌酐和尿素氮水平也停止了升高,提示rhTNFR:Fc 可有效改善TEN患者皮肤黏膜损伤、体温及肝肾功能,且治疗过程中均未出现明显不良反应。
表1 重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中毒性表皮坏死松解症前后外周血肿瘤坏死因子(TNF)-α水平及药疹面积和严重程度指数(DASI)评分变化(±s)
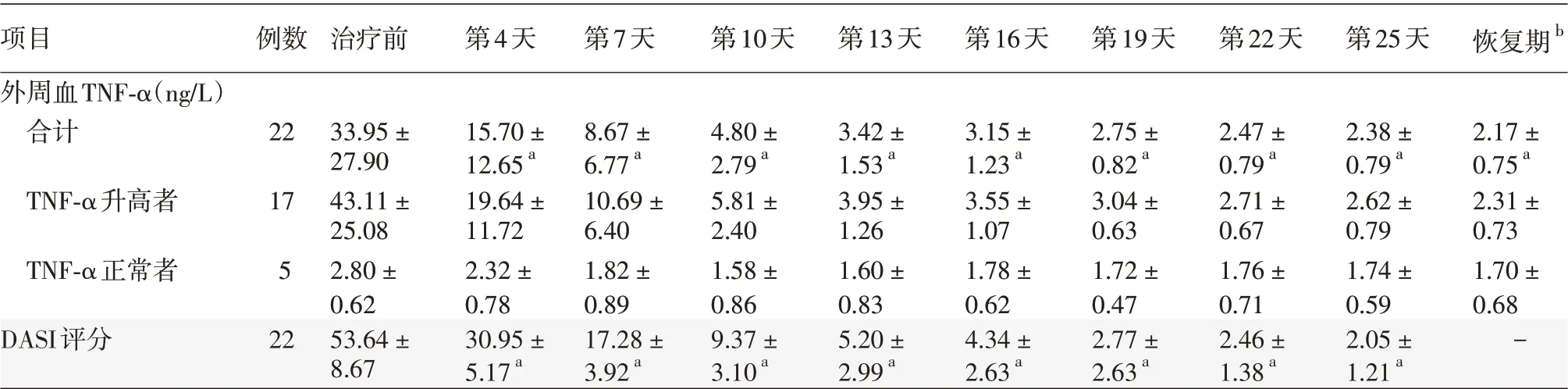
表1 重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中毒性表皮坏死松解症前后外周血肿瘤坏死因子(TNF)-α水平及药疹面积和严重程度指数(DASI)评分变化(±s)
注:a 与治疗前比较,P <0.001;b 治疗结束后2个月,皮疹消退
项目外周血TNF-α(ng/L)合计TNF-α升高者TNF-α正常者DASI评分例数治疗前第4天第7天第10天第13天第16天第19天第22天第25天恢复期b 22 17 5 22 33.95±27.90 43.11±25.08 2.80±0.62 53.64±8.67 15.70±12.65a 19.64±11.72 2.32±0.78 30.95±5.17a 8.67±6.77a 10.69±6.40 1.82±0.89 17.28±3.92a 4.80±2.79a 5.81±2.40 1.58±0.86 9.37±3.10a 3.42±1.53a 3.95±1.26 1.60±0.83 5.20±2.99a 3.15±1.23a 3.55±1.07 1.78±0.62 4.34±2.63a 2.75±0.82a 3.04±0.63 1.72±0.47 2.77±2.63a 2.47±0.79a 2.71±0.67 1.76±0.71 2.46±1.38a 2.38±0.79a 2.62±0.79 1.74±0.59 2.05±1.21a 2.17±0.75a 2.31±0.73 1.70±0.68-

表2 重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗22例中毒性表皮坏死松解症患者后不同时间药疹面积和严重程度指数(DASI)50、DASI75、DASI90的变化[例(%)]
入院时,根据SCORTEN评分预测[7],22例患者中死亡人数为8.18,但经治疗后所有患者均康复出院。SCORTEN 评分重点强调基础疾病、原发疾病对疾病预后的重要性,对皮损程度的描述仅表皮剥脱>10%体表面积,未对皮损程度做量化的描述,因此我们采用DASI评分及DASI改善指数[3]评估皮损情况。本研究22 例患者经rhTNFR:Fc 治疗后DASI 评分逐渐下降,所有患者于治疗第10 天达DASI50,第19天达DASI75,20例(90.9%)于治疗第25 天达DASI90。虽然出院时并非所有患者达DASI90 改善,但药疹属于自限性疾病,一般达DASI75 改善可判断治疗有效。与SCORTEN 评分系统相比,DASI 评分系统更侧重于评估患者局部皮损严重程度,可不受时间的限制,全程客观地评价TEN 患者的皮肤及黏膜受损情况,可作为SCORTEN评分系统的有益补充。
既往多项研究[8-9]显示,TEN患者外周血TNF-α水平明显升高。本研究显示,治疗前22 例患者中17 例外周血TNF-α 水平升高,5 例正常,但治疗后所有患者均痊愈。经晶等[10]研究显示,17例SJS患者中11 例治疗前外周血TNF-α 水平升高,但经依那西普治疗后所有患者痊愈。Murata 等[11]研究纳入19 例SJS 患者及16 例TEN 患者,仅25%患者血清TNF-α水平升高(20.2±9.1 ng/L)。此外,本研究还显示,血清TNF-α 水平与皮损DASI 评分无相关性。因此,并非所有TEN患者外周血TNF-α水平升高,且外周血TNF-α水平可能与皮损程度并无相关性,其高低并不能有效评估TNF-α 拮抗剂的治疗效果。
有研究[12-13]显示,TEN 患者疱液TNF-α 水平高于其血清水平,甚至超过10 倍[12]。本研究中共采集到15 例患者治疗前新发水疱疱液,疱液TNF-α水平明显高于外周血,且疱液与外周血TNF-α水平比值为1.83 ~28.21。Berthold 等[14]发现,治疗前类风湿性关节炎患者血清TNF-α 水平通常较低或无法检测,而关节液TNF-α 水平却显著升高,推测可能与游离TNF-α 的半衰期较短有关。Hunger 等[15]发现,TEN患者皮损处角质形成细胞和炎症细胞中TNF-α 高表达,经TNF-α 拮抗剂治疗后,随局部免疫反应的降低TNF-α表达也显著降低,TNF-α水平与皮损的恢复平行。由此我们推测,TNF-α主要产生于局部并发挥生物学效应,由于其半衰期较短,循环中TNF-α水平较低。我们还发现,疱液TNF-α水平与皮损严重程度呈正相关。因此,相较于血清TNF-α水平,疱液TNF-α水平对早期评估TNF-α拮抗剂治疗效果可能更有价值。然而,目前TEN患者疱液TNF-α水平并无参考值,且由于无法收集患者恢复期疱液,较难通过疱液TNF-α水平的变化评估治疗效果。
以往报道[16-17]依那西普治疗1 ~2 次后TEN 患者皮肤黏膜完成上皮化并完全治愈,但本研究中TEN 患 者 接 受 了6 ~8 次rhTNFR:Fc 治 疗。Famularo 等[18]报道1例环丙沙星致TEN 患者,依那西普25 mg 皮下注射2 次后表皮完成上皮化,但最终在入院第12天死于弥散性血管内凝血和多器官衰竭。研究[6]显示,TNF-α拮抗剂除了能有效控制TNF-α 的分泌,还可增加调节性T 细胞(Treg)的数量,而Treg 数量与SJS-TEN 患者死亡率呈负相关,因此建议病情严重或有高危因素的SJS-TEN 患者可通过增加TNF-α 拮抗剂的治疗量以有效控制病情。本研究22 例TEN 患者治疗前均伴有发热,部分存在肝肾功能异常,但治疗过程中未出现并发症,最终所有患者完全康复出院,可能与rhTNFR:Fc剂量足、疗程长相关。此外,我们发现TEN患者在rhTNFR:Fc治疗2次(第7天)时体温及皮疹虽明显好转,但肝肾功能并未得到有效控制,DASI50改善20 例,DASI75 改善仅5 例,且同时间段外周血TNF-α 水平(8.67±6.77 ng/L)仍高于正常;当治疗第6 次(第19 天)时,DASI75 改善比例达100%,同时间段外周血TNF-α水平(2.75±0.82 ng/L)基本降至正常范围。因此,本研究以有效控制体温、皮疹、外周血TNF-α 水平、DASI 指数及肝肾功能为停药标准,与多数文献[5-6]报道的以表皮完成上皮化为治疗终点标准不同,但本治疗方案中并发症的发生、治愈率等有明显优势。治疗过程中未出现不良反应可能是由于相比较银屑病、类风湿性关节炎等,TEN 患者使用TNF-α 拮抗剂疗程短、总量少的缘故。
受伦理的限制,本病尚难开展与传统治疗对比的随机对照试验。本研究显示,TNF-α 拮抗剂rhTNFR:Fc治疗TEN有较好的疗效,但其最佳剂量及合理的疗程尚待进一步斟酌。本研究样本量较小,还需多中心、大样本量的研究进一步验证。
利益冲突所有作者均声明不存在利益冲突

