lncRNA LEF1-AS1 通过靶向miR-612 调控皮肤鳞状细胞癌细胞株增殖、凋亡、迁移侵袭的体外实验研究
郑云鹏 李旭阳 蔡丙杰 李冬芹 尹光文
郑州大学第一附属医院皮肤科450052
皮肤鳞状细胞癌(简称皮肤鳞癌)是一种常见的皮肤恶性肿瘤,部分患者可发生快速转移,影响皮肤外观和预后[1-4]。早期快速准确地控制肿瘤进展对患者具有重要意义。长链非编码RNA(long noncoding RNA,lncRNA)和微小RNA(microRNA,miR)均为常见的非编码RNA(non-coding RNA,ncRNA),其在机体癌症中的促进功能或者抑制功能均已得到很多研究的认可[5-6]。lncRNA LEF1-AS1 在多种癌症中均已有研究报道,但是在皮肤鳞癌中的功能及机制尚不清楚。本实验通过生物信息学预测LncRNA LEF1-AS1 的靶向miRNA,发现LncRNA LEF1-AS1 与miR-612 有结合位点,且研究报道LncRNA LINC00460通过使miR-612海绵化可促进头颈部鳞癌细胞的增殖,迁移和侵袭[7]。但miR-612在皮肤鳞癌中的功能尚不清楚。本研究以皮肤鳞癌细胞SCC13 为研究对象,检测lncRNA LEF1-AS1、miR-612的表达,观察干扰lncRNA LEF1-AS1、miR-612的表达对其增殖、迁移、侵袭和凋亡的影响。
材料与方法
一、实验材料
收集郑州大学第一附属医院2018 年3 月至2019 年6 月外科手术切除的20例皮肤鳞癌及对应的癌旁组织。本研究符合2013 年修订的《赫尔辛基 宣 言》(https://www.wma.net/policies-post/wmadeclaration-of-helsinki-ethical-principles-for-medicalresearch-involving-human-subjects/)的要求,所有受试者均签署知情同意书。
SCC13细胞(编号:CVCL_4029)购自美国模式培养物集存库。实时荧光定量逆转录PCR(qRTPCR)检测试剂盒、反转录试剂盒(日本Takara 公司);LipofectamineTM2000 脂质体转染试剂盒(美国Invitrogen 公司,规格:1.5 ml);CCK8 细胞计数试剂盒(日本同仁化学研究所);膜联蛋白V-异硫氰酸荧光素和碘化丙锭(Annexin V-FITC/PI)双染细胞凋亡检测试剂盒(南京诺唯赞生物科技有限公司);迁移实验(Transwell)小室(美国Corning 公司);双荧光素酶报告基因检测试剂盒(美国Promega 公司)。 流 式 细 胞 仪(Cytomics FC 500,美 国BECKMANCOULTER公司)。
二、qRT-PCR法检测组织中皮肤鳞癌及癌旁组织中LEF1-AS1、miR-612的表达
将充分研磨的组织用RNA提取试剂盒抽提总RNA,再用反转录试剂盒将其合成cDNA,采用qRT-PCR 检测试剂盒检测lncRNA LEF1-AS1、miR-612的表达,以GAPDH、U6为内参,引物由南京科佰生物科技有限公司合成,序列见表1,以2-△△Ct法分析lncRNA LEF1-AS1、miR-612的相对表达量。
三、SCC13细胞的培养与分组
使用含10%胎牛血清的DMEM 培养基在37 ℃、5% CO2的细胞培养箱中常规培养和传代SCC13 细胞。按脂质体LipofectamineTM2000 试剂的说明书操作将lncRNA LEF1-AS1 的干扰无意义序列(si-NC)、lncRNA LEF1-AS1 的干扰序列(si-LEF1-AS1)、miR-612 过表达的无意义序列(miR-NC)、miR-612 过表达基因序列(miR-612)转染至SCC13 细胞,记为si-NC 组、si-LEF1-AS1 组、miR-NC组、miR-612组;将si-LEF1-AS1分别与抑制miR-612 表达的无意义序列(anti-miR-NC)、抑制miR-612 表达基因序列(anti-miR-612)共转染至SCC13 细胞中,记为si-LEF1-AS1+anti-miR-NC 组和si-LEF1-AS1+anti-miR-612 组;各组在转染8 h后弃去培养基继续培养48 h,用qRT-PCR法检测转染的效率,确定转染成功后用于后续实验研究。
四、干扰lncRNA LEF1-AS1表达对SCC13细胞增殖、凋亡、迁移及侵袭的影响
取si-NC 组、si-LEF1-AS1 组SCC13 细胞,采用CCK8 法检测细胞增殖,流式细胞仪分析细胞的凋亡情况,Transwell试验检测细胞的迁移、侵袭能力,Western印迹检测增殖相关蛋白细胞周期蛋白依赖激酶1(cyclinD1)、细胞周期蛋白依靠性激酶抑制剂(p21),凋亡相关蛋白Bcl-2、Bcl-2 相关X 蛋白(Bax),迁移及侵袭相关蛋白基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)的相对水平。
1.CCK8 法检测细胞增殖:以100 μl、5×105个细胞置于96孔板中,培养24、48、72 h,加入20 μl的CCK8溶液,使用酶标仪在490 nm波长检测各组细胞的吸光度(A值)。以A值反映细胞的增殖能力。
2.流式细胞仪分析细胞凋亡:收集细胞,使用结合缓冲液重悬,按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书要求操作,避光孵育待测细胞,快速上流式细胞仪检测分析细胞的凋亡情况。凋亡率(%)=早期凋亡率+晚期凋亡率。
3.Transwell 试验检测细胞的迁移、侵袭能力:收集细胞,先用不含血清的培养基培养24 h,取1×105/ml 细胞100 μl 均匀铺在上室表面,下室内加入700 μl含有血清的培养基,将小室置于恒温培养箱中培养24 h,取出小室后,进行甲醇固定、结晶紫染色,显微镜下观察穿膜细胞数,取5个视野拍照,计算平均值。选用含有基质胶的小室检测细胞的侵袭能力,不含基质胶的小室检测细胞的迁移能力。

表1 实时荧光定量逆转录PCR引物信息
4.Western印迹试验:收集细胞,裂解后提取总蛋白,使用BCA 法对蛋白进行定量。目的蛋白沸水浴变性处理,取上清液上样电泳,经转膜、封闭后,将膜转移至一抗溶液(1∶500)中,4 ℃下孵育过夜。将膜转移至相应的二抗稀释液(1∶1 000)中,室温孵育2 h,通过超敏ECL 发光试剂盒显影、定影、曝光。使用Quantity One 4.6软件分析条带灰度值,以GAPDH 为参照,以目的条带灰度值与GAPDH 条带的比值为cyclinD1、p21、Bax、Bcl-2、MMP-2、MMP-9的相对表达水平。
五、过表达miR-612对SCC13细胞增殖、凋亡、迁移及侵袭的影响
取miR-NC 组、miR-612 组SCC13 细胞,采用CCK8 法检测细胞增殖,流式细胞仪分析细胞的凋亡情况,Transwell 试验检测细胞的迁移、侵袭能力,Western 印迹检测cyclinD1、p21、Bax、Bcl-2、MMP-2、MMP-9的相对水平。
六、lncRNA LEF1-AS1 与miR-612 的结合能力检测
用LncBase Predicted v.2 在线预测网站(http://carolina.imis.athena - innovation.gr/diana_tools/web/index.php?r=lncbasev2%2Findex-predicted)预 测lncRNA LEF1-AS1 与miR-612 之间的互补序列,根据互补序列设计合成有互补结合位点的WT-LEF1-AS1序列和无互补结合位点的MUT-LEF1-AS1序列(图1),并将其克隆至荧光载体上,构建荧光素酶报告基因质粒,分别与miR-NC、miR-612 共转染至SCC13细胞,转染48 h后按照双荧光素酶报告基因检测试剂盒要求操作,检测细胞的萤火虫荧光素酶活性和海肾荧光素酶活性,以二者的比值表示报告基因的表达水平。
将LEF1-AS1过表达的无意义序列(LEF1-AS1-NC)、LEF1-AS1 过表达基因序列(LEF1-AS1)、si-NC、si-LEF1-AS1 转染至SCC13 细胞中,采用qRT-PCR 法检测各组细胞miR-612 的相对表达水平,以检测lncRNA LEF1-AS1 对miR-612 的调控作用。

图1 根据长链非编码RNA LEF1-AS1与微小RNA-612(miR-612)之间的互补序列设计的互补和不互补序列WT-LEF1-AS1:有互补结合位点的序列;MUT-LEF1-AS1:无互补结合位点的序列
七、干扰lncRNA LEF1-AS1 及抑制miR-612 表达对SCC13细胞增殖、凋亡、迁移及侵袭的影响
取si-NC 组、si-LEF1-AS1 组、si-LEF1-AS1 +anti-miR-NC 组、si-LEF1-AS1 + anti-miR-612 组细胞,采用qRT-PCR法检测各组细胞miR-612的相对表达,CCK8法检测细胞增殖,流式细胞仪分析细胞的凋亡情况,Transwell 试验检测细胞的迁移、侵袭能力,Western 印迹检测cyclinD1、p21、Bax、Bcl-2、MMP-2、MMP-9的相对水平。
八、统计学处理
结 果
一、lncRNA LEF1-AS1 和miR-612 在皮肤鳞癌组织中的表达
皮肤鳞癌组织中的lncRNA LEF1-AS1 相对表达(2.93±0.29)高于癌旁皮肤组织(1.00±0.08,t=28.69,P <0.001),miR-612 的相对表达(0.52 ±0.05)低于癌旁皮肤组织(1.01±0.09,t=21.28,P <0.001)。
二、干扰lncRNA LEF1-AS1 表达对SCC13 增殖、凋亡、迁移及侵袭的影响
见图2、表2。si-LEF1-AS1 组细胞lncRNA LEF1-AS1 相对表达低于si-NC 组(P <0.05);24、48、72 h 时细胞增殖能力低于si-NC 组(均P <0.05),细胞凋亡率高于si-NC 组(P <0.05),迁移、侵袭细胞数均低于si-NC组(均P <0.05)。
Western 印迹显示,si-LEF1-AS1组细胞增殖相关蛋白cyclinD1相对水平低于si-NC 组(P <0.05),p21 相对水平高于si-NC 组(P <0.05);凋亡相关蛋白Bcl-2相对水平低于si-NC组(P <0.05),Bax相对水平高于si-NC 组(P <0.05);迁移、侵袭相关蛋白MMP-2、MMP-9 相对水平均低于si-NC 组(均P <0.05)。见图3、表3。
三、miR-612 过表达对SCC13 细胞增殖、凋亡、迁移及侵袭的影响
miR-612 组细胞miR-612 相对表达高于miRNC 组(P <0.05);24、48、72 h 时miR-612 组细胞增殖能力低于miR-NC 组(均P <0.05);miR-612组细胞凋亡率高于miR-NC 组(P <0.05);miR-612 组迁移、侵袭细胞数均低于miR-NC组(均P <0.05)。见图4、表4。
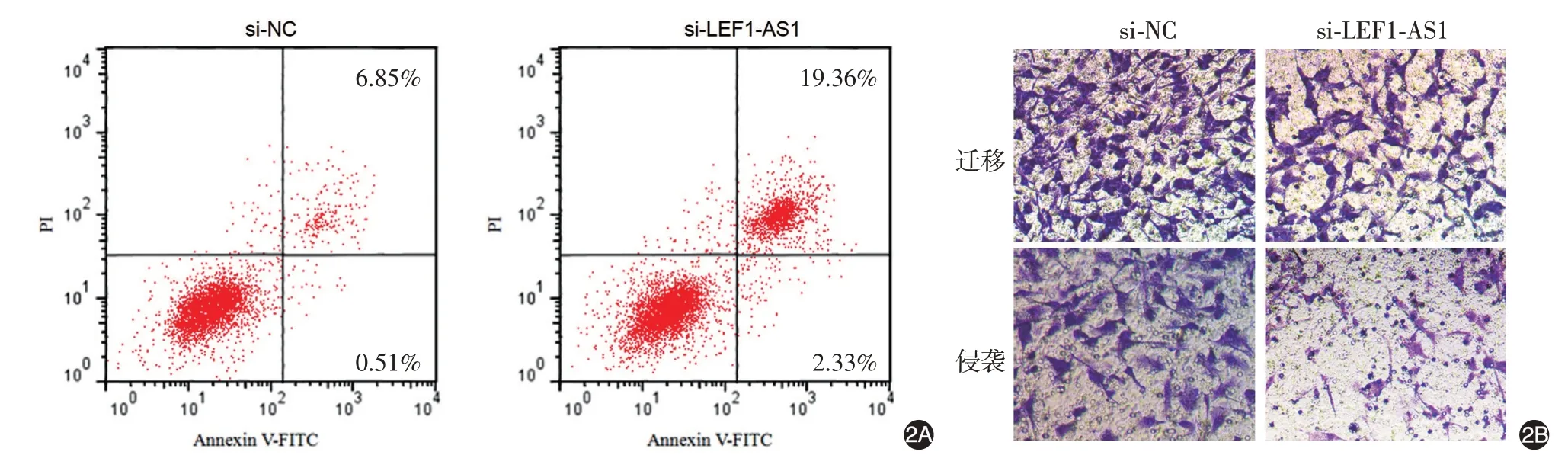
图2 干扰长链非编码RNA(lncRNA)LEF1-AS1表达后SCC13细胞的凋亡、迁移、侵袭能力 2A:流式细胞仪检测,si-LEF1-AS1组细胞凋亡率高于si-NC组;2B:Transwell试验检测,si-LEF1-AS1组迁移、侵袭细胞数均低于si-NC组。si-NC,转染lncRNA LEF1-AS1的干扰无意义序列;si-LEF1-AS1,转染lncRNA LEF1-AS1的干扰序列
表2 干扰长链非编码RNA(lncRNA)LEF1-AS1表达对SCC13细胞增殖、凋亡、迁移及侵袭的影响(±s)
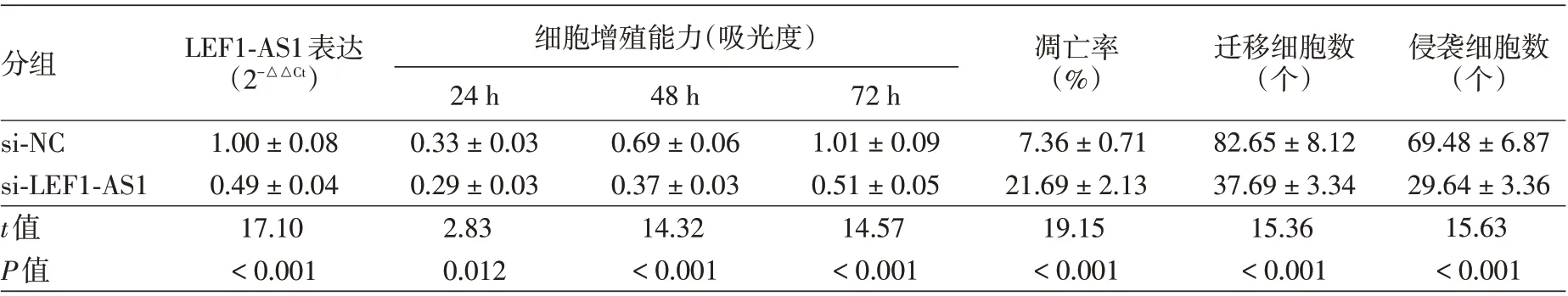
表2 干扰长链非编码RNA(lncRNA)LEF1-AS1表达对SCC13细胞增殖、凋亡、迁移及侵袭的影响(±s)
注:n=9。si-NC:转染lncRNA LEF1-AS1的干扰无意义序列;si-LEF1-AS1:转染lncRNA LEF1-AS1的干扰序列
分组LEF1-AS1表达(2-△△Ct)细胞增殖能力(吸光度)24 h 0.33±0.03 0.29±0.03 2.83 0.012 48 h 0.69±0.06 0.37±0.03 14.32<0.001 72 h 1.01±0.09 0.51±0.05 14.57<0.001凋亡率(%)迁移细胞数(个)侵袭细胞数(个)si-NC si-LEF1-AS1 t值P值1.00±0.08 0.49±0.04 17.10<0.001 7.36±0.71 21.69±2.13 19.15<0.001 82.65±8.12 37.69±3.34 15.36<0.001 69.48±6.87 29.64±3.36 15.63<0.001

图3 Western 印迹检测干扰长链非编码RNA(lncRNA)LEF1-AS1 表达后SCC13 细胞增殖、凋亡、迁移和侵袭相关蛋白的表达 3A:si-LEF1-AS1 组cyclinD1 相对水平低于si-NC 组,p21 相对水平高于si-NC 组;3B:Bcl-2 相对水平低于si-NC 组,Bax 相对水平高于si-NC 组;3C:MMP-2、MMP-9相对水平均低于si-NC组。si-NC,转染lncRNA LEF1-AS1的干扰无意义序列;si-LEF1-AS1,转染lncRNA LEF1-AS1的干扰序列
表3 Western印迹检测干扰lncRNA LEF1-AS1表达后SCC13细胞增殖、凋亡、迁移和侵袭相关蛋白的表达(±s)

表3 Western印迹检测干扰lncRNA LEF1-AS1表达后SCC13细胞增殖、凋亡、迁移和侵袭相关蛋白的表达(±s)
注:n=9。si-NC:转染lncRNA LEF1-AS1的干扰无意义序列;si-LEF1-AS1:转染lncRNA LEF1-AS1的干扰序列
分组 增殖相关蛋白cyclinD1 0.65±0.06 0.24±0.03 18.34<0.001 p21 0.31±0.03 0.73±0.06 18.78<0.001凋亡相关蛋白Bcl-2 0.69±0.06 0.27±0.03 18.78<0.001 Bax 0.37±0.03 0.78±0.07 16.15<0.001迁移、侵袭相关蛋白MMP-2 0.83±0.07 0.39±0.04 16.37<0.001 MMP-9 0.61±0.06 0.22±0.03 17.44<0.001 si-NC si-LEF1-AS1 t值P值
Western印迹显示,miR-612组细胞增殖相关蛋白cyclinD1 相对水平低于miR-NC 组(P <0.05),p21 相对水平高于miR-NC 组(P <0.05);凋亡相关蛋白Bcl-2相对水平低于miR-NC组(P <0.05),Bax相对水平高于miR-NC 组(P <0.05);迁移、侵袭相关蛋白MMP-2、MMP-9相对水平均低于miR-NC 组(均P <0.05)。见图5、表5。
四、lncRNA LEF1-AS1 靶向调控SCC13 细胞miR-612的表达
共转染WT-LEF1-AS1后,miR-612组细胞荧光活性(0.33 ± 0.03)低于miR-NC 组(1.00 ± 0.09,t =21.19,P <0.001);而共转染MUT-LEF1-AS1 后,miR-612 组细胞荧光活性(0.97 ± 0.07)与miR-NC组(0.98 ± 0.08)差异无统计学意义(t = 0.28,P =0.78)。
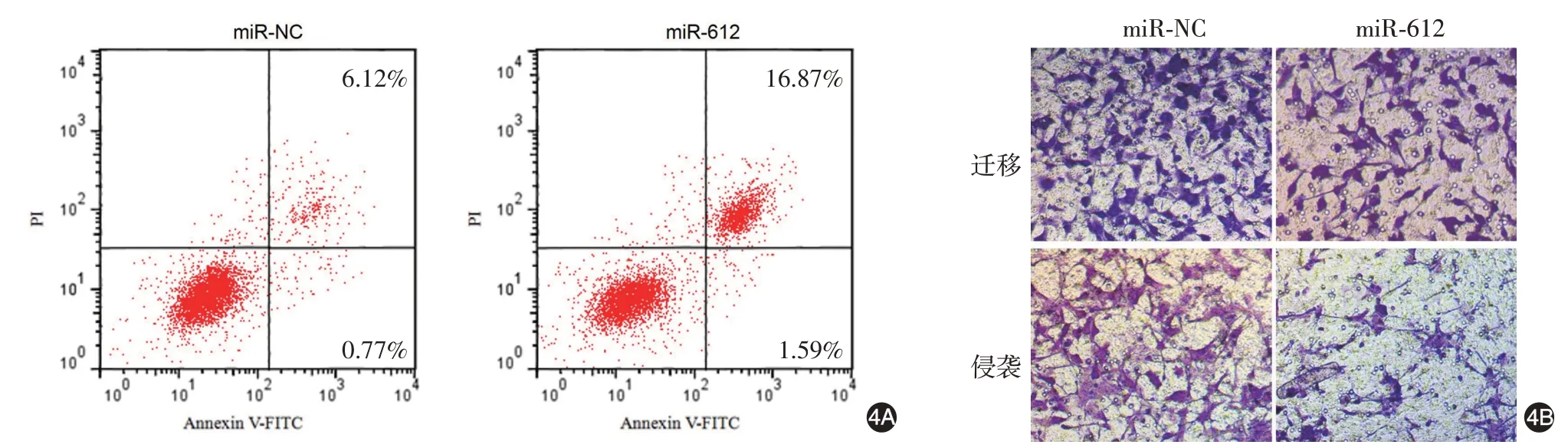
图4 miR-612 过表达对SCC13 细胞的凋亡、迁移、侵袭能力的影响 4A:流式细胞仪检测,miR-612 组细胞凋亡率高于miR-NC 组;4B:Transwell试验检测,miR-612组迁移、侵袭细胞数均低于miR-NC组。miR-NC组,转染miR-612过表达的无意义序列;miR-612组,转染miR-612过表达基因
表4 miR-612过表达对SCC13细胞增殖、凋亡、迁移及侵袭的影响(±s)

表4 miR-612过表达对SCC13细胞增殖、凋亡、迁移及侵袭的影响(±s)
注:n=9。miR-NC组:转染miR-612过表达的无意义序列;miR-612组:转染miR-612过表达基因
分组miR-612(2-△△Ct)凋亡率(%)迁移细胞数(个)miR-NC miR-612 t值P值0.99±0.07 2.68±0.26 18.83<0.001增殖能力(吸光度)24 h 0.35±0.03 0.32±0.03 2.12 0.049 28 h 0.67±0.06 0.43±0.04 9.98<0.001 72 h 1.03±0.09 0.57±0.05 13.40<0.001 6.89±0.67 18.46±1.73 18.71<0.001 83.65±8.41 43.66±4.39 12.64<0.001侵袭细胞数(个)71.64±7.32 34.69±3.87 13.33<0.001
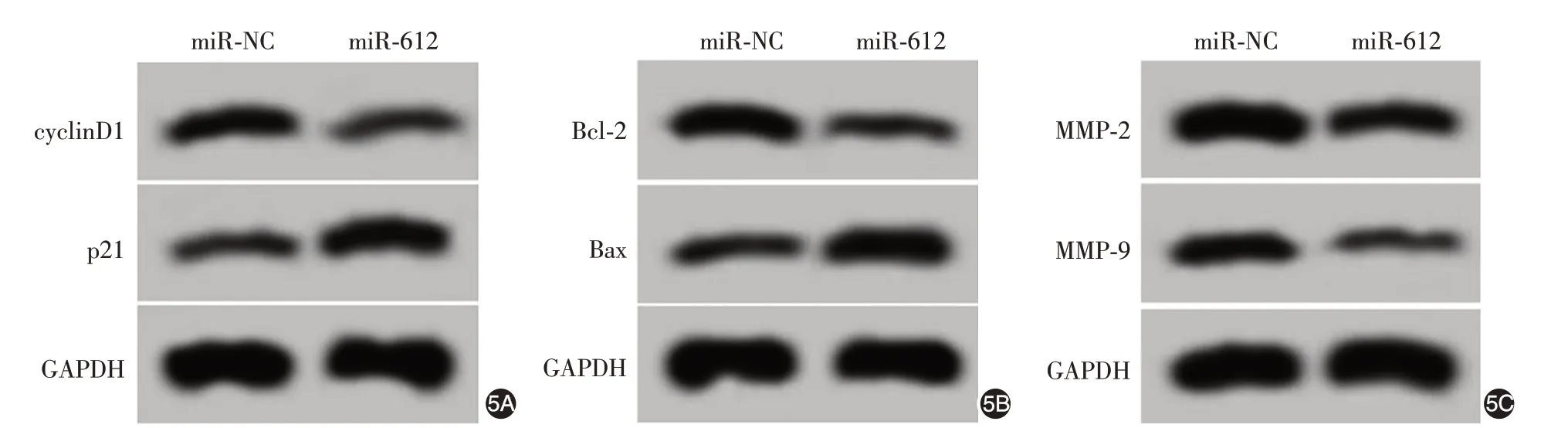
图5 Western印迹检测干扰miR-612过表达对SCC13细胞增殖、凋亡、迁移和侵袭相关蛋白表达的影响 5A:miR-612组cyclinD1相对水平低于miR-NC组,p21相对水平高于miR-NC组;5B:Bcl-2相对水平低于miR-NC组,Bax相对水平高于miR-NC组;5C:MMP-2、MMP-9相对水平均低于miR-NC组
表5 Western印迹检测miR-612过表达对SCC13细胞相关蛋白的影响(±s)
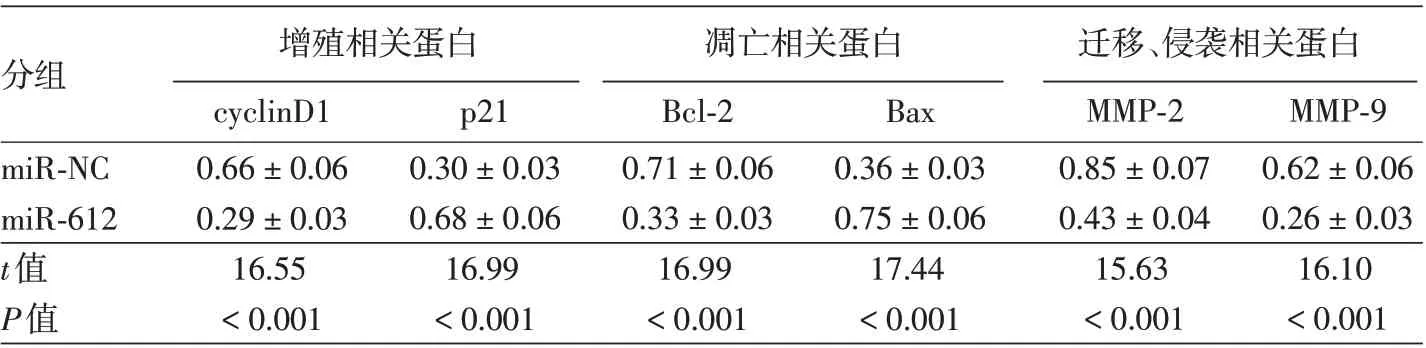
表5 Western印迹检测miR-612过表达对SCC13细胞相关蛋白的影响(±s)
注:n=9。miR-NC组:转染miR-612过表达的无意义序列;miR-612组:转染miR-612过表达基因
分组 增殖相关蛋白cyclinD1 0.66±0.06 0.29±0.03 16.55<0.001 p21 0.30±0.03 0.68±0.06 16.99<0.001凋亡相关蛋白Bcl-2 0.71±0.06 0.33±0.03 16.99<0.001 Bax 0.36±0.03 0.75±0.06 17.44<0.001迁移、侵袭相关蛋白MMP-2 0.85±0.07 0.43±0.04 15.63<0.001 MMP-9 0.62±0.06 0.26±0.03 16.10<0.001 miR-NC miR-612 t值P值
LEF1-AS1-NC 组、LEF1-AS1 组、si-NC 组、si-LEF1-AS1 组细胞miR-612 的相对表达分别为1.00±0.09、0.49±0.04、1.01±0.08、2.53±0.25,差异有统计学意义(F=356.62,P <0.001),LEF1-AS1组低于LEF1-AS1-NC 组(LSD-t =15.54,P <0.05),si-LEF1-AS1 组高于与si-NC 组(LSD-t=17.33,P <0.05)。
五、干扰lncRNA LEF1-AS1 并抑制miR-612 的表达对SCC13细胞增殖、凋亡、迁移及侵袭的影响
si-NC 组、si-LEF1-AS1 组、si-LEF1-AS1+antimiR-NC 组、si-LEF1-AS1 + anti-miR-612 组细胞间miR-612 的相对表达差异有统计学意义,24、48、72 h 时的增殖能力差异有统计学意义,凋亡率(图6)、迁移、侵袭细胞数(图7)差异均有统计学意义(均P <0.05)。si-LEF1-AS1 组细胞中miR-612表达高于si-NC组,48、72 h细胞增殖能力低于si-NC组,细胞凋亡率高于si-NC组,迁移细胞数和侵袭细胞数低于si-NC 组(均P <0.05),而si-LEF1-AS1+anti-miR-612 组细胞中miR-612 表达低于si-LEF1-AS1+anti-miR-NC 组,48、72 h 细胞增殖能力高于si-LEF1-AS1 + anti-miR-NC 组,细胞凋亡率低于si-LEF1-AS1+anti-miR-NC 组,迁移细胞数和侵袭细胞数高于si-LEF1-AS1+anti-miR-NC 组(均P <0.05)。见表6。

图6 流式细胞仪检测干扰长链非编码RNA(lncRNA)LEF1-AS1并抑制miR-612的表达对SCC13细胞凋亡的影响 si-LEF1-AS1组细胞凋亡率高于si-NC组(P <0.05);si-LEF1-AS1+anti-miR-612组细胞凋亡率低于si-LEF1-AS1+anti-miR-NC组。si-NC,转染lncRNA LEF1-AS1的干扰无意义序列;si-LEF1-AS1,转染lncRNA LEF1-AS1的干扰序列;anti-miR-NC,转染抑制miR-612表达的无意义序列;anti-miR-612,转染抑制miR-612表达基因

图7 Transwell试验检测干扰长链非编码RNA(lncRNA)LEF1-AS1并抑制miR-612的表达对SCC13细胞迁移、侵袭能力的影响 si-LEF1-AS1组迁移细胞数和侵袭细胞数低于si-NC组;si-LEF1-AS1+anti-miR-612组迁移细胞数和侵袭细胞数高于si-LEF1-AS1+anti-miR-NC组
Western 印迹显示,4 组细胞cyclinD1、p21、Bcl-2、Bax、MMP-2、MMP-9蛋白相对水平差异均有统计学意义(均P <0.001),si-LEF1-AS1 组cyclinD1、Bcl-2、MMP-2、MMP-9蛋白相对水平均低于si-NC 组,p21、Bax 蛋白相对水平高于si-NC 组(均P <0.05);而si-LEF1-AS1 + anti-miR-612 组cyclinD1、Bcl-2、MMP-2、MMP-9蛋白相对水平高于si-LEF1-AS1 + anti-miR-NC 组,p21、Bax 蛋白相对水平低于si-LEF1-AS1 + anti-miR-NC 组(均P <0.05)。见图8、表7。
讨 论
Zong 等[8]报道,lncRNA LEF1-AS1 在食管鳞癌组织中的表达异常上调,并与患者的淋巴转移和临床分期具有显著的相关性,提示lncRNA LEF1-AS1可能是参与食管鳞癌临床进展的lncRNA,可作为潜在的预测指标。Zhang等[9]在口腔鳞癌的研究中发现,lncRNA LEF1-AS1在组织和细胞中的表达均显著升高,且与患者预后不良相关,下调lncRNA LEF1-AS1能够在体外抑制癌细胞的增殖、迁移,促进凋亡并发生G0/G1期阻滞,在体内抑制裸鼠肿瘤的生长,产生这种影响的作用机制与抑制Hippo信号通路活性具有明显的相关性,提示lncRNA LEF1-AS1 通过抑制Hippo 信号通路,从而在口腔鳞癌中发挥致癌作用。由此,我们推测lncRNA LEF1-AS1可能在皮肤鳞癌中也具有致癌作用。本研究发现,lncRNA LEF1-AS1 在皮肤鳞癌组织中的表达异常升高,干扰lncRNA LEF1-AS1 表达后,皮肤鳞癌细胞SCC13的增殖能力、迁移侵袭能力均受到明显的抑制,细胞的凋亡明显增强,这些试验结果均与lncRNA LEF1-AS1 在食管鳞癌和口腔鳞癌中的功能相呼应,提示其在皮肤鳞癌中也发挥致癌的功能。
表6 干扰长链非编码RNALEF1-AS1并抑制miR-612的表达对SCC13细胞增殖、凋亡、迁移侵袭的作用(±s)
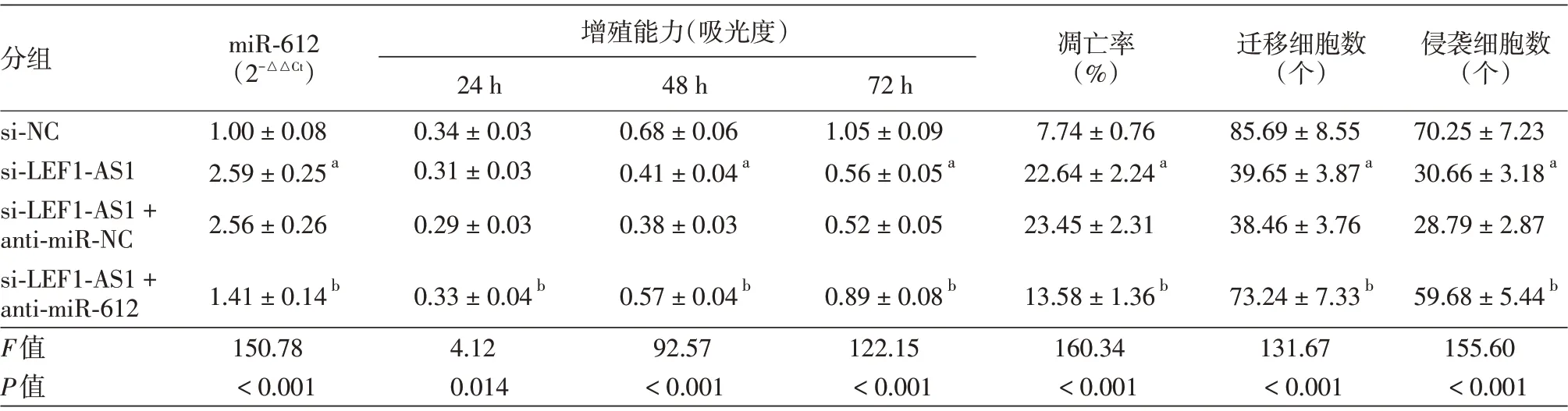
表6 干扰长链非编码RNALEF1-AS1并抑制miR-612的表达对SCC13细胞增殖、凋亡、迁移侵袭的作用(±s)
注:n=9。si-NC:转染lncRNA LEF1-AS1 的干扰无意义序列;si-LEF1-AS1:转染lncRNA LEF1-AS1 的干扰序列;anti-miR-NC,转染抑制miR-612 表达的无意义序列;anti-miR-612,转染抑制miR-612表达基因。a与si-NC 组比较,P <0.05;b与si-LEF1-AS1+anti-miR-NC 组比较,P <0.05
增殖能力(吸光度)分组miR-612(2-△△Ct)si-NC si-LEF1-AS1 si-LEF1-AS1+anti-miR-NC si-LEF1-AS1+anti-miR-612 F值P值1.00±0.08 2.59±0.25a 2.56±0.26 1.41±0.14b 150.78<0.001 24 h 0.34±0.03 0.31±0.03 0.29±0.03 0.33±0.04b 4.12 0.014 48 h 0.68±0.06 0.41±0.04a 0.38±0.03 0.57±0.04b 92.57<0.001 72 h 1.05±0.09 0.56±0.05a 0.52±0.05 0.89±0.08b 122.15<0.001凋亡率(%)7.74±0.76 22.64±2.24a 23.45±2.31 13.58±1.36b 160.34<0.001迁移细胞数(个)85.69±8.55 39.65±3.87a 38.46±3.76 73.24±7.33b 131.67<0.001侵袭细胞数(个)70.25±7.23 30.66±3.18a 28.79±2.87 59.68±5.44b 155.60<0.001

图8 Western印迹检测干扰长链非编码RNA(lncRNA)LEF1-AS1 并抑制miR-612 的表达对SCC13 细胞增殖、凋亡、迁移和侵袭相关蛋白表达的影响 cyclinD1、Bcl-2、MMP-2、MMP-9蛋白相对水平,si-LEF1-AS1组低于si-NC 组,si-LEF1-AS1+anti-miR-612 组高于si-LEF1-AS1+anti-miR-NC组;p21、Bax蛋白相对水平,si-LEF1-AS1 组高于si-NC 组,si-LEF1-AS1+anti-miR-612 组低于si-LEF1-AS1+anti-miR-NC组
miRNA 既可作为lncRNA 的靶标,还可作为靶基因的直接上游调控因子,其在癌症中的功能得到普遍认可[10]。miR-612在肝癌、黑素瘤中均表达异常[11-12],发挥调控癌症进展的作用,但在皮肤鳞癌中的作用尚未十分清楚。Kang等[13]在非小细胞肺癌的研究中发现,miR-612 的表达异常降低,且与患者的临床病理分期和淋巴结转移密切相关。另外,过表达miR-612能够抑制非小细胞肺癌细胞的增殖、迁移和侵袭,促进凋亡,阻止裸鼠体内肿瘤的生长,其机制为miR-612 靶向含溴结构域的蛋白4(BRD4)进而抑制PI3K/Akt 信号通路的活性,揭示miR-612/BRD4/PI3K/Akt信号通路在非小细胞肺癌中的功能,提示miR-612可能成为非小细胞肺癌患者抗癌治疗的潜在靶标。Sheng 等[14]在研究中发现,miR-612在结直肠癌组织或细胞中的表达显著降低,并且miR-612 在体外抑制结直肠癌细胞的增殖和迁移,miR-612 直接靶向抑制AKT2,进而抑制下游的上皮-间质转化相关的信号通路,说明miR-612 在结直肠癌的发展中起着关键性的作用。目前,miR-612 在皮肤鳞癌中的功能尚不清楚,我们推测其在皮肤鳞癌中也具有相似的抑癌作用。CyclinD1、p21 均是细胞周期调控因子,CyclinD1 高表达,p21 低表达,提示细胞增殖增多[15]。Bcl-2、Bax 是凋亡相关蛋白,Bcl-2 抗凋亡,Bax 促凋亡[16]。MMP-2、MMP-9是基质金属蛋白酶家族成员,其高表达可促进细胞外基质的降解,促进细胞迁移、侵袭[17]。本研究发现干扰LncRNA LEF1-AS1 表达和miR-612 过表达后,CyclinD1、Bcl-2、MMP-2、MMP-9蛋白表达显著降低,p21、Bax蛋白表达显著升高。表明干扰LncRNA LEF1-AS1表达和miR-612 过表达可抑制皮肤鳞癌细胞的增殖、迁移侵袭,促进凋亡。本研究发现,miR-612在皮肤鳞癌组织中的表达异常降低,过表达miR-612具有与干扰lncRNA LEF1-AS1 相类似的抑制皮肤鳞癌细胞增殖、迁移、侵袭和促进凋亡的作用。
表7 干扰长链非编码RNALEF1-AS1并抑制miR-612的表达对SCC13细胞相关蛋白表达的影响(±s)
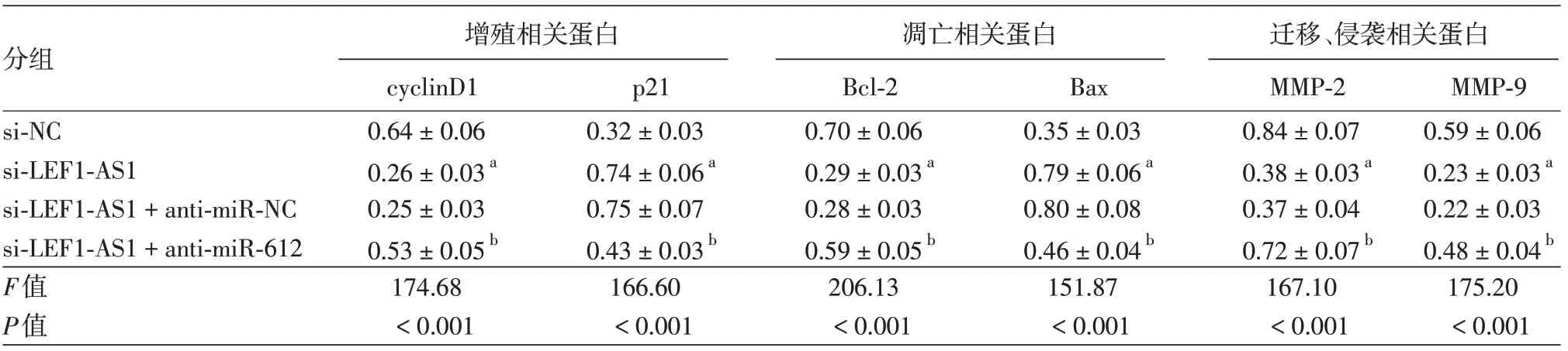
表7 干扰长链非编码RNALEF1-AS1并抑制miR-612的表达对SCC13细胞相关蛋白表达的影响(±s)
注:n=9。注:si-NC:转染lncRNA LEF1-AS1的干扰无意义序列;si-LEF1-AS1:转染lncRNA LEF1-AS1的干扰序列;anti-miR-NC,转染抑制miR-612表达的无意义序列;anti-miR-612,转染抑制miR-612表达基因。a 与si-NC 组比较,P <0.05;b与si-LEF1-AS1+anti-miR-NC 组比较,P <0.05
分组 增殖相关蛋白cyclinD1 0.64±0.06 0.26±0.03a 0.25±0.03 0.53±0.05b p21 0.32±0.03 0.74±0.06a 0.75±0.07 0.43±0.03b凋亡相关蛋白Bcl-2 0.70±0.06 0.29±0.03a 0.28±0.03 0.59±0.05b Bax 0.35±0.03 0.79±0.06a 0.80±0.08 0.46±0.04b迁移、侵袭相关蛋白MMP-2 0.84±0.07 0.38±0.03a 0.37±0.04 0.72±0.07b MMP-9 0.59±0.06 0.23±0.03a 0.22±0.03 0.48±0.04b si-NC si-LEF1-AS1 si-LEF1-AS1+anti-miR-NC si-LEF1-AS1+anti-miR-612 174.68<0.001 166.60<0.001 206.13<0.001 151.87<0.001 167.10<0.001 175.20<0.001 F值P值
我们通过生物信息学预测、双荧光素酶报告基因检测实验验证,lncRNA LEF1-AS1 可靶向作用miR-612,猜测这可能与lncRNA LEF1-AS1在皮肤鳞癌中的功能具有联系。本研究发现,抑制miR-612能够逆转干扰lncRNA LEF1-AS1 对皮肤鳞癌细胞增殖、迁移侵袭和凋亡的调控作用。提示在皮肤鳞癌中,lncRNA LEF1-AS1 可能通过miR-612 发挥调控皮肤鳞癌细胞增殖、凋亡、迁移、侵袭的作用。
利益冲突所有作者均声明不存在利益冲突

