nicastrin基因沉默的HaCaT细胞基因表达谱分析
肖学敏 何艳艳 徐浩翔 王宝玺 林立航
1福建医科大学附属协和医院皮肤科,福州350001;2中国医学科学院 北京协和医学院皮肤病医院,南京210042;3中国医学科学院 北京协和医学院 整形外科研究所皮肤科,北京100144
反常性痤疮(acne inversa,AI;OMIM 142690),又称化脓性汗腺炎,是一种好发于皱褶部位的慢性复发性炎症性皮肤病。2010 年,王宝玺等[1]首先发现编码γ 分泌酶(γ-secretase,GS)不同亚单位的基因突变可引起部分家族性AI 的发生。γ分泌酶包含4 个必要组分,分别为早老素1(presenilin-1,PSEN1)、nicastrin 蛋白(NCSTN)、前咽缺陷蛋白(anterior pharynx defective-1,APH1)和早老素增强子2(presenilin enhancer-2,PEN2)。目前已在AI患者的γ分泌酶基因上发现41个不同的突变位点,其中NCSTN 基因突变27 个,均为功能缺失性突变[2-3]。NCSTN 亚基属于Ⅰ型跨膜糖蛋白,参与γ分泌酶的组装、成熟及稳定,此外还具有募集γ 分泌酶底物的功能,其表达异常可导致γ分泌酶活性和功能受损[4]。目前认为毛囊栓塞为AI 的初始及最主要致病因素,NCSTN 基因功能缺失性突变导致γ分泌酶-Notch信号通路表达及活性受损,进而影响角质形成细胞正常增殖和分化,可能在AI 的发病中发挥重要作用[5]。然而近期的研究显示,某些NCSTN 基因的功能缺失性突变并不影响Notch信号通路的正常活化,说明可能还有其他增殖和分化相关的细胞信号通路参与AI 发病[6]。我们通过沉默人永生化角质形成细胞HaCaT中NCSTN基因的表达,研究其下游细胞增殖及分化相关信号通路的改变。
材料和方法
一、材料
1.主要试剂和仪器:人永生化角质形成细胞株HaCaT 细胞源自美国ATCC 细胞库。胎牛血清、DMEM 培养基、0.25%胰酶(美国GIBCO 公司);Trizol 核酸抽提试剂、Opti-MEM®I 减血清培养基、Lipofectamine®2000 转染试剂(美国Invitrogen 公司);DNA 分子标志物、5 × DNA Loading Buffer、PrimeScript™RT-PCR试剂盒、TaqTMRT-PCR试剂盒(日本TaKaRa 公司);UltraPowerTM核酸染料(北京BioTeke 公司),EvaGreen 染料(美国Biotium 公司);RIPA裂解液、cocktail蛋白酶抑制剂、BCA蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳凝胶配制试剂盒(南京碧云天公司);绵羊抗人NCSTN 多克隆抗体(美国R&D 公司);鼠抗绵羊β肌动蛋白单克隆抗体(美国Santa Cruz 公司)。CO2培养箱、低温高速离心机(美国Thermo 公司),GeneAmp System 9700 PCR 仪、ABI 7300 Real Time PCR仪(美国Applied Biosystems公司)。
2. 引 物 及siRNA:NCSTN - siRNA 由 美 国Invitrogen 公司合成,序列如下:正义链5′-UGUUAUGGAAGGCACCAGAGUGGUC-3′,反义链3′-GACCACUCUCUGGUGCCUUCCAUAACA-5′;另由Invitrogen 公司合成一个标准的错配siRNA(mismatch-siRNA control,m-siRNA)作为阴性对照。实时定量PCR 引物利用Primer5.0 程序设计,由上海生工生物工程技术服务有限公司合成,序列见表1。
二、方法
1.细胞培养及实验分组:将HaCaT 细胞以1×106/ml 接种于25 ml 培养瓶中,放入37 ℃、5% CO2饱和湿度细胞培养箱中,用含10%胎牛血清以及青霉素(100 U/ml)和链霉素(100 mg/L)的DMEM培养基培养。转染前1天,按每孔2×105个细胞接种在6孔板板孔上,当细胞融合度达到30%~40%时,将HaCaT 细胞分为3 组,干扰组转染100 pmol 特异性NCSTN-siRNA,阴性对照组转染等量m-siRNA,空白对照组仅加等量转染试剂,根据Lipofectamine®2000 说明书进行转染。转染后72 h收集细胞进行后续实验。
2.表达谱芯片检测干扰组和阴性对照组全基因组mRNA的差异表达:所用芯片为上海康成生物工程有限公司提供的Agilent 人类全基因组表达谱芯片(4×44K)。干扰组和阴性对照组每组进行3次生物学重复,共6 张芯片。用Trizol 试剂分别提取两组细胞的总RNA,用NanoDrop ND-1000 定量并经变性琼脂糖凝胶电泳检测RNA的完整度。RNA质检合格后,将总RNA 反转录成双链cDNA,再进一步合成用花青素-3-三磷酸胞苷(Cy3)标记的cRNA。将标记好的cRNA 和芯片杂交,洗脱后利用Agilent Scanner G2505C 扫描得到原始图像。采用Feature Extraction 软件(version11.0.1.1)处理原始图像提取原始数据,再使用GeneSpring GX 软件(version11.5.1)进行数据标准化及后续处理。将读取的数据进行归一化处理后筛选出差异表达基因,并对差异表达基因进行基因表达谱本体(GO)分析。
3.实时PCR 验证差异表达基因mRNA 表达的改变:利用与芯片同一批组织样提取RNA 进行荧光定量PCR 验证,选取芯片结果显示差异表达的6条基因即NCSTN、Sprouty相关蛋白2(SPRED2)、表皮生长因子7(FGF7)、胰岛素样生长因子结合蛋白5(IGFBP5)、人Rho 关联含卷曲螺旋蛋白激酶2(ROCK2)和骨形成发生蛋白6(BMP6)基因,以人β肌动蛋白作为内参基因验证芯片结果的可靠性。将样本RNA按PrimeScript™RT-PCR试剂盒说明书反转录合成cDNA,再根据TaqTMRT-PCR 试剂盒说明书进行PCR反应。PCR反应体系包括12 μl预配混合液、正反向引物各1 μl、Taq 酶1 μl、EvaGreen 2.5 μl、cDNA 2.5 μl,加入无核酶水补足至50 μl。将PCR 反应体系置于ABI 7300 Real Time PCR 仪进行实时荧光定量PCR反应。反应条件为95 ℃预变性5 min,95 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s,共40 个循环;72 ℃延伸5 min。采用2-△△Ct法对实时PCR结果进行数据分析,△Ct值表示循环数,△△Ct目的基因=△Ct目的基因-△Ctβ肌动蛋白,目的基因的相对表达量=2-△△Ct。另行琼脂糖凝胶电泳确认扩增反应产物的单一性。
4. Western 印迹法检测细胞NCSTN 蛋白表达的改变:收集干扰组、阴性对照组及空白对照组HaCaT 细胞,冷磷酸盐缓冲液洗涤细胞2 次,加适量预冷的细胞裂解液,4 ℃裂解细胞后收集总蛋白。BCA 试剂盒测定蛋白浓度后取适量变性的蛋白样品,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,90 V电泳20 min,再于130 V电泳50 min后转膜至聚偏二氯乙烯膜上,用含5%牛血清白蛋白的三羟甲基氨基甲烷吐温缓冲液浸泡聚偏二氯乙烯膜,室温摇床封闭2 h。将封闭过的膜加入一抗绵羊抗人NCSTN多克隆抗体(1∶200稀释)4 ℃孵育过夜,用二抗鼠抗绵羊β肌动蛋白单克隆抗体(1∶200稀释)孵育2 h 后进行化学发光显影。以β 肌动蛋白作为内参。用Gel-Pro analyzer 软件分析各条带灰度值,用每组细胞各自的β 肌动蛋白作归一化处理,再将空白对照组作为1,其余以比值表示,代表相对表达量。

表1 实时定量PCR引物序列
5.统计学方法:应用SPSS 22.0 统计学软件进行数据分析,数据以±s 表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间多重比较采用LSD法。P <0.05认为差异有统计学意义。
结 果
一、转染特异性NCSTN-siRNA 后HaCaT 细胞NCSTN mRNA及蛋白表达情况
琼脂糖凝胶电泳显示,转染NCSTN-siRNA 后HaCaT 细胞NCSTN 基因PCR 扩增片段与所设计大小一致,且较阴性对照组及空白对照组表达水平明显下降(图1A)。实时PCR 显示,干扰组NCSTN mRNA 的相对表达量为0.287±0.090,阴性对照组0.969 ± 0.127,空白对照组1.000 ± 0.151,3 组间差异有统计学意义(F =30.787,P=0.001),且干扰组与阴性对照组及空白对照组相比差异都有统计学意义(P 值分别为0.001、0.000)。3 组细胞均表达NCSTN(图1B),干扰组NCSTN 蛋白相对表达量为0.443±0.085,阴性对照组为1.047±0.114,空白对照组为1.000 ± 0.111,3 组间差异有统计学意义(F=31.139,P=0.001),且干扰组与阴性对照组及空白对照组相比差异都有统计学意义(P值分别为0.000、0.001)。上述结果提示NCSTN-siRNA 在mRNA及蛋白水平干扰效率良好,可以单独用于后续试验。
二、RNA质控分析

图1 nicastrin(NCSTN)-siRNA 转染后干扰效率验证 1A:实时PCR 检测各组HaCaT细胞NCSTN mRNA表达;1B:Western印迹检测各组HaCaT细胞NCSTN蛋白表达
分光光度计显示,干扰组与阴性对照组6份样本A260/A280 值均十分接近2.0,A260/A230 值均大于1.8,说明RNA纯度高,达到试验的要求。RNA样品琼脂糖凝胶电泳分析显示,28SrRNA、18SrRNA条带清晰,5SrRNA条带模糊,表明RNA完整性和纯度较好。RNA浓度为861.05 ~1 247.71 mg/L,每管样本共20 μl,样本量充足。
三、差异表达基因、分层聚类图分析
筛选差异表达基因的标准为上调或者下调倍数值≥2.0 且P ≤0.05。芯片结果显示,干扰组NCSTN 基因mRNA 表达水平只有阴性对照组的25%左右,说明干扰效率良好。与阴性对照组相比,干扰组表达下调基因605 个,上调基因444 个。基于两组细胞差异表达基因得到的分层聚类分析图显示,两组间有明显的表达谱差异,而组内无明显差异,证明样本的重复性较好(图2)。
四、GO分析
运用Agilent GeneSpring GX software 对表达谱芯片干扰组与阴性对照组的差异基因进行GO 分析。GO 分析包括生物学过程、细胞成分及分子功能3部分。富集归类图显示,干扰组与阴性对照组之间的差异表达分子在上皮发育、上皮细胞分化、角质形成细胞分化、角化4种生物学过程富集程度排在第1、2、4、5位,角质化包膜、胞外段部分、蛋白胞外基质、胞外段、锚定质膜胞外侧5 种细胞成分富集程度排在第1、3、7、8、10位。见图3。
五、实时PCR验证全基因组表达谱芯片结果
验证结果显示,与阴性对照组相比,干扰组SPRED2、ROCK2 和BMP6 基因表达下调,FGF7 和IGFBP5 基因表达上调,和芯片分析结果中差异表达趋势一致(P <0.01),见图4。
讨 论
由于毛囊上皮细胞的增殖和分化异常是AI的发病基础,我们在芯片的海量信息中主要关注上皮细胞增生分化及相关信号通路的分子表达情况。生物学过程富集归类图显示,干扰NCSTN 基因表达后对上皮发育、上皮细胞分化、角质形成细胞分化、角化4 种生物学过程影响最为显著。提示NCSTN 基因在维持角质形成细胞正常增殖及分化等自稳性的生理过程中发挥作用,干扰NCSTN 基因的表达可能导致角质形成细胞增殖过度及异常分化。细胞成分富集归类图显示,干扰NCSTN 基因表达影响细胞的角质化包膜及胞外段。角质化包膜由多种谷氨酰转移酶共价连接的蛋白组成,发挥皮肤屏障的作用,代表角质形成细胞的终末分化;角质化包膜的改变也说明沉默NCSTN 基因的表达可干扰角质形成细胞的正常分化。而胞外段是NCSTN 基因识别及结合底物的部位,胞外段的改变说明干扰NCSTN基因的表达可损害其识别及结合底物的功能,从而可能影响γ分泌酶复合体的酶解活性。我们筛选出5 条有重要意义的差异表达的细胞增殖分化相关基因进行实时PCR验证,验证结果与芯片检测结果趋势一致,显示芯片结果可信。

图2 干扰组和阴性对照组HaCaT 细胞差异表达基因聚类图分析 横坐标表示样本,纵坐标表示差异基因,红色代表显著上调,绿色代表显著下调;C1 ~C3代表3个阴性对照组样本,N1 ~N3代表3个干扰组样本

图3 NCSTN基因沉默的HaCaT细胞前10位富集程度最高的生物学过程(3A)及细胞成分(3B) 可见角质形成细胞增生分化相关的生物学过程及细胞成分差异基因富集程度最高
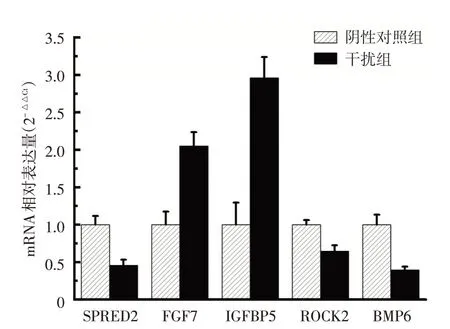
图4 实时PCR 验证表达谱芯片检测出的5 条差异表达基因各基因在干扰组和阴性对照组样本间的表达水平差异均有统计学意义(P <0.01)
Ras-MAPK-ERK 通路在调节角质形成细胞的增殖与分化中发挥重要作用,其异常活化可导致角质形成细胞的过度增殖和异常分化[7]。我们发现Ras-ERK 通路的靶基因SPRED2 的改变,SPRED2同时也是负性调节因子。作为Sprouty(SPRY)蛋白家族的成员,SPRED2可通过抑制Ras的激活,拮抗血管内皮细胞生长因子及FGF 相关信号通路的生物学作用[8]。其中,FGF7 不但能明显刺激表皮角质形成细胞生长,还能促进毛囊和皮脂腺的角质形成细胞生长,是迄今为止发现的最强的角质形成细胞生长因子[9]。FGFR2b与FGF7结合后活化,可调控角质形成细胞的增殖和活化[10]。我们发现干扰组FGF7 表达水平上升。基于上述结果,我们推测NCSTN基因表达下调可通过抑制SPRED2表达,激活Ras-MAPK-ERK介导的受体酪氨酸激酶FGF7-FGFR信号转导通路,导致角质形成细胞的异常增殖和分化。
在胰岛素-胰岛素样生长因子(IGF)信号转导通路中,IGF 家族由于可调控角质形成细胞的增殖、分化、迁移和黏附,参与皮肤肿瘤和银屑病的发生发展[11]。IGF 家族包括IGF-Ⅰ和IGF-Ⅱ两种生长因子,IGF 结合蛋白(IGFBP)可调节IGF 的活性。IGF-Ⅱ可直接结合细胞外基质的玻连蛋白,而IGF-Ⅰ却无法结合。研究表明IGFBP5可使IGF-Ⅰ易于结合玻连蛋白,形成IGF-Ⅰ/IGFBP5/玻连蛋白复合物,从而促进角质形成细胞的增殖和迁移。本研究中,NCSTN基因表达下调可促进IGFBP5的表达,结合文献,推测其可能通过增强与IGF-Ⅰ的结合发挥作用。
丝氨酸/苏氨酸激酶ROCK 是小GTP 酶RhoA的下游效应分子,包括ROCK1 和ROCK2,在调节角质形成细胞黏附和促进其终末分化中发挥重要作用[12]。激活ROCK2的表达可诱导角质形成细胞分化标志的产生[13];使用ROCK分子的选择性阻断剂可完全抑制表皮角质形成细胞分层的形成,说明ROCK 信号通路的表达缺失可抑制角质形成细胞的终末分化[14-15]。因此,NCSTN基因表达下调可能通过抑制RhoA/ROCK2信号通路,抑制角质形成细胞的分化,促进其增殖。
骨形成发生蛋白BMP6属于转化生长因子β超家族成员,该家族成员在调控细胞增殖和分化中发挥重要作用。BMP6可促进角质形成细胞早期分化标记角蛋白1和10的表达,促进角质形成细胞的分化[16]。Gosselet等[17]也发现,BMP6可通过抑制表皮干细胞的增殖,从而阻遏角质形成细胞的增殖,诱导其终末分化,这种作用可能有细胞周期素依赖激酶抑制蛋白P57 的参与。本研究中芯片及实时PCR 结果显示,沉默NCSTN 基因表达后可能通过抑制BMP信号转导通路影响角质形成细胞的正常增殖和分化。
本实验中筛选出的NCSTN 基因干扰组与阴性对照组的重要差异表达基因,较多参与角质形成细胞增殖分化相关信号通路,提示NCSTN 基因功能缺失性突变可导致角质形成细胞异常的增殖分化。差异基因的生物信息学分析为我们今后的研究奠定了基础,后续我们将挑选感兴趣的基因在蛋白水平、原代角质形成细胞和动物模型上做深入的研究,并在人AI皮损中进行验证。
利益冲突所有作者均声明不存在利益冲突

