人骨碱性磷酸酶基因启动子的克隆及高水平尿酸对其活性影响的实验研究*
田民杰,徐华国
(1.南京医科大学第一附属医院检验学部,江苏南京 210029;2.南京市江宁医院检验科,江苏南京 211100)
骨转移是癌症中晚期外源性恶性肿瘤转移至骨组织引起的疾病,常伴随骨痛和骨质损害[1-2]。随着癌症诊疗技术的发展,肿瘤患者生存周期明显延长,骨转移出现的概率也明显增加,疾病的早期发现具有重要价值,可防范或减少错误治疗,提高患者生存质量。目前,骨转移辅助诊断主要依赖影像学技术(如放射核素骨扫描、X线和CT),但缺点在于其特异度不能满足临床需求。而骨代谢相关的血清学标志物具有操作便捷、灵敏度高、动态监测的优点,受到临床医生及科研工作者的广泛关注[3-5],常见标志物如骨碱性磷酸酶(BALP)和抗酒石酸磷酸酶5b(TRACP 5b)。BALP是反映成骨细胞活性及功能的血清标志物,《肺癌骨转移专家共识(2014版)》专门提到BALP在诊断和检测骨转移进展中的应用价值[6]。同时,应用中需要重视BALP检测水平被低估,出现和临床症状不相符的情况,进一步研究发现血清中均含有高水平尿酸(UA)。类似现象还见于笔者前期研究的血清标志物TRACP 5b,TRACP 5b是反映骨吸收代谢的重要血清标志物,在高水平UA条件下TRACP 5b水平受到抑制,出现假性降低的现象[7]。因此,本研究试图通过构建BALP重组质粒,探究高水平UA是否干扰细胞系中BALP的产生及该影响因素产生的分子机制。
1 材料与方法
1.1标本来源 人骨肉瘤细胞(Saos-2细胞)、Hek293细胞、pGL3-basic质粒(对照质粒)、pRL-TK (海肾荧光素酶报告质粒)均源于南京医科大学第一附属医院检验学部实验室保存标本。DMEM培养基和限制性内切酶KpnⅠ、Bgl Ⅱ来自美国Thermo Fisher Scientific公司,胎牛血清和Opti-MEM培养基来自美国Gibco公司。大肠埃希菌DH5a、DL5000 Maker、TaKaRa Ex Taq保真酶和TDNA连接酶均购自大连TaKaRa宝生物公司。基因组DNA提取试剂盒、小量质粒抽提试剂盒、小量切胶回收试剂盒均购自美国Omega公司,琼脂糖购自西班牙GENE公司。质粒转染试剂LipofectamineTM2000 脂质体购自美国Invitrogen公司,双荧光素酶检测试剂盒购自美国Promega公司,UA标准品购自日本奥林巴斯公司。
1.2方法
1.2.1人骨肉瘤细胞Saos-2细胞培养和细胞基因组DNA提取 液氮罐中取出Saos-2细胞冻存管,立即置于水浴箱中解冻复苏。细胞培养液含10%的胎牛血清、100 μg/mL链霉素、DMEM培养基,置于37 ℃ 5%CO2细胞培养箱中培养。每天观察细胞生长及融合情况,每周传代培养两次,保证实验采用对数期生长细胞。通过胰蛋白酶消化处理收集细胞。用细胞基因组DNA提取试剂盒提取Saos-2细胞的DNA,所有步骤严格按照操作手册进行,用分光光度计检测评判DNA的水平和纯度,—20 ℃保存备用。
1.2.2基因启动子的预测和PCR引物设计 使用生物信息学方法借助NCBI基因数据库和UCSC网站,获取人BALP的全基因组序列:ALPL基因(编码:NM_000478.4),进一步预测启动子序列位于ALPL基因的5′端上游区域,设计并合成一对引物用来扩增位于上游-473 bp至154 bp序列的片段(基因转录起始位点为+1位)。引物设计选择Oligo7软件,目的片段所含的Bgl Ⅱ和Kpn Ⅰ两个酶切位点分析借助DNAMAN 5.2.9软件,根据设计引物原则选择评分最高的。上下游引物序列如下,F:5′-GGG GTA CCGTGC AGA GTC AGA GGT GCA CGT-3′(斜体下划线是Kpn Ⅰ酶切位点);R:5′-GAA GAT CTGAGC ACT GGC GAG GGT CCG TCC-3′ (斜体下划线是Bgl Ⅱ酶切位点)。
1.2.3BALP基因5′侧翼启动子序列的PCR扩增 将提取的Saos-2细胞基因组作为DNA模板,根据5′端上游区域设计的引物进行PCR扩增,PCR反应条件设置为:94 ℃预变性5 min,1个循环;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,共30个循环;72 ℃延伸10 min。PCR反应体系:双蒸水37.75 μL,10×PCR缓冲液5.00 μL,dNTP混合液4.00 μL,上下游引物各1.00 μL,模板1.00 μL,TaKaRa Taq 0.25 μL。PCR 扩增产物用1%琼脂糖凝胶电泳鉴定。切下和目的基因大小相同的凝胶条带,用DNA小量胶回收试剂盒对PCR扩增产物进行纯化、回收。
1.2.4BALP基因启动子荧光素酶报告基因重组质粒的克隆 用限制性内切酶Kpn Ⅰ酶和Bgl Ⅱ酶,将已纯化的PCR产物和报告基因质粒PGL3-Basic分别进行双酶切消化,反应条件为37 ℃,水浴酶切2 h。双酶切后的目的基因扩增产物及载体质粒分别在1%琼脂糖凝胶上电泳,用DNA小量胶回收试剂盒纯化,再用T4 DNA连接酶把酶切纯化后的PCR产物和载体质粒黏性末端进行连接,16 ℃水浴连接过夜。取10 μL连接产物加入至100 μL DH5α大肠埃希菌感受态细胞进行转化,将上述悬液100 μL均匀地涂抹于含50 μg/mL氨苄青霉素的LB琼脂培养板平板上,平板倒置于37 ℃恒温培养箱过夜培养。次日挑取生长出来的菌落进行PCR验证,PCR扩增产物进行琼脂糖凝胶电泳分析,菌落的阳性克隆可见约620 bp大小的条带,放大培养,阳性克隆并提取质粒,将BALP基因启动子荧光素酶报告基因重组质粒命名为PGL3-BALP,构建重组质粒模式简图见图1。
1.2.5不同水平UA溶液的配置 将40 mg UA干粉置室温平衡,溶解在1 mol/L的NaOH溶液中,保证UA结晶颗粒充分溶解防止再次析出,若再次出现结晶时加热溶解。取细胞培养液作为稀释时的溶剂及空白对照品,留意调整pH值不宜偏酸。将UA溶液稀释配置成0.2和0.4 mmol/L两种水平备用。
1.2.6BALP基因5′侧翼序列的启动子活性初步鉴定 借助HEK293细胞进行质粒转染,鉴定构建的重组质粒的启动子活性。以每孔2×105个HEK293细胞铺板于48孔板培养,次日细胞生长密度至80%~90%时进行转染,每个质粒设置3个复孔。依据LipofectamineTM2000转染试剂的使用说明书,对照质粒、待测重组质粒和内参照质粒pRL-TK进行瞬时共转染。转染24 h后去除每孔中的培养基,1×PBS轻轻洗涤细胞两次,加入新鲜配制的1×被动裂解缓冲液裂解细胞。采用双荧光素酶检测试剂盒,分别进行待测重组质粒、对照质粒、内参质粒的荧光素酶活性检测,计算荧光素酶活性的比值,即相对荧光素酶强度。

注:右侧方框所示区域为双酶切后插入目的片段区域,构建成新的重组质粒;Ampr为氨苄西林耐药基因。
图1 构建PGL3-BALP重组质粒模式简图
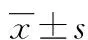
2 结 果
2.1BALP基因启动子荧光素酶报告基因重组质粒的克隆 用Saos-2细胞基因组作为DNA模板,根据5′端上游区域设计的引物进行PCR扩增,产物用1%琼脂糖凝胶电泳鉴定,结果与目的条带大小一致。将获得的重组质粒进行双酶切鉴定,利用Kpn Ⅰ和Bgl Ⅱ限制性内切酶,将双酶切产物进行核酸电泳并观察条带分布。阳性克隆在单个泳道中显示为两个条带:一条大小约5 000 bp(载体质粒片段),另一条约620 bp(目的片段),根据条带位置可以判断与目的片段相同,见图2。将双酶切鉴定为阳性克隆的质粒送外测序分析,将测序公司返回的结果序列输入到在线BLAST核酸比对软件,与ALPL基因的5侧翼区的核酸序列比对结果相同。


注:1为pGL3-basic电泳图,2为重组报告质粒双酶切电泳图,3为DL10000 DNA Maker。
图2 BALP启动子重组质粒酶切后电泳鉴定
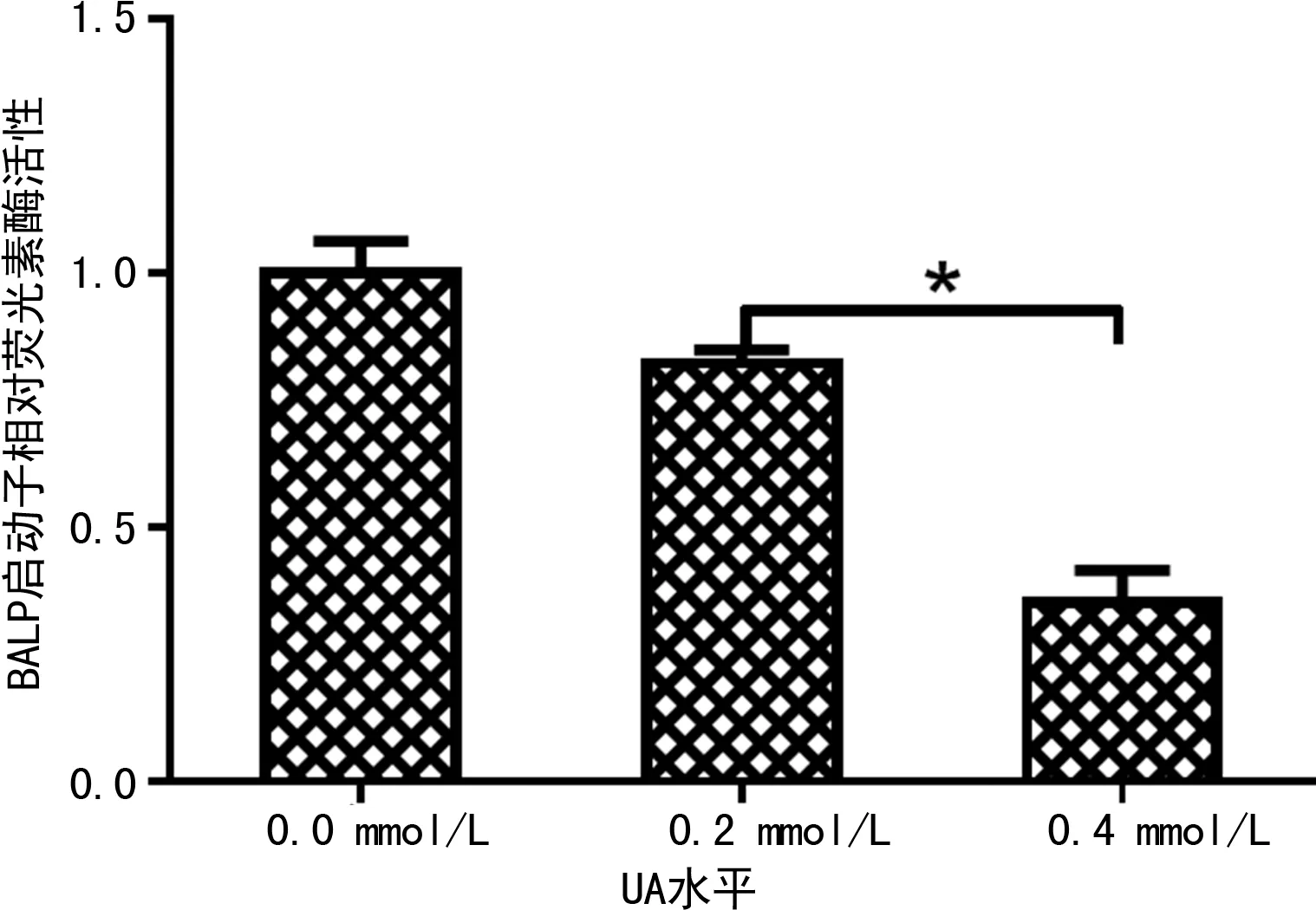
注:加入0.4 mmol/L UA时的相对荧光素酶活性与加入0.2 mmol/L UA时比较,*P<0.05。
图3 人BALP启动子荧光素酶报告基因重组质粒在不同水平UA溶液中的相对荧光素酶活性比较
3 讨 论
BALP来源于成骨细胞,排除了肝、肾、肠道等疾患的干扰,能更特异地反映骨代谢情况,当骨形成大于骨吸收时,血清中BALP活性明显增高,是反映成骨细胞活性及骨形成的敏感指标之一[8]。骨是多种实体瘤的常见转移部位,包括肺癌、乳腺癌、卵巢癌[9-10],骨转换标志物可应用在疾病的诊断、预后和预测过程中[11]。
随着生活水平不断提高,高尿酸血症(HUA)患病率不断增加,我国沿海经济发达地区HUA的患病率超过10%[12-13]。2010-2015年江浙沪皖地区一项基于24家医院的横断面研究发现,江苏地区HUA检出率达14.84%[14]。HUA还与恶性肿瘤的进展、转移相关[15],晚期肿瘤患者放、化疗时会破坏细胞核,UA随之释放增多[16]。UA是嘌呤的终末代谢产物,可清除氧自由基,抑制氧化应激反应[17],使骨细胞内抗氧化能力下降,降低反应骨代谢的相关标志物,抑制破骨细胞的生成[18]。国外研究尝试在老鼠体内建立UA干扰破骨细胞的实验模型,验证UA可以降低破骨细胞内活性氧自由基(ROS)水平,进而影响破骨细胞生成,降低骨转化相关标志物[19]。基于上述研究推测,在人体内可能也存在类似干扰,临床监测患者的BALP需留意HUA的干扰。因此,本实验借助细胞模型来验证高水平UA影响BALP的生成,并探索其影响的机制。
在高水平UA对BALP启动子的干扰实验中,将UA最高水平设置为0.4 mmol/L,这是因为UA水平为0.8 mmol/L时,HEK293细胞的凋亡明显增加,结果重复性差,不稳定。此外,国内学者在体外观察不同水平UA对培养肾小管上皮细胞影响时也有类似发现,0.1 mmol/L UA溶液组(最低水平组)检测肾小管上皮细胞凋亡率已经达到(73.4±11.7)%,且伴随UA水平增加细胞凋亡率呈现剂量依赖性[20]。
本研究借助现有Saos-2细胞系成功构建了人BALP基因启动子荧光素酶基因报告重组质粒,并验证高水平UA对BALP基因启动子活性产生抑制作用。下一步工作尝试探索在其他人骨肉瘤细胞系中(如MG-63、U2SO)同样的实验过程能否具有共性的结论。此外在调控机制中,高水平UA是否作用于BALP基因启动子中的转录因子结合位点而发挥作用,有待进一步研究。
4 结 论
本研究成功构建BALP基因启动子重组质粒,证实高水平UA干扰Saos-2细胞系中BALP的产生。其干扰机制在于高水平UA抑制BALP基因启动子的活性。BALP检测在用于骨转移的早期诊断、预后判断等临床应用时,应注意高水平UA造成的假阴性结果。

