miR-381-5p靶向ERCC4调节乳腺癌细胞顺铂耐药的生物信息学分析
赵永祥 陈 秋 朱玉松
济宁市第二人民医院,山东 济宁 272000
乳腺癌是世界上严重危害女性健康的一种恶性肿瘤,近十年来在中国的发病率也呈上升趋势[1]。对晚期乳腺癌患者,一般采取含顺铂的联合化疗方案[2]。顺铂是一种DNA烷化剂,通过与DNA交联诱导肿瘤细胞凋亡。作为一种广谱抗肿瘤药物,尽管它能对包括乳腺癌在内的多种癌症有效短期治疗,但在一些情况下,疗效持续时间较短,主要原因是癌细胞发展出了顺铂耐药性[3]。明确顺铂作用细胞后,胞内基因组和转录组的变化有利于解决乳腺癌的顺铂耐药问题。
miRNA是真核生物中自然发生的一类小的非编码RNA分子,成熟的miRNAs长约21~25 nt。据预测,miRNA占人类基因组的1%~5%,参与至少30%的蛋白编码基因的转录后调控,影响细胞的发育、分化、增殖、凋亡等多种生物过程[4]。miR-381-5p位于14q32.31染色体,与肿瘤的发生、发展及肿瘤细胞耐药性的产生有密切关系。上皮性卵巢癌耐药组织中miR-381的表达明显高于药物敏感组织[5],miR-381作为内源性的WEE1抑制剂可能增加肾癌细胞对5-FU的化疗耐药性[6]。以上研究表明 miR-381-5p 参与多种肿瘤的化疗耐受。本研究小组前期对乳腺癌细胞 MDA-MB-231的顺铂敏感与耐药细胞系进行了Small RNA 及RNA-seq 测序,对比发现,miR-381-5p在顺铂耐药细胞系MDA-MB-231/ DDP中呈显著高表达水平。 因此,我们推测miR-381-5p 参与了乳腺癌细胞耐受顺铂的过程,但目前国内外尚未有对其分子机制的研究报道。本研究通过生物信息学方法寻找miR-381-5p在此过程中的关键靶基因,旨在为临床上逆转乳腺癌的化疗耐受提供新的靶点。
1 材料与方法
1.1 miR-381-5p 靶基因预测
利用miRBase (http://www.mirbase.org/)、NCBI在线数据库查找 miR-381-5p-3p 的碱基序列、染色体定位、物种保守性等基本信息。应用 RNAhybrid2.1.2(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/%3e)、Miranda3.3a (http://www.microrna.org/)与TargetScan7.0(http://www.targetscan.org/) 这3种在线工具分别预测 miR-381-5p 的靶基因,为降低假阳性率,取3种预测结果的交集组成新的基因集合,用于下一步分析。
1.2 靶基因 Gene Ontology 分析与统计学方法
应用GO公共数据库(http:www.geneontology.org)对miR-381-5p靶基因的分子功能、 生物学过程进行基因本体论(GO)功能分类注释,并对GO功能显著性富集分析。GO注释富集程度P值利用人类基因组为背景,以超几何分步法进行计算,以P<0.05 为显著性阈值筛选富集显著的GO条目。
1.3 miR-381-5p调控基因的筛选与统计学方法
结合顺铂敏感细胞系MDA-MB-231与顺铂耐药细胞系 MDA-MB-231/DDP的转录组分析结果,筛选出在两者中表达有显著性差异的miR-381-5p 靶基因与相关基因。其中差异表达基因的筛选以表达差异倍数(fold change)|log2(fold change)|>1且检验统计量经FDR(false discovery rate,错误发现率)校正后的P<0.05为筛选标准。
2 结 果
2.1 miR-381-5p 靶基因预测
通过 miRBase与Ensemble数据库检索 miR-381-5p发现,基因序列号分别为 MI0000789与ENSG00000199020,染色体定位于14q32.31(NC_000014.9,101045920 ~ 101045994))。我们前期对乳腺癌敏感与耐药细胞系的Small RNA 测序结果发现,miR-381-5p的在耐药细胞系中的表达量显著升高,是敏感细胞系的39倍,这表明miR-381-5p很可能参与了乳腺癌细胞对顺铂的耐受过程。本研究运用3种生物信息学在线软件对miR-381-5p 的靶基因进行了预测,结果RNAhybrid2.1.2软件预测得到了5 536个靶基因,Miranda3.3a软件预测得到了4 973个靶基因,TargetScan7.0 软件预测得到了5 536个靶基因。为使结果更加精确,我们对 3 种预测结果进行交集进而获得了52个交集靶基因,基因ID与基因名等信息如表1所示。
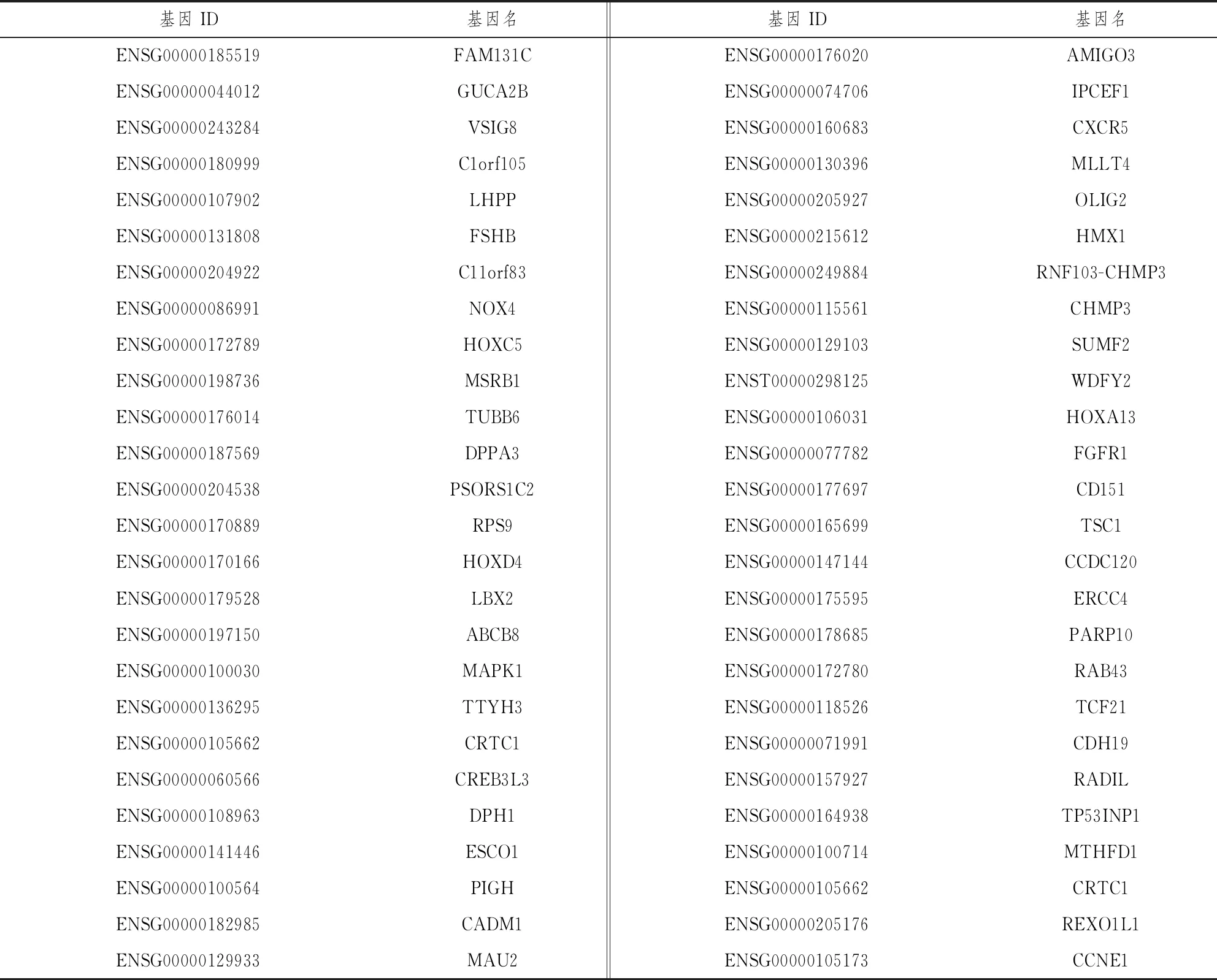
表1 miR-381-5p 靶基因
2.2 miR-381-5p 靶基因的GO分析
为了深入了解miR-381-5p在MDA-MB-231耐药细胞中的具体功能,我们对上述52个交集靶基因进行了GO分子功能、GO生物过程的分析。从结果可得出:靶基因的分子功能集中于蛋白质N端结合、蛋白质同源二聚化活性、转录因子结合、双链DNA结合等(P<0.01) ,见表 2。靶基因生物学过程集中于同型半胱氨酸代谢过程、细胞生物合成过程的调控、核染色体隔离等(P<0.01) ,见表 3。
肿瘤细胞顺铂耐药性的产生有多种机制,包括以下几个方面:细胞内顺铂被还原性物质谷胱甘肽(glutathione, GSH)解活、细胞内顺铂的转运与泵出使药物累积量减少、顺铂引起的DNA损伤被修复系统修复等[7]。半胱氨酸是GSH合成最重要的原料之一,细胞内同型半胱氨酸水平升高时,可通过对γ-谷氨酰半胱氨酸合成酶的抑制而明显降低胞内GSH的水平。GSH可以与顺铂结合导致药物失活而产生耐药性[8]。同时细胞内药物的转运与泵出需要一些生物大分子的合成,如细胞膜上的人类铜转运蛋白1(hCTR1)及ABC 转运子(ATP binding cassette transporter)等。与敏感细胞系相比,耐药细胞系CTR1 的表达明显降低,使顺铂的摄取减少,ABC转运子的表达明显升高,使顺铂的外排增多,都可导致耐药性的产生[9]。以上结果表明, miR-381-5p 的靶基因在还原性物质合成及药物的转运蛋白合成等过程中具有重要的生物学功能。

表2 miR-381-5p 靶基因的 GO 分子功能富集分析

表3 miR-381-5p 靶基因的 GO 生物学过程富集分析
2.3 miR-381-5p 调控基因的筛选
对生物信息学分析得到的miR-381-5p的52个交集靶基因,我们查询了前期对乳腺癌敏感与耐药细胞的转录组分析结果,总结了它们在两个细胞系中的表达变化,并筛选了表达有显著性差异的基因,结果如图1所示。图中,表达下调、上调及表达无显著差异的靶基因分别用绿色、红色和蓝色散点来表示。当细胞内miRNA表达后,可被装载到RISC复合物中,发挥其基因表达调控的作用。miRNA的作用效果主要有3种:转录抑制与mRNA的切割或降解。miRNA行使功能主要依靠这三种方式抑制下游基因表达,减弱或消除下游基因的功能,以这种间接方式来实现对细胞生命过程的调节。因此,miR-381-5p调控的基因理论上都会受到抑制或者发生降解,而导致其表达水平发生下降。MDA-MB-231DDP 细胞中表达水平降低的miR-381-5p 靶基因有LHPP、HOXC5、LBX2、ERCC4、CREB3L3、IPCEF1、CD151、RAB43、TCF21与MTHFD1这10个,其中DNA 切除修复交叉互补基因 4 (excision repair 4, endonuclease catalytic subunit,ERCC4)表达量降低最为明显,仅约为MDA-MB-231顺铂敏感细胞系的十分之一(图2A)。ERCC4是参与DNA碱基切除修复(nucleotide excision repair,NER)的关键蛋白。顺铂对DNA产生损伤后,ERCC4表达升高并识别碱基损伤部位,招募其他蛋白如XPC、 DDB1、CSB、 hHR23B等启动NER[10]。在我们前期的测序结果中发现,NER途径中的这些关键蛋白质表达同样升高(图2B)。这也证明了miR-381-5p的表达异常可通过影响DNA的碱基切除修复能力而影响肿瘤细胞对顺铂治疗的耐受性。
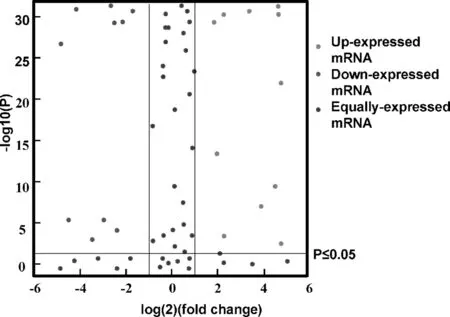
图1 miR-381-5p靶基因的差异表达情况

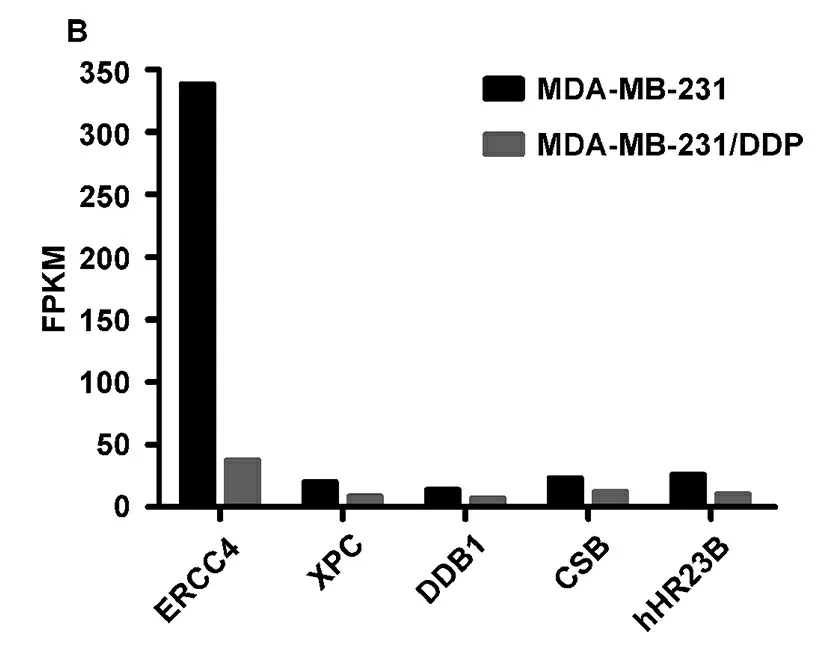
图2 表达下调靶基因及NER相关基因的mRNA在细胞中的表达情况
3 讨 论
近年来,miRNA介导的转录后基因沉默与肿瘤耐药性的相关性已成为关注的热点。肿瘤细胞接受化疗后,其miRNA的表达谱会发生明显的变化。且肿瘤耐药相关的易变基因组中也发现miRNA的高频率出现,miRNA的变化是许多靶基因表达调控的始动因素,提示miRNA在肿瘤细胞形成药物耐受过程中扮演着重要角色[11]。
顺铂是晚期乳腺癌患者常用的化疗药物之一,但是疗效欠佳,可能原因是乳腺癌细胞对顺铂产生了耐药性。为探讨乳腺癌细胞的顺铂耐药机制,本研究利用高通量RNA-seq二代测序筛选了乳腺癌MDA-MB-231 和MDA-MB-231DDP细胞株之间差异表达的RNA数据,结果显示 miR-381-5p 在 MDA-MB-231DDP 中呈高表达状态。这表明miR-381-5p 的异常高表达参与了与乳腺癌顺铂耐药的发生发展,因此本研究对 miR-381-5p的靶基因进行了预测,以期了解其靶基因分子功能并分析其参与的生物学过程。结果显示miR-381-5p 靶基因主要有蛋白质N端结合、转录因子结合、双链DNA结合等分子功能。 同时其靶基因可能影响了耐药细胞同型半胱氨酸代谢过程、细胞生物合成过程的调控、核染色体隔离等重要生命过程。另外,本研究发现,耐药细胞系MDA-MB-231DDP 中受miR-381-5p负调控的靶基因有10个,其中ERCC4的表达水平降低最为显著,表明ERCC4可能在乳腺癌顺铂耐药中起最关键的调节作用,ERCC4是 DNA 损伤修复系统的关键蛋白。铂类药物进入细胞后可与DNA交联引发DNA 损伤,ERCC4表达水平的改变可影响DNA损伤的碱基切除修复能力,从而使细胞产生对铂类药物的耐药性。
综上所述,本研究表明乳腺癌细胞中miR-381-5p的异常高表达可能下调ERCC4的表达导致乳腺癌细胞对顺铂产生耐药,这一结果为 miR-381-5p 的机制研究提供了可靠的理论基础,为将来逆转乳腺腺癌的化疗耐受提供了新的靶点。

