miR-17-5p通过IL-6/STAT3信号通路对髓核细胞外基质降解的调控作用
夏新成 周 涛
安徽医科大学马鞍山临床学院,安徽 马鞍山 243000
流行病学统计表明,随着经济社会的发展,世界范围内的下腰痛患病率逐年递增,已经超过脊髓损伤,成为致残率最高的疾病之一[1]。尤其是随着生活工作方式的改变以及人口老龄化的进程不断推进,该疾病必将对社会经济造成不可避免的重大损失。而造成下腰痛最主要的根本原因是椎间盘退行性变(简称椎间盘退变)[2]。
椎间盘退变是一个复杂的病理生理过程,是由椎间盘髓核细胞、细胞外基质及椎间盘生物力学之间相互作用,从而形成一个闭合的恶性循环过程,并不断促进椎间盘退变的发展[3]。其中细胞外基质的改变是椎间盘退变的核心环节,而炎症介质在细胞外基质改变的过程中起到了关键作用[4]。白介素-6(interleukin-6,IL-6)是一类促炎细胞因子,是JAK/STAT3信号通路的起始因子。研究证实,其在椎间盘退变进程中可促进髓核细胞外基质降解,且血清IL-6的水平与椎间盘退变引起的下腰痛密切正相关[5]。此外,IL-6能够激活髓核细胞和纤维环细胞中的信号转导体及转录激活因子3(STAT3),从而增加基质金属蛋白酶(MMPs)如MMP-3等的表达,诱导椎间盘退变的发生和发展[6-7]。
MicroRNAs(miRNAs)是一类非编码的内源性单链RNA,长约19~25 nt,通过靶向降解mRNA或抑制其翻译来发挥生物学作用[8]。研究发现,miRNAs在椎间盘退变进程中表达异常,在调控椎间盘退变中发挥着重要的作用。如miR-194-5p通过CUL4A 和 CUL4B可以调控椎间盘的退变过程[9];miR-93通过MMP3在髓核细胞内调控胶原纤维的丢失[10]等。已有研究发现,miR-17-5p在多种疾病中具有重要作用,如其能够靶向结合mcl1和STAT3进而调控结核分枝杆菌感染巨噬细胞的自噬[11]。Zhao等[12]也报道了miR-17-5p通过靶向SRCIN1促进骨肉瘤中细胞的增殖和上皮瘤变。然而miR-17-5p在椎间盘退变中的作用及潜在机制尚未研究。
因此,本研究旨在探究miR-17-5p在椎间盘退变过程中的作用及其与IL-6介导的IL-6/STAT3信号通路的联系。
1 材料与方法
1.1 材料
1.1.1主要试剂 GAPDH抗体(KC-5G5, 武汉星康城生物科技有限公司),BCA蛋白检测试剂盒(Pierce, Appleton, WI, USA),miR-17-5p mimic与inhibitor及阴性对照(上海吉玛制药技术有限公司),IL-6(上海碧云天生物技术有限公司),RIRA裂解液(上海碧云天生物技术有限公司),RNA快速提取试剂盒(北京百泰克生物技术有限公司),IL-1、IL-6和TNF-α ELISA检测试剂盒(C10327, 广州市锐博生物科技有限公司),p-STAT3抗体(dilution, 1∶500; cat. no. AMAB90787)、MMP-2(dilution, 1∶500; cat. no. SAB530144),Aggrecan、Collagen I和Collagen II蛋白定量试剂盒(23235,赛默飞世尔科技公司),Trizol溶液(B511321,上海捷瑞生物工程有限公司),SuperSignal West Dura Extended Duration Substrate发光底物试剂盒(Millipore, MA, USA),Takara RNA PCR试剂盒(C507329, 宝生物工程(大连)有限公司)和Oligo dT引物(赛默飞世尔科技有限公司),其他试剂均为国产分析纯。
1.1.2主要仪器 NanoDrop 2000 设备(Thermo Fisher Scientific, Rockford, IL, USA),Light Cycler 480设备(Roche, Switzerland),荧光显微镜(德国徕卡),实时荧光定量PCR仪(ABI,美国)。
1.2 方法
1.2.1样本收集 本研究中使用的实验组临床骨组织样本来源于2017年7月—2019年3月就诊于本院脊柱科的5例椎间盘退变患者,其中男性患者2例和女性患者3例,年龄42~62岁,中位年龄51岁。对照组5例,来源于因爆裂性骨折行融合内固定手术的患者,年龄26~35岁,中位年龄30岁。所有参与该项研究的患者都签署了知情同意书,并获得本院伦理委员会审核批准。术前均依据MRI的T2加权像进行Pfirrmann分级。收集的髓核标本于术后用液氮临时保存,在实验室的无菌环境下快速分离和去除纤维环组织,保留髓核组织,于-80℃超低温冰箱保存。
1.2.2细胞培养与处理 原代细胞使用DMEM培养基在37℃恒温恒湿细胞培养箱中,湿度保持95%,5%CO2,进行细胞培养,第2天更换新鲜细胞培养液继续培养,并观察细胞复苏生长情况。选取进行传代培养3~5代后的细胞。在培养出正常髓核细胞系后使用10 ng/ml IL-6处理24 h,qPCR检测IL-6处理前后髓核细胞系中miR-17-5p、IL-1、TNF-α和MMP-3的表达水平。此外,用miR-17-5p mimics、miR-17-5p inhibitor和对照(空白对照)分别处理培养的髓核细胞,操作流程参照Lipofectamine 2000(USA, Invitrogen)说明书进行。
1.2.3RT-PCR分析 上述样本用RNA快速提取试剂盒按照说明书提取总RNA,用NanoDrop 2000定量后用Takara RNA PCR反转录试剂盒获得cDNA,并以此为模板进行PCR反应,反应条件如下:在95℃变性10 min,接着进行40个循环(条件为95℃持续10 s,60℃持续20 s,72℃持续30 s)。在Light Cycler 480设备检测相关基因的表达。每个实验均重复3次。以GAPDH或U6为内参,实验数据采取2-ΔΔCT方法进行标准化和分析[13]。引物序列见表1,并由生工生物(上海)股份有限公司合成。

表1 PCR引物序列列表
1.2.4Western blot实验 用RIRA裂解液裂解组织并提取总蛋白。用BCA蛋白检测试剂盒检测蛋白浓度。12.5% SDS-PAGE分离总蛋白并转至硝酸纤维素膜后,以抗GAPDH抗体为一抗作为对照,用抗ACAN、COL2A1、p-STAT3、MMP-2抗体按照1∶1000的比例稀释后,与硝酸纤维素膜一起在4℃中孵育过夜。TBST缓冲液洗涤(3次,5 min/次)硝酸纤维素膜后,再加入HRP-交联的IgG二抗,室温下孵育1 h,TBST缓冲液洗涤(3次,5 min/次)后取出硝酸纤维素膜。按照SuperSignal. West Dura Extended Duration Substrate发光底物试剂盒说明书进行显影和定影。选择Bandscan5.0软件分析电泳条带的光密度值,每个实验重复3次。并根据灰度值进行半定量统计学分析。

2 结 果
2.1 miR-17-5p的表达及其临床相关性分析
我们收集了10例在我院就诊患者的髓核组织样本,其中5例因爆裂性骨折行融合内固定手术的患者正常髓核组织样本作为对照组,同时提取两组病人髓核组织的总RNA样本,经逆转录并通过RT-PCR检测miR-17-5p的表达水平。结果表明,5例椎间盘退变的髓核组织中miR-17-5p的表达水平(4.51±1.05)显著低于对照组(7.15±1.18),t=3.732,P=0.006(图1a)。对所有样本依据Pfirrmann分级后进行相关性分析,表明miR-17-5p表达与椎间盘的退变呈负相关(r=-0.95,P<0.01,图1b,表1)。

图1 miR-17-5p在IDD和NC中的表达水平,且与Pfirrmann分级呈负相关(**P<0.01)

表1 miR-17-5p的表达量与Pfirrmann分级的相关性
2.2 IL-6对miR-17-5p、IL-1、TNF-α和MMP-3表达的影响。
为模拟IL-6/STAT3炎症信号通路,本研究采用IL-6处理髓核细胞,并用RT-PCR检测了IL-6处理对miR-17-5p、IL-1、TNF-α和MMP-3表达的影响。结果表明,IL-6处理显著降低了miR-17-5p的表达(P<0.05,图2A,表3),而升高了IL-1、TNF-α和MMP-3的水平(P<0.05,图2B~D,表2)。

A. miR-17-5的表达;B. IL-1的表达;C. TNF-α的表达;D. MMP-3的表达。与CON组相比,*P <0.05,**P<0.01。
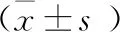
表2 miR-17-5p、IL-1、TNF-α和MMP-3在两组中表达对比
2.3 miR-17-5p对IL-1、IL-6和TNF-α表达的影响
我们通过RT-PCR分析了髓核细胞外炎症介质IL-1、IL-6和TNF-α的表达情况,发现IL-1、IL-6、TNF-α水平在miR-17-5p inhibitor组转染的髓核细胞中显著增高(P<0.01),而在miR-17-5p mimics组转染后的髓核细胞中显著降低(P<0.01),如图3、表3a和表3b所示。

A. miR-17-5p的表达水平;B. IL-1的表达水平;C. IL-6的表达水平;D. TNF-α的表达水平(**P<0.01)。
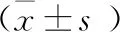
表3a miR-17-5p、IL-1、TNF-α和IL-6在两组中表达对比
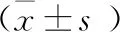
表3b miR-17-5p、IL-1、TNF-α和IL-6在两组中表达对比
2.4 miR-17-5p对ACAN、COL2A1、p-STAT3和MMP-2表达的影响
为了分析miR-17-5p对髓核细胞外基质如蛋白聚糖(ACAN)、II型胶原蛋白(COL2A1)及其IL-6/STAT3炎症信号通路的下游蛋白p-STAT3和MMP-2的影响,我们用Western blot检测了上述分子的表达情况。结果如图4所示,ACAN、COL2A1的水平在miR-17-5p inhibitor组中明显下降,而在miR-17-5p mimics组中显著增加;此外,p-STAT3和MMP-2则出现相反的表达趋势。

图4 miR-17-5p对ACAN、COL2A1、p-STAT3和MMP-2表达的影响
3 讨 论
越来越多的证据表明,miRNAs参与调节髓核细胞外基质的代谢平衡,并在椎间盘退变的过程中至关重要,其表达失调可影响椎间盘退变的进程[14]。已有研究表明,miR-17-5p在多个组织中存在差异表达,是多种疾病的重要调控因子[11-12]。本研究的结果表明,退变髓核组织中miR-17-5p表达显著低于正常的髓核组织,说明miR-17-5p低表达与椎间盘退变具有高度相关性,且随着Pfirrmann分级的升高,miR-17-5p的表达越低,呈负相关性。
研究表明,椎间盘退变的过程与多种病理生理过程如炎症、氧化应激、凋亡、自噬等密切相关,其中炎症和凋亡起到了关键的作用[15];IL-6/STAT3炎症信号通路在多个组织系统中参与免疫炎症反应[16]。基于此,我们首先使用IL-6处理髓核细胞,模拟激活IL-6/STAT3炎症信号通路,并检测了miR-17-5p、IL-1、TNF-α和MMP-3的表达水平,发现IL-6处理导致髓核组织中IL-1、TNF-α和MMP-3表达显著增加,而miR-17-5p表达显著下降,提示IL-6/STAT3炎症通路参与髓核组织的退变过程。该结果与Ji等[17]的研究相一致,后者证实在椎间盘退变疾病中IL-6/STAT3炎症信号通路的激活伴随着miR-17-5p表达变化,二者可以相互影响,并且存在负相关性。
为了探究IL-6/STAT3与miR-17-5p之间的潜在作用机制,我们进一步用miR-17-5p的inhibitor和mimics处理髓核细胞并分析了炎症介质(IL-1、IL-6、TNF-α)的表达。结果发现,抑制miR-17-5p后能够促进炎症介质(IL-1、IL-6和TNF-α)和IL-6/STAT3信号通路的下游分子p-STAT3和MMP-2的表达,而ACAN和COL2A1的表达则受到抑制。相反,升高miR-17-5p的水平则显著抑制了炎症介质(IL-1、IL-6和TNF-α)的释放和p-STAT3、MMP-2的表达,同时促进ACAN和COL2A1的表达。上述结果提示,椎间盘退变过程中,miR-17-5p低表达激活了IL-6/STAT3炎症通路,且其表达水平与炎症介质(IL-1、IL-6、TNF-α)的释放和髓核细胞外基质ACAN和COL2A1的生成具有密切相关性,即miR-17-5p低表达在椎间盘退变过程中能够促进炎症介质的释放,从而减少蛋白聚糖、II型胶原蛋白的生成,证明miR-17-5p在椎间盘退变中调控髓核细胞外基质降解。
尽管如此,同其他相关研究一样[18-19],本研究仍有不足之处。(1)本研究纳入的髓核组织是来自不同的年龄段,年龄差异是否影响上述基因的表达未在本研究中探讨;(2)本研究仅检测了临床样本的miRNA-17-5p的水平,未同时检测IL-1、IL-6和TNF-α表达,后续研究需进一步探究样本中IL-1、IL-6和TNF-α的表达与miRNA-17-5p的相关性及其临床意义。
综上所述,本研究揭示了miR-17-5p在椎间盘退变中的调控作用及其潜在作用机制,有助于深入了解椎间盘退变的病因,深化我们对于椎间盘退变的发病机制及其分子调控网络的认识,为进一步研究椎间盘退变的机制,提供了体外试验基础。

