基于密度泛函理论的锂辉石晶体结构及(110)面表面化学基因特性研究
谢瑞琦 朱一民 刘 杰 李艳军 1
(1.东北大学资源与土木工程学院,辽宁沈阳110819;2.难采选铁矿资源高效开发利用技术国家地方联合工程研究中心,辽宁沈阳110819;3.东北大学基因矿物加工研究中心,辽宁沈阳110819)
锂辉石是重要的锂资源之一,随着近年来新型能源汽车及电子设备的快速发展,锂需求量越来越大,因此,高效开发和利用锂辉石具有重要意义[1-2]。与锂辉石伴生的常见脉石矿物主要有钠长石、石英等,浮选是将锂辉石与其脉石矿物分离最常用的方法[3]。但由于石英、钠长石等脉石矿物与锂辉石均属于硅铝酸盐矿物,表面性质相似,尤其是钠长石,其化学成分与锂辉石极为相近。因此,锂辉石较难与其脉石矿物分离[4]。
为了更有效地将锂辉石与其脉石矿物分离,研发高选择性的浮选药剂具有重要意义,而浮选药剂的选择性与矿物表面特性息息相关,这些矿物表面特性正如“基因”一样,基于矿物“基因”设计和研发浮选药剂,是提高药剂选择性的有效手段之一。
采用量子化学计算方法研究矿物晶体表面特性已经越来越受到科研工作者的重视,目前已有很多研究者利用理论计算研究浮选药剂作用机理[5-7]。但量子化学在锂辉石浮选研究中的应用还较少。Yu Fushun[8]利用第一性原理研究了以油酸钠作为捕收剂浮选锂辉石时,钙离子的活化机理。Xu Longhua[9]计算了锂辉石(110)面、(001)面和(100)面的表面能,确定了(110)面是锂辉石最常见解理面。目前,未见基于第一性原理对锂辉石表面特性进行深入研究的报道。
本文利用Material Studio的CASTEP模块构建了锂辉石晶胞,基于密度泛函理论的第一性原理方法模拟计算了锂辉石的布居、能带及态密度,并将优化后的锂辉石晶胞沿米勒指数(110)方向切割晶胞,计算了锂辉石(110)面的表面能,并对其进行了弛豫、布居、态密度及电荷差分密度分析。深入分析研究了锂辉石晶体表面特性,为研发高选择性锂辉石浮选药剂提供参考。
1 模拟与计算方法
1.1 锂辉石晶胞的构建及优化
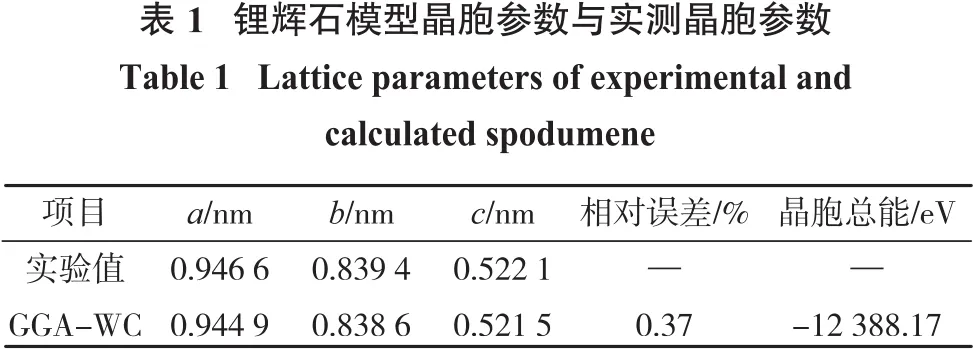
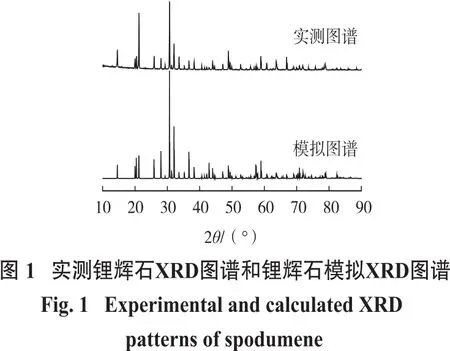
利用Materials Studio软件的CASTEP模块对锂辉石晶胞结构进行优化,设置交换相关泛函为GGAPBE,k点取样密度为3×3×4,截断能为340 eV,赝势为超软赝势。自洽迭代过程中的收敛标准为:能量最大变化不超过2×10-5eV,原子最大位移不超过0.000 2 nm,原子间内应力不超过0.1 GPa,SFC收敛标准为1×10-6eV。最终优化得到的锂辉石晶胞参数与试验检测值对比如表1所示。经过优化的锂辉石晶胞参数为a=0.944 9 nm,b=0.838 6 nm,c=0.521 5 nm,α=90.00°,β=110.10°,γ=90.00°。将优化完的晶胞模型的XRD图与锂辉石纯矿物XRD图进行对比(图1),模拟的XRD图特征峰与检测图谱中的基本吻合。因此,该锂辉石模型与实际情况吻合,通过分析模型的晶体结构性质能够代表锂辉石矿物的性质。
1.2 表面能计算
物质生成新的表面,需要外力对其作功,破坏表面原子与相邻原子之间的化学键,该过程所需要的功大小的一半即为表面能,表面能越低,该表面的性质越稳定。表面能以式(1)所示公式计算[10]。
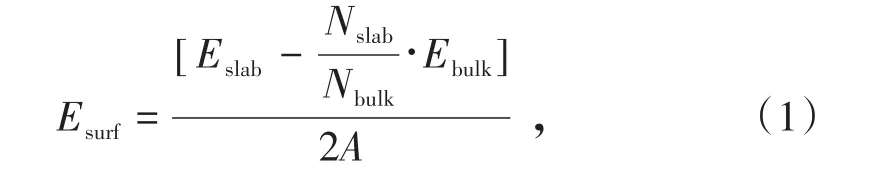
式中,Esurf为表面能,J/m2;Eslab为表面结构的总能量,J;Ebulk为矿物晶胞的总能量,J;Nslab为表面结构中的原子数目;Nbulk为优化后的矿物晶胞中的原子数目;A为计算表面的面积,m2。
1.3 表面模型建立
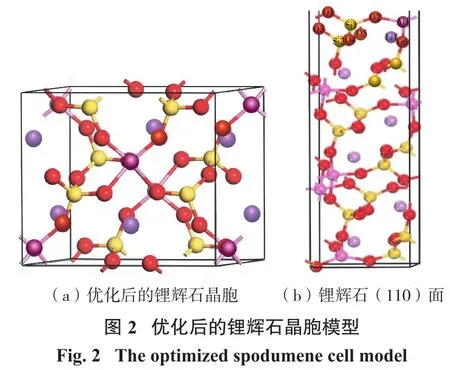
根据文献[9]报道确定(110)面为锂辉石最稳定表面,因此本文在优化后晶胞上沿米勒指数(110)方向切割晶胞,当锂辉石切割层数为3,真空层厚度为1.5 nm时,切面足以维持稳定的表面性能,且上下两底面间干扰不大,若切割层和真空层厚度数继续增加,表面的稳定性变化不大,但计算时间明显延长,因此本文选择切割晶胞层数为3,真空层厚度为1.5 nm的(110)表面slab模型[9]。优化后的锂辉石晶胞及优化后的锂辉石(110)表面如图2所示。
2 计算结果与讨论
2.1 锂辉石晶体分析
2.1.1 布居分析
锂辉石的原子布居结果如表2所示。

从表2可以看出:锂辉石中荷正电的原子主要为Al、Si、Li,荷负电的原子为O;优化后的 Al的价电子构型为Al 3s0.473p0.85,s轨道失去了1.53个单位的电子,p轨道失去了0.15个单位的电子,主要是3s轨道失去电子,Al所带电荷为1.69 e;优化后的Si价电子构型为Si 3s0.633p1.27,s轨道失去了1.37个单位的电子,p轨道失去了0.73个单位的电子,主要是3s轨道失去电子,所带电荷为2.10 e;Li只有s轨道参与反应,所带电荷为1.12 e;优化后的O存在3种价电子构型,第1种为O 2s1.852p5.29,s轨道失去了0.15个单位的电子,p轨道得到1.29个单位的电子,主要是p轨道得到电子,所带电荷为-1.15 e;第2种为O 2s1.842p5.35,s轨道失去了0.16个单位的电子,p轨道得到1.35个单位的电子,主要是p轨道得到电子,所带电荷为-1.19 e;第3种为O 2s1.832p5.34,s轨道失去了0.17个单位的电子,p轨道得到1.34个单位的电子,主要是p轨道得到电子,所带电荷为-1.17 e。
矿物Mulliken键布居值越接近0说明键的离子性越强,越接近1表明键的共价性越强[11]。锂辉石的键布居如表3所示。
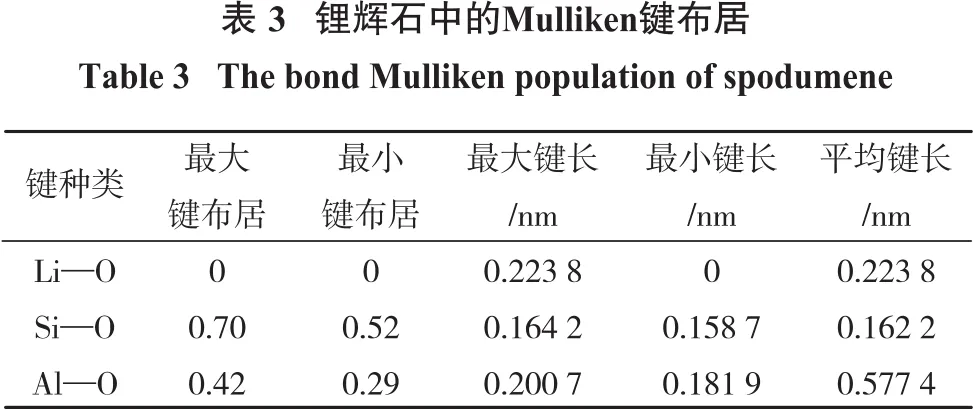
由表3可以看出:Al—O键和Si—O键具有不同的布居值和键长,这是由于锂辉石晶体结构复杂所造成的;锂辉石中Li—O键为离子键,Si—O键具有较强的共价性,因此破碎磨矿时,Li—O键最易断裂,其次是Al—O键,最后是Si—O键。由于锂辉石表面的Li易溶于水,因此,Al为锂辉石表面的最可能的荷正电的活性位点。
2.1.2 能带和态密度分析
由计算可知,锂辉石的能带间隙宽度为5.77 eV,因此锂辉石为绝缘体[12]。图3所示是锂辉石各原子的分态密度图和总态密度图。
由图3可知:锂辉石的能带主要分为4部分;第1部分为-44~-41 eV之间,这部分基本完全由Li的s轨道组成;第2部分为-20~-15 eV之间,这部分主要由O的s轨道组成,同时,Si和Al的s轨道和p轨道对该部分价带也有少量贡献;第3部分为-10~0 eV之间,该部分与-20~-15 eV之间的价带类似,主要由O的s轨道组成,同时有少量的Si和Al的s轨道和p轨组成,不同点在于该部分有少量的Li的s轨道贡献;最后,0 eV至20 eV之间的导带能级所有原子都有轨道参与贡献。费米能级附近的电子活性最强[13],O的p轨道在费米能级附近的态密度贡献最大,因此O是锂辉石中最活跃的原子,其次依次是Si和Al,但由布居分析可知,Si—O键在破碎磨矿时较Al—O键难断裂,因此Al为锂辉石表面的最可能的荷正电的活性位点,O为锂辉石表面的最可能的荷负电的活性位点。此外,由布居分布可知,锂辉石中有3种不同价电子构型的O,分别为O1、O2和O3。由3种O的分态密度图可知,在费米能级附近的态密度贡献最大的是O2的p轨道,其次是O1的p轨道,O3的p轨道贡献较小。因此3种O中,活性从大到小依次是O2、O1和O3。
2.2 锂辉石(110)表面特性
2.2.1 锂辉石(110)面的表面能

优化后的锂辉石(110)面的表面能按式(1)计算,计算结果如表4所示,所构建的锂辉石(110)面的表面能为0.342 9 J/m2。

2.2.2 锂辉石(110)面的结构弛豫
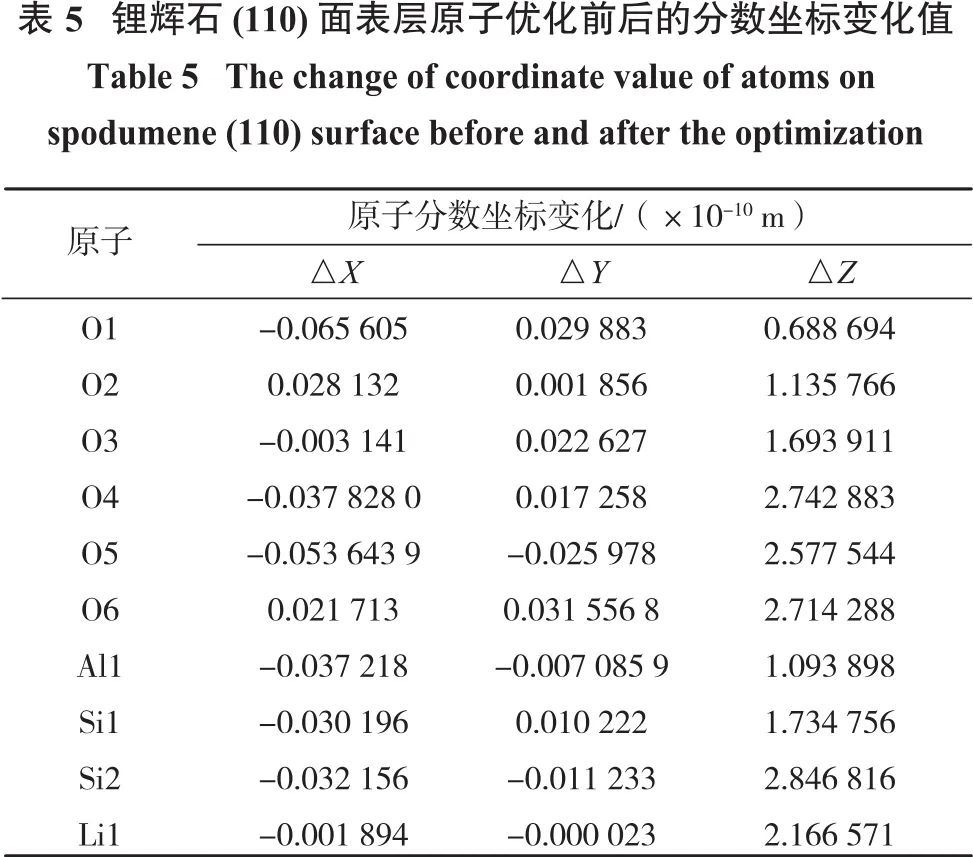
锂辉石晶体中原子呈周期性分布,而在晶体表面,由于周期性排列中断,锂辉石表层的原子受力不再平衡,表面原子通过弛豫而发生重构现象使体系达到新的平衡[14-15]。锂辉石(110)面表层原子优化前后的分数坐标变化值如表5所示。
由表5可知:锂辉石的表层原子在优化以后,均产生了弛豫现象。Z轴方向的弛豫相对最明显,其次是X轴方向,Y轴方向的弛豫相对较弱。其中,在X轴方向弛豫最明显的3个原子为O1、O5、O4,在Y轴方向弛豫最明显的3个原子为O6、O1、O5,在Z轴方向的弛豫最明显的3个原子为Si2、O4、O5。
2.2.3 锂辉石(110)面的布居分析
由于表面原子之间的相对位移以及配位数的变化,原子外层电子随之变化,键长也发生改变。表6为锂辉石(110)面表层原子的Mulliken布居分布。
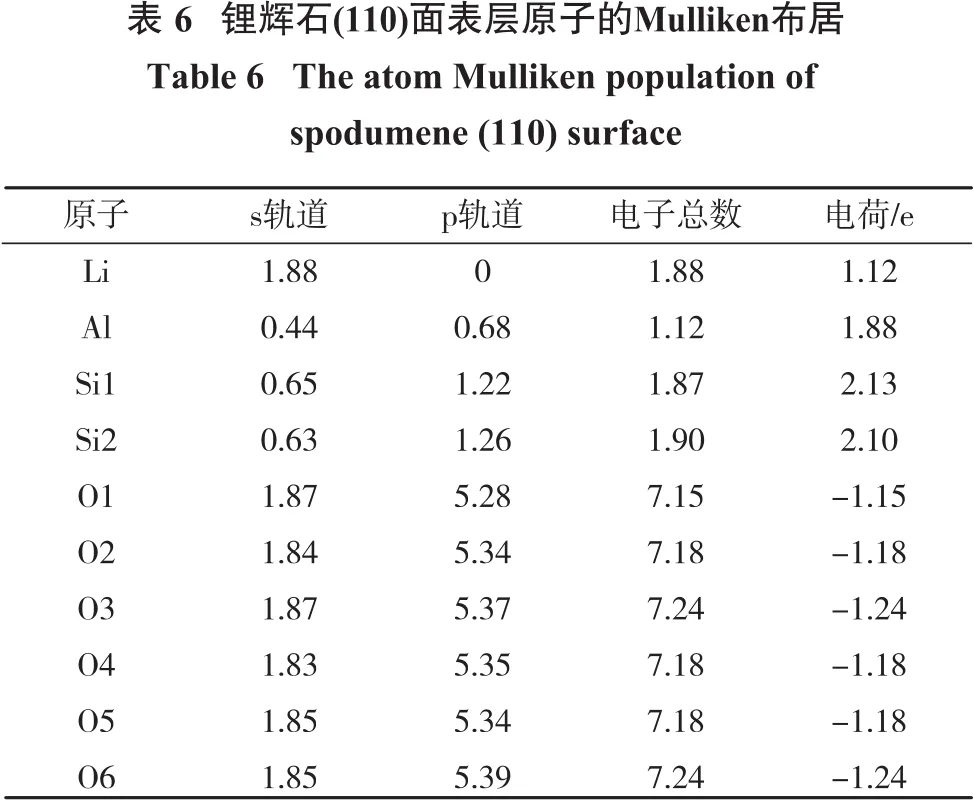
由表6可知:与锂辉石体相相比,锂辉石(110)面表层原子除Li以外,外层电子都发生了变化;Al的价电子构型变为Al 3s0.443p0.68,s轨道失去了1.56个单位的电子,较体相多失去了0.03个单位的电子,p轨道失去了0.32个单位的电子,较体相多失去了0.17个单位的电子,Al所带电荷增加为1.88 e;Si的价电子构型变为2种,分别为Si 3s0.653p1.22和Si 3s0.633p1.26,与体相相比,其s轨道分别少失去了0.02个单位的电子和0个单位的电子,p轨道分别多失去了0.05个单位的电子和0.01个单位的电子,所带电荷分别为2.13 e和2.10 e;表层6个O的价电子构型均不同,分别为O 2s1.872p5.28,O 2s1.842p5.34,O 2s1.872p5.37,O 2s1.832p5.35,O 2s1.852p5.34,O 2s1.852p5.39,与体相相比,O3和O6变化稍大,主要表现为p轨道得到的电子增多,所带电荷变为-1.24 e。
表7为锂辉石(110)面表层电子的键布居。
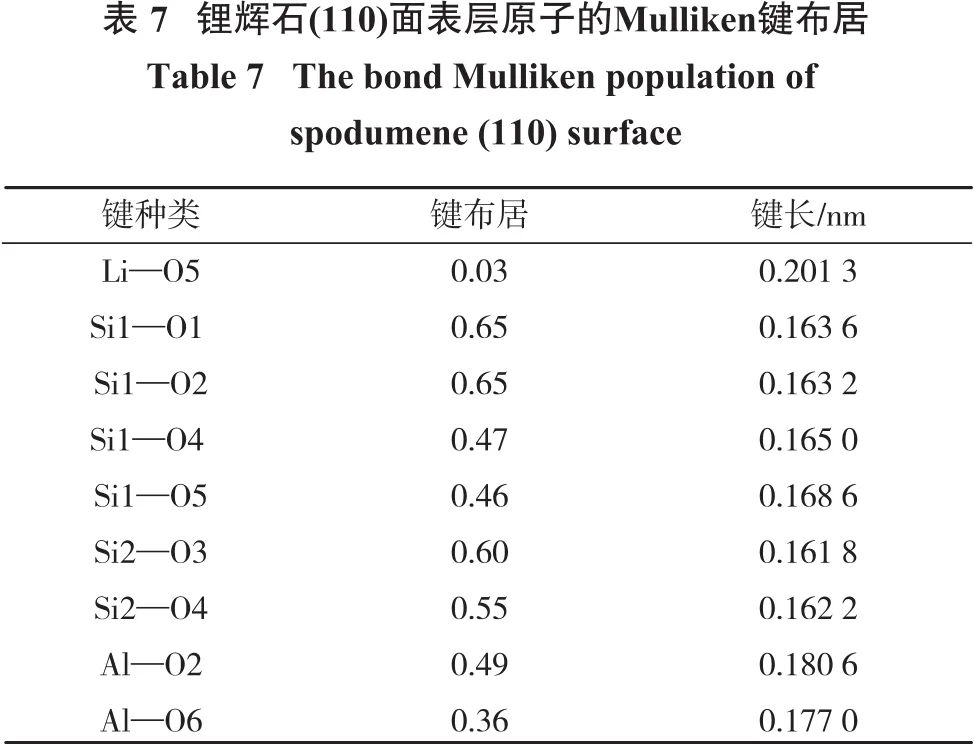
由表7可以看出:Li—O键的布居值和键长较体相发生了改变,其键强变强;Si—O键的布居值和键长也发生了变化,6个Si—O键中,除Si1—O1和Si1—O2较为接近,其余均表现出不同的布居值和键长,与体相也有差别,说明锂辉石切表面后,表面Si—O键发生了较明显的重构;Al—O键的布居分别为0.49和0.36,与体相相比,键的共价性增强。锂辉石表面,Li—O键离子性最强,Si—O键共价性最强,Al—O键介于其中,这与体相一致。
2.2.4 锂辉石(110)面的态密度分析
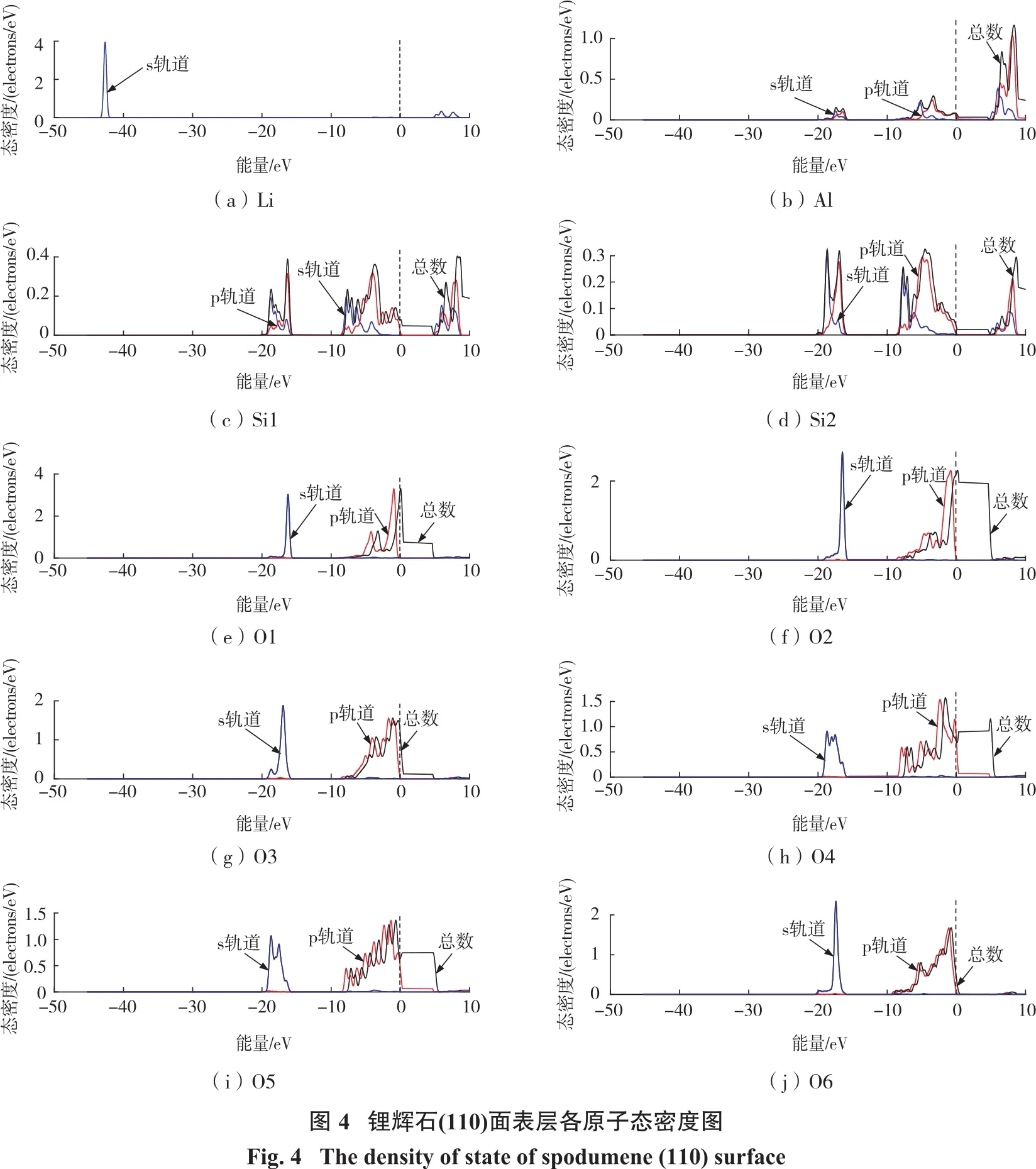
图4为锂辉石(110)面表层原子的态密度图。
由图4可知:锂辉石(110)面的能带与体相类似,主要也分为4部分,-44~-41 eV之间,基本完全由Li的s轨道组成;-20~-15 eV之间,主要由O的s轨道组成,同时,Si和Al的s轨道和p轨道对该部分价带也有少量贡献;-10~0 eV之间,主要由O的s轨道和少量的Si和Al的s轨道和p轨道组成,此外还有少量的Li的s轨道贡献;0~20 eV之间的导带能级所有原子都有轨道参与贡献。此外,O的p轨道在费米能级附近的态密度贡献仍然是最大的,因此O是锂辉石中最活跃的原子。表层6个氧原子在费米能级附近的态密度贡献大小不同,因此其活性也不同。6个氧原子在费米能级附近的态密度贡献大小为:O1>O2>O3≈O6>O5>O4。因此,O1是锂辉石表面活性最高的原子,其次是O2。
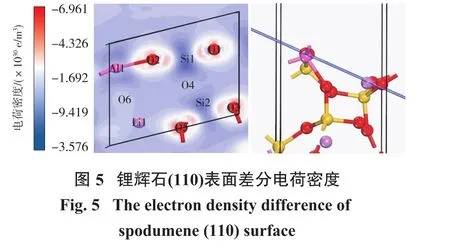
2.2.5 锂辉石(110)面的差分电荷密度图
图5为锂辉石(110)面表层电子的差分电荷密度图,其中蓝色区域为失电子的区域,红色为得到电子的区域,如图5左侧的标尺所示,色调的深浅代表了得失电子的程度。从图中可以看出:锂辉石表面缺电子位点和多电子位点交替出现,但得失电子程度不同,因此化学活性也不同,这与态密度结果相一致,各原子表现出不同的化学活性。
3 锂辉石浮选行为预测
根据以上计算结果可知:锂辉石表面荷正电的活性位点主要为Al,预测锂辉石容易与含—COOH、—CONHOH、—OSO2H等易于与Al发生化学反应官能团的阴离子捕收剂作用。但根据其态密度可知,Li和Al等荷正电的位点的活性很低,因此使用该类阴离子捕收剂时,其捕收性能可能不佳。
锂辉石中荷负电的活性位点为O,且其活性较高,因此预测阳离子捕收剂如胺类捕收剂,以及金属离子活化剂如Ca2+等,可吸附于锂辉石表面,且主要与锂辉石表面的O1和O2作用。由于O的活性较高,因此阳离子捕收剂可能表现出较好的捕收性能,而金属离子可能表现出较好的活化作用。
4 结 论
(1)锂辉石晶体中,主要荷正电的原子为Li、Al和Si,荷负电的原子为O,其中O具有3种价电子构型。由于锂辉石晶体结构的复杂性,锂辉石晶体中具有不同的Al—O键和Si—O键,此外,Li—O键具有较强的离子性,Si—O键具有较强的共价性,因此Li—O键最易断裂,其次是Al—O键。由于Li+易溶于水,因此Al为锂辉石表面最有可能的荷正电的活性位点。
(2)锂辉石晶体的能带和态密度分析表明锂辉石能带间隙为5.77 eV,是绝缘体。其能带主要分为4个部分,其中O的p轨道在费米能级附近的态密度贡献最大,因此O是锂辉石中最活跃的原子,锂辉石中最有可能的荷负电的活性位点为O。
(3)所构建的锂辉石(110)面的表面能为0.342 9 J/m2,锂辉石表面弛豫结果表明锂辉石(110)面的表层原子在优化以后,均产生了弛豫现象。Z轴方向的弛豫相对明显,其次是X轴方向,Y轴方向的弛豫相对较弱。
(4)锂辉石表面的布居分析表明优化后的锂辉石(110)面表层原子价电子构型、布居、键长等均发生了变化。态密度分析结果表明锂辉石(110)面活性最强的原子仍然是O,但6个O活性不同,其在费米能级附近的态密度贡献大小为:O1>O2>O3≈O6>O5>O4。因此,O1是锂辉石表面活性最高的原子,其次是O2。差分电荷密度图也表明锂辉石表面缺电子位点和多电子位点交替出现,但得失电子程度不同,因此各原子表现出不同的化学活性。
(5)根据矿物基因特性,预测锂辉石容易与含—COOH、—CONHOH、—OSO2H等易于与Al发生化学反应官能团的阴离子捕收剂作用,但捕收性能可能不佳;预测阳离子捕收剂如胺类捕收剂以及金属离子活化剂如Ca2+等,可吸附于锂辉石表面,产生较好的捕收能力和活化能力。

