柠檬苦素类化合物抗病原体作用及机制研究进展
张群琳,何雅静,李 甜,孙志高,2*
1西南大学柑桔研究所;2中国农业科学院柑桔研究所,重庆 400712
柠檬苦素类化合物是一类主要存在于芸香科(Rutaceae)和楝科(Meliaceae)植物中[1]的三萜类次生代谢产物,其中,在芸香科植物(如柠檬、甜橙、葡萄柚、佛手柑)的种子、果实和果皮组织中含量丰富,并与柑橘品种有关[2];楝科植物中的印度楝树含柠檬苦素类化合物种类最多[3]。目前已经从芸香科和楝科植物中分别发现了130余种该类化合物[4-6]。国内外学者对柠檬苦素类化合物的生理活性进行大量研究,发现柠檬苦素类化合物具有抗癌[7,8]、抗菌、抗病毒[9]、抗氧化和杀虫[10,11]等生理活性。柠檬苦素配糖体大多溶于水溶液,具有预防骨质疏松[12,13]和抗肥胖[14,15]作用,且在pH2~8范围内稳定、无味,因此被广泛应用于传统药物[16,17]或作为膳食补充剂应用于现代营养制品[18]中。
近年来由于抗生素的不当使用,逐渐产生了耐药菌株,抗菌药物的疗效和安全性呈现降低的趋势,利用柠檬苦素类化合物的抗菌活性,将其作为一种天然的抗病原体物质具有很好的应用潜能和研究价值。本文就柠檬苦素类化合物结构、其对病原体的影响及作用机理和柠檬苦素类物质的吸收代谢情况等进行综述,旨在为柠檬苦素类化合物于食品、医药领域的开发应用提供一定的理论参考。
1 柠檬苦素类化合物的结构特性
柠檬苦素类化合物是高度氧化的三萜类化合物,其特征在于含有呋喃环的四环三萜类骨架。按化学骨架和环开裂情况,主要分为四环均完整型(intact apo-euphol skeleton limonoid)、A-环开环(A-ring seco limonoid)、B-环开环(B-ring seco limonoid)、C-环开环(C-ring seco limonoid)、A,D-环开环型(A,D-ring seco limonoid)等[5],详见图1。
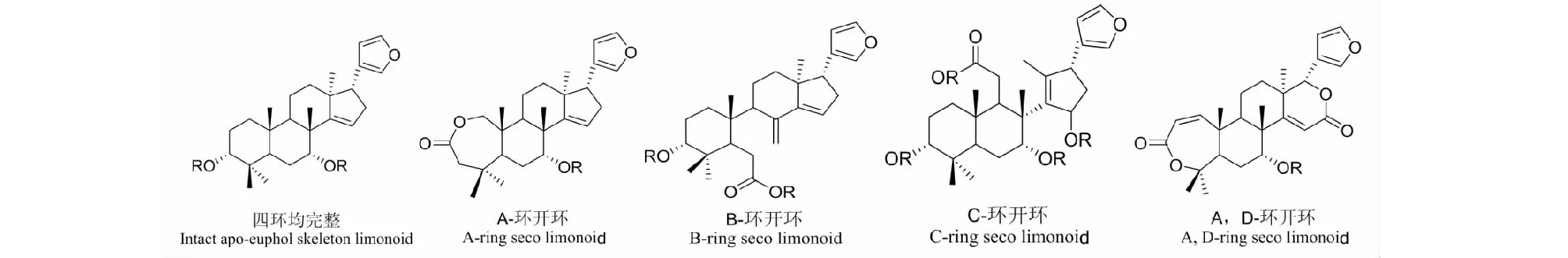
图1 各组柠檬苦素类化合物骨架图
芸香科植物中柠檬苦素类化合物主要以游离苷元和相应的β-D-葡萄糖苷形式存在,前者主要在种子中形成,后者在果实成熟过程中形成。柠檬苦素苷元类化合物(1~10)的主要的官能团为双内酯[20],包括柠檬苦素(limonin,1)、诺米林(nomilin,2)、黄柏酮(obacunone,3)、脱乙酰诺米林(deacetylnomilin,4)、limonexic acid(5)、isolimonexic acid(6)、枸橼苦素(citrusin,7)、宜昌橙苦素(ichangin,8)、异黄柏酮酸(isoobacunoic acid,9)、脱氧柠檬苦素(deoxylimonin,10)详见图2和表1。
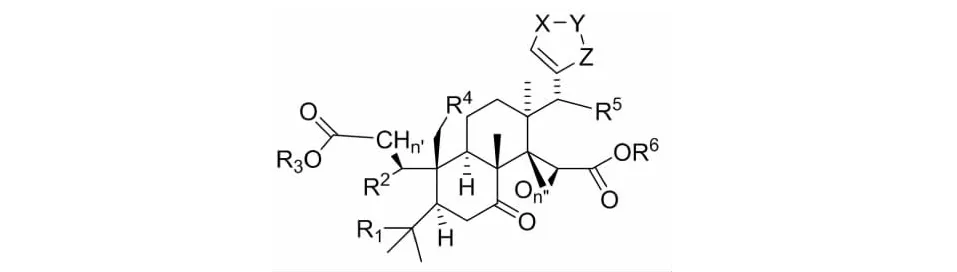
图2 柠檬苦素类化合物1~15骨架图
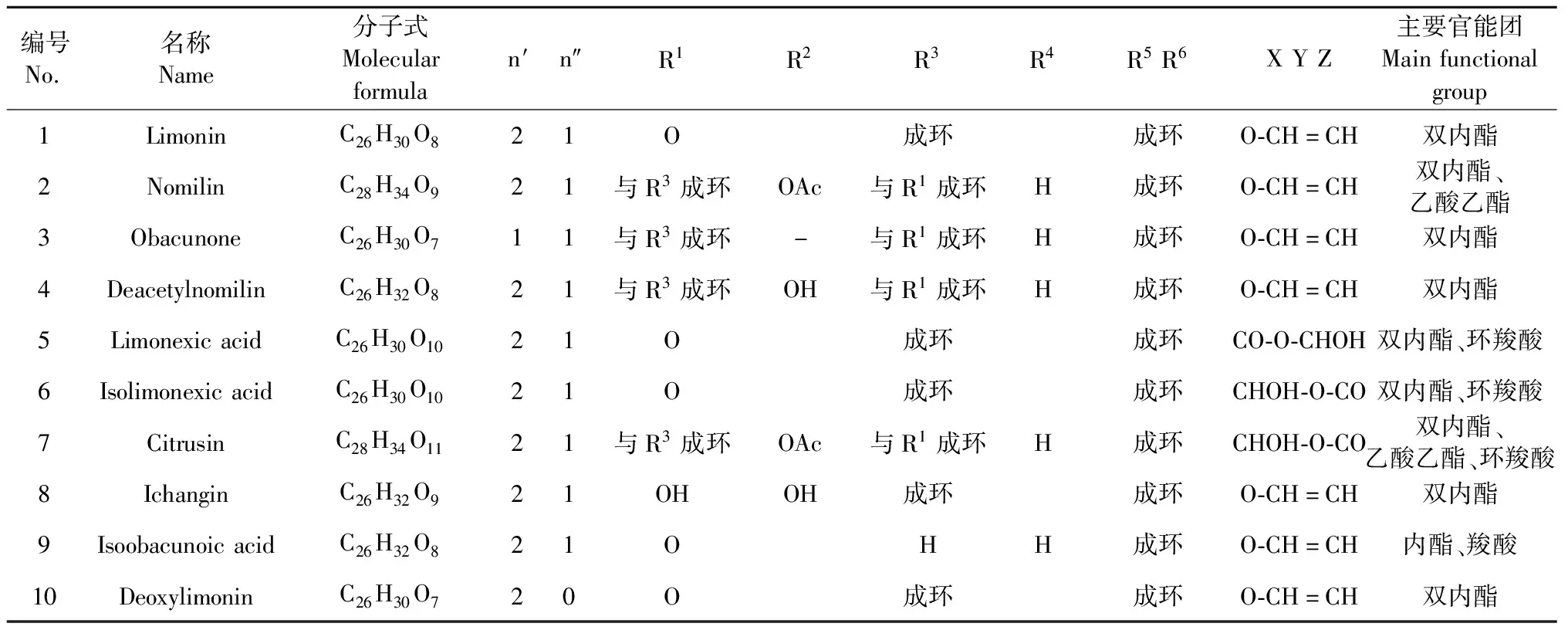
表1 柠檬苦素苷元类化合物主要结构特征汇总
葡萄糖苷类柠檬苦素类化合物(11~15)是由柠檬苦素苷元在17位和1分子葡萄糖以糖苷键的形式结合而形成的,主要官能团为内酯、二羧酸[20],主要包括柠檬苦素17-R-D-glucoside(11)、黄柏酮17-R-D-glucoside(12)、脱乙酰诺米林酸17-R-D-glucoside(13)、诺米林酸17-R-D-glucoside(14)、异黄柏酮酸17-R-D-glucoside(15),详见表2。

表2 葡萄糖苷类柠檬苦素化合物主要结构特征汇总
续表2(Continued Tab.2)
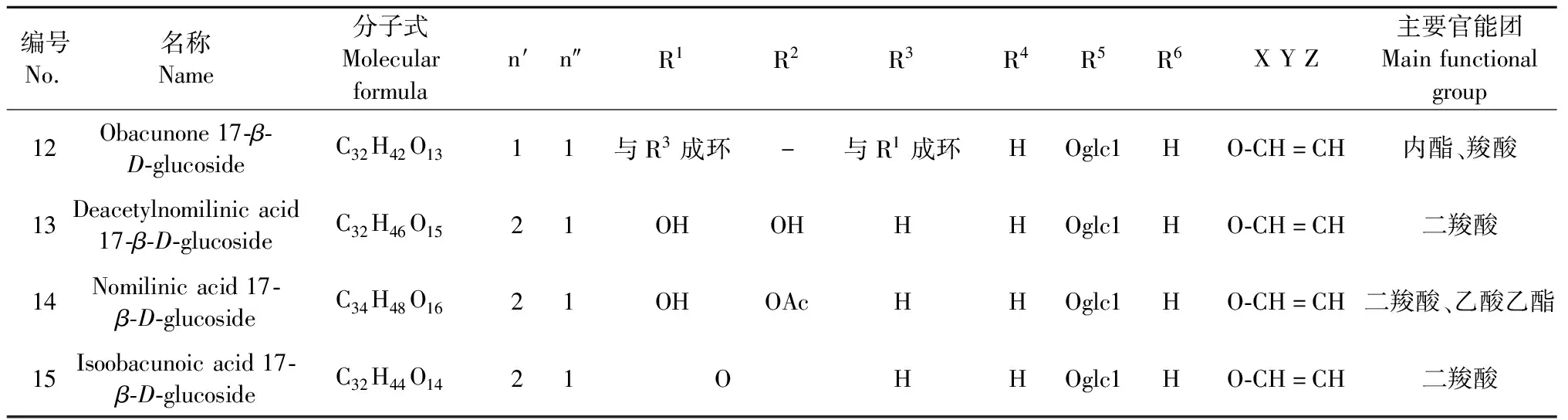
编号No.名称Name分子式Molecularformulan′n″R1R2R3R4R5R6XYZ主要官能团Mainfunctionalgroup12Obacunone17-β-D-glucosideC32H42O1311与R3成环-与R1成环HOglc1HO-CH=CH内酯、羧酸13Deacetylnomilinicacid17-β-D-glucosideC32H46O1521OHOHHHOglc1HO-CH=CH二羧酸14Nomilinicacid17-β-D-glucosideC34H48O1621OHOAcHHOglc1HO-CH=CH二羧酸、乙酸乙酯15Isoobacunoicacid17-β-D-glucosideC32H44O1421 OHHOglc1HO-CH=CH二羧酸
楝科植物的次级代谢产物-柠檬苦素类化合物是该科植物的主要特征成分,楝科植物中柠檬苦素类物质是由三萜类或具有4,4,8-三甲基-17-呋喃甾类骨架的前体衍生而来,通过环氧化作用和apo-euphol或apo-triucallol重组,逐步形成具有较高生物活性的四环三萜类物质[12]。其中苦楝子酮(melianone)、苦楝子醇(melianol)是代表性楝科柠檬苦素类化合物,详见图3。
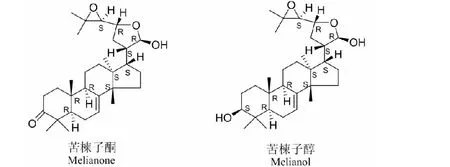
图3 苦楝子酮和苦楝子醇结构式
2 柠檬苦素类物质抗病原体特性
2.1 柠檬苦素类物质抗动物源性病原体
2.1.1 抗动物源性致病菌
近年来,随着抗菌药物的广泛应用,细菌耐药性逐渐增加。有研究表明,天然产物柠檬苦素类物质对李斯特菌、大肠杆菌、结核分歧杆菌等致病菌具有显著的抑制作用,所以将其作为一种新型抗菌药物以解决细菌耐药性问题,具有一定的研究价值,详见表3所示。
Rahman等[21]以活菌计数法测定柠檬苦素对单增李斯特杆菌的抗菌活性,其结果表明柠檬苦素对ATCC 19116菌株抑制作用最强,最小抑制浓度(minimum inhibitory concentration,MIC)为15.62 μg/mL,敏感性高于ATCC 19111、19166、19118和15313菌株(MIC:31.25~62.5 μg/mL)。
苦楝果实中含量最丰富的柠檬苦素类化合物为3-α-tigloyl-melianol和苦楝萜酸甲酯,Sanna等[22]的研究表明这两个化合物具有显著的抗结核分歧杆菌活性,其中3-α-tigloyl-melianol活性最高,MIC值为29 μM,其次是苦楝萜酸甲酯,MIC值为70 μM;最重要的是,发现3-α-tigloyl-melianol使用量在500 μM以下时对Vero细胞没有细胞毒性,这使其作为抗分歧杆菌剂极具应用价值。
2.1.2 抗动物病毒
迄今为止,多种植物来源的柠檬苦素类化合物已被证实对HIV-1[25,26]、登革热病毒[27,28]、呼吸道合胞病毒[29]和单纯疱疹病毒[30]等具有抗病毒活性,详见表4所示。
Sanna等[22]研究表明苦楝科苦楝果实中的柠檬苦素类化合物3-α-tigloyl-melianone和苦楝子酮,在半最大效应浓度(EC50)分别为7和3 μM时,对黄热病病毒均表现出很强的抑制活性。为进一步确定其抗病毒活性,研究将筛选范围扩大到黄热病毒属的其它重要人类病原体,结果表明两种物质对登革病毒和西尼罗河病毒(west nile virus,WNV)(EC50值在3~11 μM范围内)也显示出一定的抑制活性。
Petrera等[31]的研究也表明,苦楝叶中柠檬苦素1-cinnamoyl-3,11-dihydroxymeliacarpin(CDM)在上皮细胞中具有有效的抗疱疹作用。Balestrieri[26]研究了佛手柑提取物(BSext)、柠檬苦素、诺米林对δ逆转录病毒人体T细胞白血病病毒1型(HTLV-1)的抑制作用,结果表明柠檬苦素和诺米林对HTLV-1均有抑制活性,抑制50%逆转录浓度(RTIC50)分别为0.31±0.01和2.60±0.06 ng/mL。同时发现BSext、柠檬苦素和诺米林等天然来源化合物的细胞毒性显著低于参考化合物,且结果表明,BSext、柠檬苦素和诺米林对HTLV-1和HIV-1的抗感染作用都是源于它们自身的抗病毒作用,而不是其对细胞产生的毒性作用。
2.2 柠檬苦素类物质抗植物病原体活性
部分天然植物提取物具有抗真菌毒素及抑制不同植物病原体的重要作用[32]。柠檬苦素类化合物作为三萜类化合物的代表物质,研究表明其在一定浓度下足以抵御某些潜在的植物病原菌[33],因其具有低动物毒性、无神经毒性、在环境中易降解以及避免抗药性产生等多种优势,在农业领域被认为是防治植物病原菌的有效候选药物。
Abdelgaleil等[34]研究了从植物大叶卡雅楝中分离出的10种柠檬苦素类化合物对植物病原真菌灰葡萄孢菌的抗真菌活性,结果表明methyl-angolensate 和1,3,7-trideacetylkhivorin对灰葡萄孢菌的抑菌活性最高,在1000 mg/L时抑菌率分别为62.8%和64.0%,在1500 mg/L时抑菌率分别为73.3%和68.6%。Park等[35]用指示植物法测定了柠檬苦素衍生物anthothecol对锈菌的抑制活性,结果表明当浓度分别为0.5、0.25、0.1 mg/mL时,抑菌率可达90%、76%和53%。
烟草花叶病毒(tobacco mosaic virus,TMV)是一种在世界范围内广泛分布的植物病原体,一些重要的经济作物被其感染后会造成严重的经济损失。Ge等[36]通过半叶法研究发现,当实验浓度为200 μg/mL时,从单叶地黄连中分离出的8种柠檬苦素类物质都具有抗TMV活性,同时酶联免疫吸附法结果显示,两种柠檬苦素类物质munronoid K和munronoid O在浓度为30 μg/mL时对TMV的复制表现出强烈抑制作用。
3 柠檬苦素类物质抗病原体作用机理
3.1 抗致病菌机理
目前研究表明,多种柠檬苦素类化合物能够通过影响致病菌群体感应(quorum sensing,QS)从而削弱细菌的致病性[37,38]。群体感应是细菌细胞之间交流的重要机制,根据细菌合成的信号传递分子即自诱导剂(autoinducer,AI)和感应机制不同,肠道致病菌使用LuxR/I、LuxS/AI-2和AI-3/肾上腺素介导的几种群体感应系统来操纵生物膜形成、毒力基因表达等,以在宿主细胞内引发感染并使之持续[39]。结合国内外的相关研究,可将柠檬苦素类物质的抑细菌机理分为以下几个方面。
3.1.1 抑制信号分子活性、干扰感应系统
弧菌有3种平行的QS系统,其中系统2是LuxS/AI-2系统,感应器是LuxO[39]。Vikram等[40]通过研究几种柠檬苦素类化合物对哈氏弧菌细胞信号传导的抑制潜能,发现isolimonexic acid是AI-2活性最有效的抑制剂,IC90=38.90 Μm。此外在100 μg/mL浓度下,isolimonexic acid、宜昌橙苦素能够使调节应答调节因子LuxO的表达分别下调3.68、23.7倍,从而抑制细菌细胞信号转导途径。该作者的另一研究还发现limonexic acid是大肠杆菌O157:H7信号分子AI-3、肾上腺素和感应器激酶QseBC的有效抑制剂。
3.1.2 影响细菌生物被膜形成
细菌生成生物被膜是其为适应自然环境有利于生存的一种生命现象,是致病菌的一个病理特征,受到多种影响因子的复杂调控,包括环境因素和AI-2、AI-3介导的细胞信号。
Vikram[40]的研究表明柠檬苦素类物质能抑制细胞信号,因此,其进一步研究了处理组对致病菌生物膜的影响,结果表明不同柠檬苦素类化合物对哈维氏弧菌生物膜的抑制活性差异显著(P<0.05),isolimonexic acid和黄柏酮在最小抑制浓度分别为94.18和91.2 μM时是哈维氏弧菌生物膜最有效的抑制剂。柠檬苦素类物质对大肠杆菌的抑菌活性研究结果也显示[37],isolimonexic acid和黄柏酮是肠出血性大肠杆菌生物膜最有效的拮抗剂,以剂量依赖的方式对其产生抑制,IC25和IC50值分别为19.7和116.68 μM。
3.1.3 抑制细菌毒力基因正常表达
肠出血性大肠杆菌含有多种毒力决定因素,如由LEE基因座操控的粘附抹平病理学效应、stx2编码的志贺毒素、编码激活转录基因flhDC等[41,42]。有学者[40]研究发现在实验浓度为100 μg/ml的情况下,isolimonexic acid使LEE区编码的基因表达下调5~10倍,flhD和flhC的表达分别下调4.5、6.9倍,stx2的表达下调4.9倍,ichangin同样能够不同程度的抑制这三种基因的表达。沙门氏致病岛(salmonella pathogenicity islands,SPIs)是沙门氏菌附着和内化到肠细胞以及在细胞内存活所必需的,研究表明黄柏酮能够使SPI区内负责编码TTSS和效应因子的基因ssrA、ssrB表达下调9.7,11.8倍,通过进一步研究发现,经黄柏酮(100 μg/mL)处理,沙门氏菌附着于Caco-2细胞上的数量出现显著性下降[40]。
3.1.4 对致病菌造成形态学损伤
Rahman等[23]学者测试了柠檬苦素对单核细胞增生李斯特菌的影响,通过扫描电镜观察发现,对照组单核细胞增生李斯特菌菌株的形态没有任何变化,而处理组显示这些化合物会造成单核细胞增生李斯特菌的形态学损伤,如终点肿胀,细胞壁溶解,部分变形,有孔形成等。Wang等[43]研究发现经柠檬苦素处理的根霉孢子凹陷和皱缩严重,柠檬苦素通过破坏根霉细胞壁和细胞膜的完整性,使胞内物质渗出,菌丝体和孢子变形,从而达到抑菌效果(MIC:1 250 μg/mL)。
3.2 抗病毒机理
3.2.1 抑制病毒入侵宿主细胞
Sanna等[22]通过体外细胞实验证明柠檬苦素类物质3-α-tigloyl-melianol和苦楝子酮对WNV的抑制仅在发生感染的前1 h内有效,如果在病毒感染细胞后的2、4、8 h再添加目标物质,则处理组细胞的存活率与对照组相比无显著提升,同时两种化合物不能阻止病毒与细胞受体间的识别和附着,所以研究者推测对病毒的抑制发生在随后的进入过程。另有研究[44]表明苦楝子提取物(ethanolic extract of Meliae Fructus,EMF)可以有效抑制流感病毒血凝素的活性,从而起到抑制病毒入侵的效果,这是因为血凝素作为流感病毒表面蛋白,与宿主细胞表面的唾液酸受体结合后能促进病毒侵入胞内。
3.2.2 抑制病毒糖蛋白转运
病毒具有有限的遗传能力,必须依赖宿主细胞的多种功能才能增殖,病毒糖蛋白在核糖体上合成,经内质网、高尔基氏体到达细胞膜,在此过程中被糖基化。Barquero等[45]将感染水泡性口炎病毒(vesicular stomatitis virus,VSV)后的宿主细胞经CDM处理,间接荧光免疫结果显示,合成的病毒G-蛋白被限制于高尔基体上,即CDM抑制了G-蛋白向质膜的转运。Bueno等[46]的研究表明,CDM对转铁蛋白受体(TfR)和TNF-α两种糖蛋白的转运有短暂的阻断作用,在不影响细胞糖蛋白生物活性的情况下,CDM引起的糖蛋白转运延迟对病毒增殖会产生强烈抑制作用,但CDM对TfR与转铁蛋白的结合能力没有影响,对TNF-α的分泌也没有影响。另一方面,CDM同时干扰了衣壳蛋白、糖蛋白和被膜蛋白在同一HSV-1感染细胞内的定位。
3.2.3 抑制病毒复制和部分基因表达
Botticelli等[47]发现,在人外周血单核细胞(PB-MC)、单核细胞/巨噬细胞培养体系中,柠檬苦素能有效抑制HIV-1的复制且呈现剂量依赖趋势,EC50为60.0 μmol/L。另一体外细胞实验[45]表明,分别在VSV病毒感染细胞0~3 h和3~6 h后,向培养基中加入75 μM CDM,对病毒复制的抑制率可分别达到90%和91%。
tax、rex是HTLV病毒基因组的两个调节基因,其中rex基因可表达两种对病毒结构有调节作用的蛋白。Balestrieri[26]研究结果表明,佛手柑提取物(BSext)和诺米林在用量10 μg/mL时能完全抑制HTLV-1 tax/rex的表达,柠檬苦素在5 μg/mL浓度下也达到抑制HTLV-1/rex表达的效果,此外研究表明柠檬苦素、诺米林、BSext对HTLV-1逆转录酶活性均有抑制作用,其中BSext对酶的抑制最强,为柠檬苦素和诺米林的13和1.2倍。
3.2.4 增强细胞免疫应答
细胞因子是由免疫细胞或某些非免疫细胞经刺激诱导产生一类高活性小分子,如白细胞介素(interleukin,IL)和干扰素(inferferons,IFN)等,具有抗病毒和免疫调节作用。Petrera等[31]学者使用生物测定法和酶联免疫吸附法测定细胞因子的产生来评价免疫调节作用,研究表明CDM单独或与2型单纯疱疹病毒(HSV-2)组合使用时能增加TNF-α、IFN-γ、IL-6和IL-10等细胞因子的水平。Mx1蛋白作为重要的抗病毒因子,其基因表达受IFN-I型和III型诱导,通过干扰核糖核酸蛋白复合物组装,并降低病毒聚合酶活性来抑制流感病毒[48],有研究表明,经EMF处理的犬肾细胞,抗病毒蛋白Mx1明显上调,这可能在抑制流感病毒感染中发挥一定作用。
4 柠檬苦素类物质吸收代谢途径
临床前药代动力学结果表明柠檬苦素在动物和人体内的血药浓度较低,生物利用度较差[49,50]。因此研究柠檬苦素类化合物的代谢过程对阐明其药效物质基础和作用机制发挥着重要作用。目前,对柠檬苦素类化合物代谢的研究方法主要包括肝微粒体体外代谢法、实验动物原位肠灌流法及体外细胞实验代谢产物分析法等。
研究表明,柠檬苦素在整个肠道内均有吸收,但吸收途径不是简单的扩散吸收而是促进扩散[51,52],其吸收主要受P-糖蛋白(P-glycoprotein,P-gp)和细胞色素P450肝酶3A4(CYP3A4)的调节[53,54]。Zhang等[51]采用大鼠小肠原位灌流法研究柠檬苦素在十二指肠、结肠、回肠和盲肠的吸收情况,结果表明吸收速率常数Ka和P值没有显著性差异。Han等[53]通过进一步实验证明说明柠檬苦素的吸收与MRP调节的药物转运无关,在P-gp和CYP3A4的调节下维拉帕米和酮康唑能够以剂量依赖的方式显著提高柠檬苦素的吸收,而丙磺舒对柠檬苦素吸收的改善效果不明显,P-糖蛋白的主动外排和细胞色素P450肝酶3A4的首过效应可能是导致其生物利用度低的主要原因之一。
药代动力学研究表明,柠檬苦素类化合物在体内主要发生Ⅰ相代谢,包括羟基化及氢化[55],最终经尿液或粪便以原形及代谢产物的形式排出体外[55,56]。Ren等[54]使用超高效液相色谱与高分辨率质谱联用检测人肝微粒体(human liver microsomes,HLMs)中四种柠檬苦素的代谢产物,结果表明,在C-7和C-16处的还原、羟基化与还原柠檬苦素类物质的糖基化反应是HLMs中柠檬苦素的主要代谢途径。
5 结语
柠檬苦素类化合物是芸香科和楝科植物的次生代谢产物,来源丰富,作为一种新型天然抗病原体活性物质,其在抗动物源性细菌、动物病毒、植物病原菌方面具有广泛的应用前景。近年来国内外研究人员对柠檬苦素类化合物进行了大量研究,对其生物活性做了初步的阐明,但对于柠檬苦素类化合物的分子结构、不同功能基团与其抗病原体活性之间的联系仍处于初步探索阶段,如柠檬苦素类化合物在动植物体内存在多种抗病原体的作用机制,但是这些不同的途径相互渗透、相互影响,需要对其复杂的抗病原菌机制进行更为深入地研究。此外,对于柠檬苦素类化合物经口服在体内吸收率低这一问题,其药物制备方法可以结合纳米微球、纳米脂质体、冰片、载药微囊等技术展开进一步研究和技术更新,以期提高药物的吸收率。鉴于目前一些研究对植物提取物及其抗毒素功效存在多样的解释,迫切需要对这些药物进行进一步的评价,可通过使用适当的感染模型进行广泛的体外、临床前和临床实验,系统研究这些药物发挥作用的机理,为进一步应用奠定理论基础。

