乳粉中发酵乳杆菌CECT5716微生物检测方法的建立
王云霞,侯霞霞*,赵淑环,井丽娟,刘丽君,李翠枝
(内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010110)
发酵乳杆菌CECT5716属于乳杆菌属,兼性厌氧、呈革兰氏阳性、接触酶阴性、无芽孢、无鞭毛、不能运动,是西班牙Biosearch Life公司从母乳中分离的天然益生菌,经大量实验研究和临床实验证实,发酵乳杆菌CECT5716安全[1]且具有抗菌[2-3]和免疫调节[4-5]作用,有助于婴儿肠道菌群建立和增殖[6],能降低胃肠道感染[7],提高母婴免疫力和维持肠道健康[8-10],被广泛应用于功能食品和医药产品[11-12]。发酵乳杆菌CECT5716已通过美国食品药品监督管理局的公认安全认定,并于2016年6月列入我国《可用于婴幼儿食品的菌种名单》[13],可用于婴幼儿乳粉。通过对市场上常见婴幼儿食品,尤其是有益生菌宣称的调制乳粉进行调研后发现,大多数产品添加菌种为动物双歧杆菌Bb-12,仅少数添加了动物双歧杆菌Bb-12和乳双歧杆菌HN019 2 种菌种,将发酵乳杆菌添加于婴幼儿配方乳粉较为少见[14]。发酵乳杆菌CECT5716在国内的应用起步较晚,且相应的检测手段也存在不足,利用GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》实现对发酵乳杆菌的单独计数操作复杂。本研究通过对方法的准确性和重复性进行评价,建立乳粉中发酵乳杆菌CECT5716的微生物检测方法,稀释液为缓冲蛋白胨水,采用10 倍系列梯度稀释,选择适宜稀释度在MRS平板上进行涂布,(36±1) ℃厌氧培养(48±2) h后计数,并对分离菌株进行16S rDNA序列测定。
1 材料与方法
1.1 材料与试剂
发酵乳杆菌CECT5716菌粉(批号:98961;标准值:1×1011CFU/g) 西班牙Biosearch Life公司;MRS琼脂 美国BD公司;缓冲蛋白胨水(含蛋白胨10 g、氯化钠5 g、磷酸氢二钠(12H2O)9 g、磷酸二氢钾1.5 g、蒸馏水1 000 mL) 北京陆桥技术股份有限公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;WH-250-II生化培养箱((36±1) ℃) 上海乔跃电子有限公司;GI54DWS高压灭菌锅 致微(厦门)仪器有限公司;Stomacher® 400 Circulator无菌均质器 英国Seward公司。
1.3 方法
1.3.1 试样制备
样品的全部制备过程均应遵循无菌操作程序,样品应尽可能混匀。冷冻样品可先在2~5 ℃条件下解冻,时间不超过24 h,或在室温下解冻不超过3 h,纯菌粉需恢复至室温才能打开包装。
1.3.2 检测步骤
以无菌操作称取10 g样品,置于装有90 mL灭菌缓冲蛋白胨水的无菌均质袋中,用拍击式均质器拍打1~2 min制成1∶10的样品匀液。用1 mL无菌吸管或微量移液器吸取1 mL初始悬浮液加入装有9 mL灭菌缓冲蛋白胨水的无菌试管中,制备10 倍系列稀释样品匀液,用旋涡振荡器混匀。每递增稀释1 次,换用1 次1 mL灭菌吸管或吸头。根据对样品质量浓度的估计,选择2~3 个适宜稀释度的样品匀液,在进行10 倍递增稀释时,吸取0.1 mL接入MRS琼脂平板(最好前一天配制),使用一次性无菌L形涂布棒均匀涂布,每个稀释度做2 个平皿。同时,分别吸取0.1 mL空白稀释液(灭菌缓冲蛋白胨水)加入2 个MRS琼脂平板作空白对照。待琼脂表面干燥后,将平板翻转,(36±1) ℃厌氧培养(48±2) h,培养后统计平板上的所有菌落数。
1.3.3 发酵乳杆菌CECT5716计数
培养48 h后,对MRS琼脂平板进行菌落计数,保留30~300 个菌落的平板。菌落计数以菌落形成单位(colony-forming units,CFU)表示。
1.3.4 菌种鉴定
涂片镜检:MRS平板上,发酵乳杆菌菌落较大,呈圆形、乳白色、不透明,表面光滑、隆起、边缘整齐。挑取MRS平板上生长的单个发酵乳杆菌菌落进行染色镜检,发酵乳杆菌为革兰氏阳性,呈短杆状,单个或链状,无芽孢杆菌。
菌株16S rDNA序列测定:挑取3 个或3 个以上单个典型菌落,纯培养后外送进行测序,测序结果利用在线分析网站NCBI或EzBioCloud进行比对分析,相似度达97%以上为符合[15-17],确认鉴定结果,最终结果以CFU/g表示。
2 结果与分析
2.1 方法准确性和重复性实验结果
选用未添加乳酸菌的婴儿配方乳粉为基质,通过人为添加发酵乳杆菌CECT5716纯菌粉后作为待测样品进行检测,添加量设置高、中、低3 个水平,每个水平进行6 次检测。

表 1 方法准确性和重复性实验结果Table 1 Accuracy and repeatability of the new method
发酵乳杆菌CECT5716为纯菌粉,菌落数标准值为1×1011CFU/g,以r=0.25设定理论加标范围[18]。由表1可知,经平板计数后实测值均落在理论加标范围,因此,该方法的准确性较好。同一加标样品6 个检测结果对数值的绝对差值,均未超过重复性限(r=0.25),因此可以判定,该方法的重复性较好。
2.2 本方法与国标方法比对实验结果
选取菌粉和乳粉加标样品共20 份,利用本方法和国标(GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》)方法同时进行检测,检测结果如表2所示。
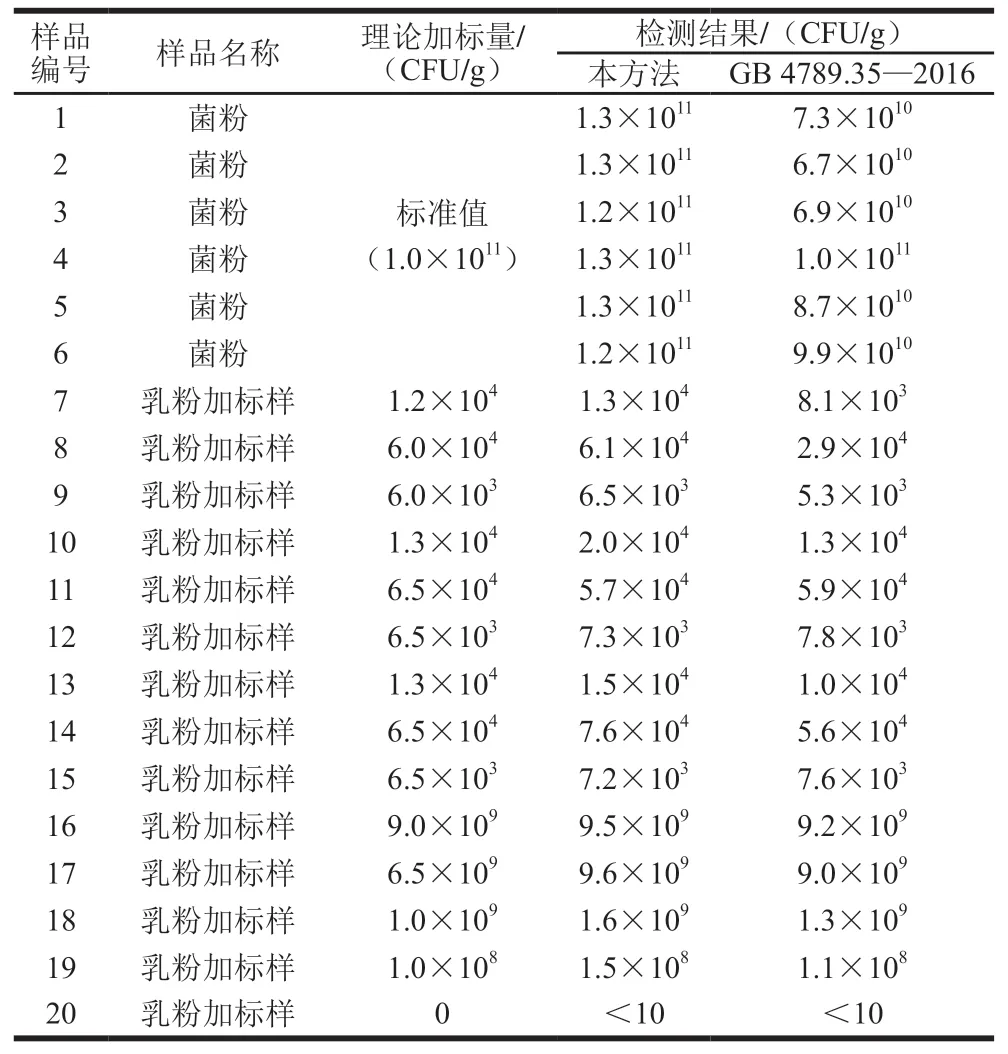
表 2 本方法与国标方法实验结果对比Table 2 Comparison of experimental results obtained using this method and the national standard method
将表2实验结果利用双样本t检验进行分析,可以得出P=0.127>0.05,说明本研究建立的方法测定结果与GB 4789.35—2016无显著性差异。
2.3 方法特异性实验结果
目前添加于婴幼儿乳粉的益生菌主要为双歧杆菌属细菌,因此选择含双歧杆菌乳粉制成加标样,同时用不含乳酸菌乳粉加标作为对照样,按本研究建立方法进行检测,检测结果如表3所示,菌落形态如图1所示。
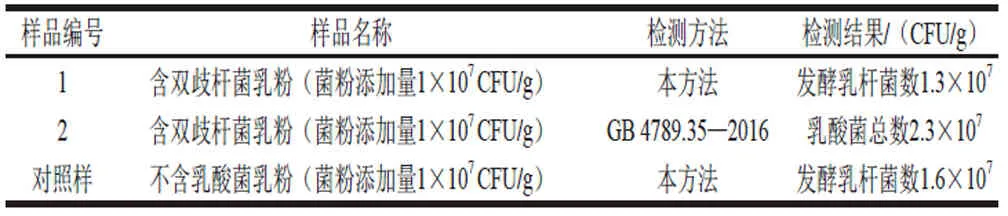
表 3 特异性实验结果Table 3 Specificity of this method
由表3可知,本研究建立的方法能独立进行发酵乳杆菌计数,在一定程度上具有优势。由图1A可知,发酵乳杆菌CECT5716在MRS平板上生长旺盛,菌落较大,呈圆形、乳白色、不透明,表面光滑、隆起、边缘整齐,而双歧杆菌属细菌生长较慢,菌落较小,二者易于区分。由图1B可知,国标法倾注培养后菌落分布于培养基内部和表面,大小不一,通过形态无法对发酵乳杆菌和双歧杆菌进行区分。尽管通过菌落形态特征对2 种已知添加菌进行了初步分类,但其种属信息还需通过革兰氏染色和16S rDNA序列分析进一步确定。
2.4 发酵乳杆菌菌种鉴定
挑取2.3节MRS平板上样品1的单个大菌落(典型菌落)和小菌落进行染色镜检。由图2可知:典型菌落经革兰氏染色为阳性,呈短杆状,无芽孢杆菌;小菌落经革兰氏染色为阳性,呈短杆状、长弯杆状、分叉杆状、棍棒状或匙状。
将上述菌落纯培养后送上海美吉生物医药科技有限公司进行测序,测序结果利用在线分析网站NCBI和EzBioCloud进行比对分析。结果表明:MRS平板上典型菌落与发酵乳杆菌具有100%的相似度,确定为发酵乳杆菌。MRS平板上小菌落与动物双歧杆菌具有100%的相似度,确定为动物双歧杆菌。
综合菌株的镜检、菌落形态特征和16S rDNA分析结果,确定菌粉中菌株为发酵乳杆菌。
3 结 论
采用传统微生物方法对婴幼儿乳粉中发酵乳杆菌进行计数,涂布法测定结果表明,发酵乳杆菌与双歧杆菌在MRS平板上易于区分,MRS平板上发酵乳杆菌菌落明显大于双歧杆菌,且乳脂状更明显;而倾注法测定结果表明,菌落分布于培养基内部和表面,且菌落形态及大小不一,造成发酵乳杆菌和双歧杆菌区分不明显。涂布法和倾注法对于食品中乳酸菌的检测结果在统计学上无显著性差异[19-21],通过本方法与GB 4789.35—2016进行对比也获得了相同结果。本方法选用涂布培养法实现了对乳粉中发酵乳杆菌的独立计数,增加了菌株16S rDNA序列测定,结合形态学与分子生物学进一步对添加菌粉的真实性进行确认,弥补了国标检测中不能确定菌株种属信息的不足。另外,该方法培养时间较国标方法减少24 h,节省了时间成本。对乳粉加标样品进行6 次重复性实验,其准确性和重复性均较好。综上所述,本方法较国标法更适合发酵乳杆菌CECT5716的计数,具有区分度高、培养时间短、操作简单、重复性好、准确性高的优点;本方法能检测乳粉中发酵乳杆菌CECT5716的活菌数,并确定发酵乳杆菌种属信息,对发酵乳杆菌CECT5716菌粉及添加有发酵乳杆菌CECT5716菌种的乳粉中发酵乳杆菌的计数具有重要参考意义,在一定程度上保证了产品的质量和安全,进一步推动了发酵乳杆菌CECT5716在婴幼儿配方乳粉中的应用。

