响应面法优化乳双歧杆菌Z-1冷冻干燥保护剂配方
徐显睿,李翠凤,隋勇军,张宗博,杨洪来,李道河,陈政言,张兰威*
(1.青岛根源生物技术集团有限公司食品实验室,山东 青岛 266000;2.青岛诺和诺康实业有限公司,山东 青岛 266000;3.中国海洋大学食品科学与工程学院,山东 青岛 266000)
乳双歧杆菌(Bifidobacterium lactis)是肠道中最典型的有益菌[1-2],具有促进肠道健康[3]、调节肠道菌群平衡[4]、抑制有害菌生长[5]、预防肠道疾病[6]和提高免疫力[7]等功能。乳双歧杆菌作为原料或发酵剂应用于食品领域,例如在饮料、乳品、烘焙产品、糖果、固体饮料、保健品及其他益生菌衍生产品中,主要采用冻干粉形式进行直投式添加。冷冻干燥技术不仅方便乳双歧杆菌等益生菌运输、销售和应用[8],而且可以降低其贮藏期内微生物的生化反应,使益生菌粉性状和菌数保持相对稳定,进而更好发挥益生功效[9]。
影响乳双歧杆菌冻干粉等益生菌粉剂使用和贮藏期内菌株活性及存活率的因素主要有三方面:1)菌株特异性;2)真空冷冻干燥过程中对菌体的损伤;3)干粉包装技术和贮藏环境条件[10]。其中菌体冷冻干燥过程中,菌液经冻结、融化及渗透压变化等作用而受到的损伤为主要影响因素。引起菌体冷冻损伤的因素主要为菌体细胞内冰晶的形成和细胞质的损伤[11]。因此,在菌体中加入适当的冷冻干燥保护剂配制成乳化液,能够减少干粉制备过程中外部环境对菌体造成的破坏,提高菌粉的菌株活性和存活率。
乳双歧杆菌Z-1是一株经筛选具有优良益生性状的菌株。本研究通过响应面法对乳双歧杆菌Z-1原冷冻干燥保护剂配方进行优化,以期提高其存活率,为乳双歧杆菌Z-1菌粉商业化应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
乳双歧杆菌Z-1 青岛根源生物技术集团有限公司食品实验室菌种资源库保藏。
乳糖、海藻糖、蔗糖、甘油、异抗坏血酸钠、谷氨酸钠、L-半胱氨酸盐酸盐、氯化钠、吐温-80(均为分析纯)国药集团(上海)化学试剂有限公司;脱脂乳粉、乳清蛋白粉 恒天然商贸(上海)有限公司;大豆蛋白胨、胰蛋白胨、莫匹罗星锂盐 青岛高科技工业园海博生物技术有限公司;琼脂 北京索莱宝科技有限公司;酵母膏、牛肉膏 北京奥博星生物技术有限责任公司。
1.2 仪器与设备
YXQ-LS-50SⅡ立式高压蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;SW-CJ-1F超净工作台 苏州安泰空气技术有限公司;AG050厌氧培养罐 广州雷得生物技术有限公司;SE6001FZH电子天平 美国奥豪斯公司;MEI04E分析天平 瑞士梅特勒-托利多公司;TG16-WS台式高速离心机 湖南湘仪实验室仪器开发有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司;LRH-250生化培养箱、BWS-12G电热恒温水槽上海一恒科学仪器有限公司;MX-S旋涡振荡器 美国赛洛捷克公司。
1.3 方法
1.3.1 乳双歧杆菌Z-1菌泥收集
菌体经高密度培养至稳定前期,10 000×g离心10 min收集菌泥。
1.3.2 乳双歧杆菌Z-1乳化液制备
将1.3.1节中的菌泥与灭菌后的冷冻干燥保护剂(脱脂乳粉、乳清蛋白粉、蔗糖、海藻糖、甘油、异抗坏血酸钠、谷氨酸钠、L-半胱氨酸盐酸盐)按干物质质量比1∶2混合,搅拌10~15 min后进行真空冷冻干燥处理。
1.3.3 乳双歧杆菌计数培养基配制
乳双歧杆菌计数培养基成分:乳糖2%、胰蛋白胨0.5%、大豆蛋白胨1.5%、酵母膏0.3%、牛肉膏0.4%、氯化钠0.4%、吐温-80 0.1%、L-半胱氨酸盐酸盐0.1%、莫匹罗星锂盐0.005%、琼脂1.5%。
将上述成分(除莫匹罗星锂盐外)加入蒸馏水中,加热溶解,调节pH值至6.2±0.1,分装后121 ℃高压灭菌20 min,降温待用;再用0.22 μm滤膜将莫匹罗星锂盐过滤至培养基中,充分混合。
1.3.4 活菌数测定
参照GB 4789.34—2016《食品安全国家标准 食品微生物学检验 双歧杆菌检验》测定。
1.3.5 Plackett-Burman试验设计
以乳双歧杆菌Z-1冷冻干燥保护剂配方中的脱脂乳粉、乳清蛋白粉、蔗糖、海藻糖、甘油、谷氨酸钠、异抗坏血酸钠和L-半胱氨酸盐酸盐添加量为主要因素,进行Plackett-Burman筛选试验,考察对冷冻干燥后活菌数有显著影响的因素。
1.3.6 最陡爬坡试验设计
为更好建立响应面拟合方程,逼近最佳响应值区域,采用最陡爬坡试验近一步确定影响乳双歧杆菌Z-1冷冻干燥后活菌数主要因素的最优添加量。根据1.3.5节结果确定各因素爬坡方向及步长。
1.3.7 Box-Behnken响应面试验设计
响应面分析采用多元二次回归方程拟合各因素和响应值间的关系。通过乳双歧杆菌Z-1冷冻干燥保护剂成分中显著性影响因素与活菌数之间的拟合,优化保护剂中的关键成分,获得保护剂的最优配方。
1.4 数据处理
采用Design-Expert 8.0软件进行数据处理、作图。
2 结果与分析
2.1 Plackett-Burman试验结果及分析
选择脱脂乳粉、乳清蛋白粉、蔗糖、海藻糖、甘油、谷氨酸钠、异抗坏血酸钠、L-半胱氨酸盐酸盐共8 种组分进行Plackett-Burman试验(n=12),确定对乳双歧杆菌Z-1冷冻干燥后活菌数具有显著影响的因素。采用+1水平是―1水平的2 倍进行试验设计。试验设计、响应值及结果分析如表1~3所示。
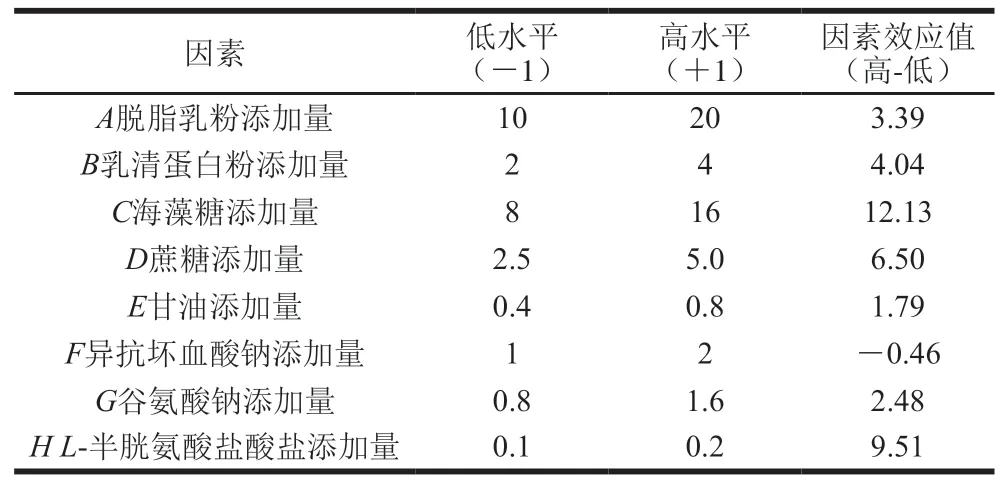
表 1 Plackett-Burman试验设计变量及不同水平的用量Table 1 Variables and levels used in Plackett-Burman design

表 2 Plackett-Burman试验设计及结果Table 2 Plackett-Burman design with experimental results
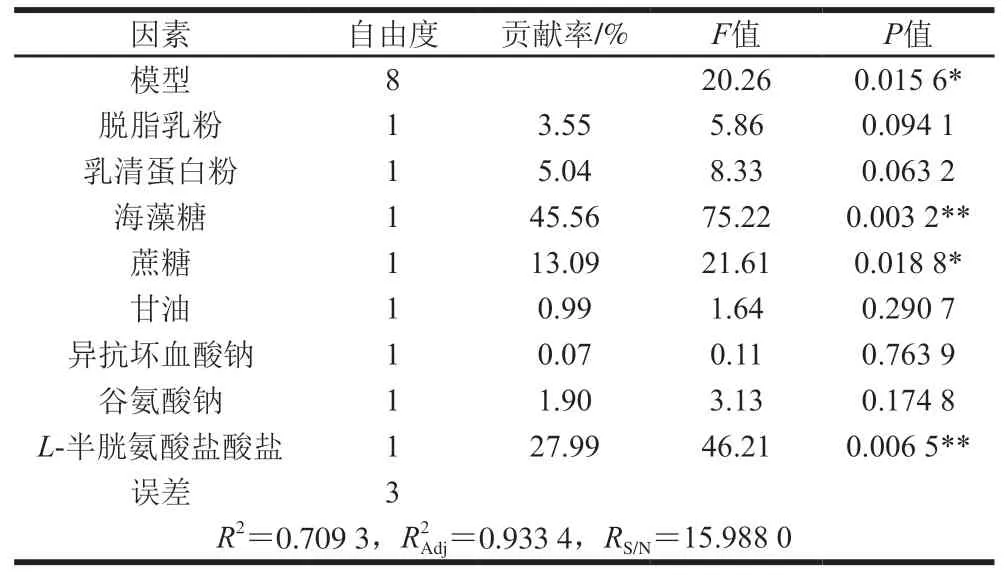
表 3 Plackett-Burman试验结果显著性分析Table 3 Analysis of variance of regression model from Plackett-Burman design
由表1、3可知,根据统计学分析,影响活菌数的显著因素共有3 个,海藻糖贡献率为45.56%,蔗糖贡献率为13.09%,L-半胱氨酸盐酸盐贡献率为27.99%。由Design Expert 8.0软件得出拟合回归模型方程为:R=34.15+1.69A+2.02B+6.07C+3.25D+0.90E―0.23F+1.24G+4.75H,模型有统计学意义(F=20.26,P<0.05),R2Adj为0.933 4,说明93.34%活菌数变化由所选因素引起。本模型中RS/N为15.988 0,说明了模型的充分性和合理性。在所选因素中,海藻糖、蔗糖、L-半胱氨酸盐酸盐添加量对活菌数的效应值分别为12.13、6.50、9.51,且均为正效应。
2.2 最陡爬坡试验结果及分析
根据Plackett-Burman试验结果,海藻糖、蔗糖、L-半胱氨酸盐酸盐对活菌数的影响均为正效应,故爬坡方向均向上。以海藻糖方程系数为基准量,分别确定各显著因素的添加量,最陡爬坡试验各因素步长水平如表4所示。

表 4 最陡爬坡试验各因素步长水平表Table 4 Levels of factors used in steepest ascent design
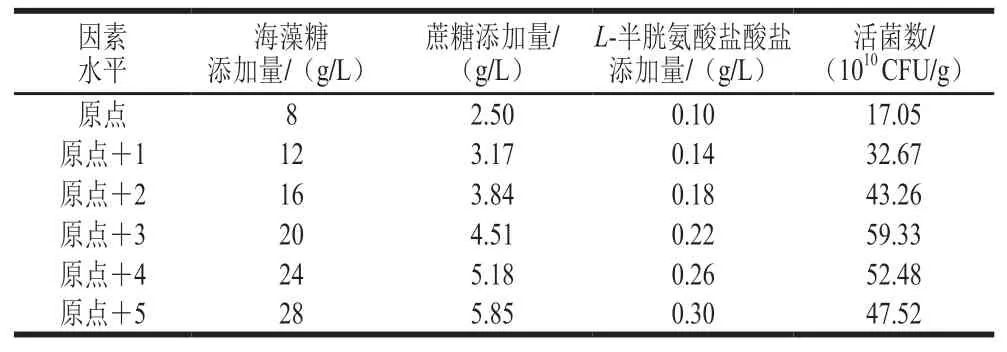
表 5 最陡爬坡试验设计及结果Table 5 Steepest ascent design with experimental results
由表5可知,因素水平在原点+3处活菌数达到最大,之后活菌数减少,因此活菌数最大值出现的响应区间在因素水平原点+3附近,选择原点+3作为响应面试验的中心点。
2.3 响应面试验结果及分析
以海藻糖、蔗糖和L-半胱氨酸盐酸盐添加量为自变量,采用响应面法对乳双歧杆菌Z-1冷冻干燥保护剂配方进行优化,采用Design-Expert软件进行响应面试验设计和数据分析。
2.3.1 响应面试验因素水平及结果运用Box-Behnken组合试验设计原理,对海藻糖、蔗糖和L-半胱氨酸盐酸盐添加量进行3因素3水平响应面试验分析。响应面试验因素水平和结果如表6所示。
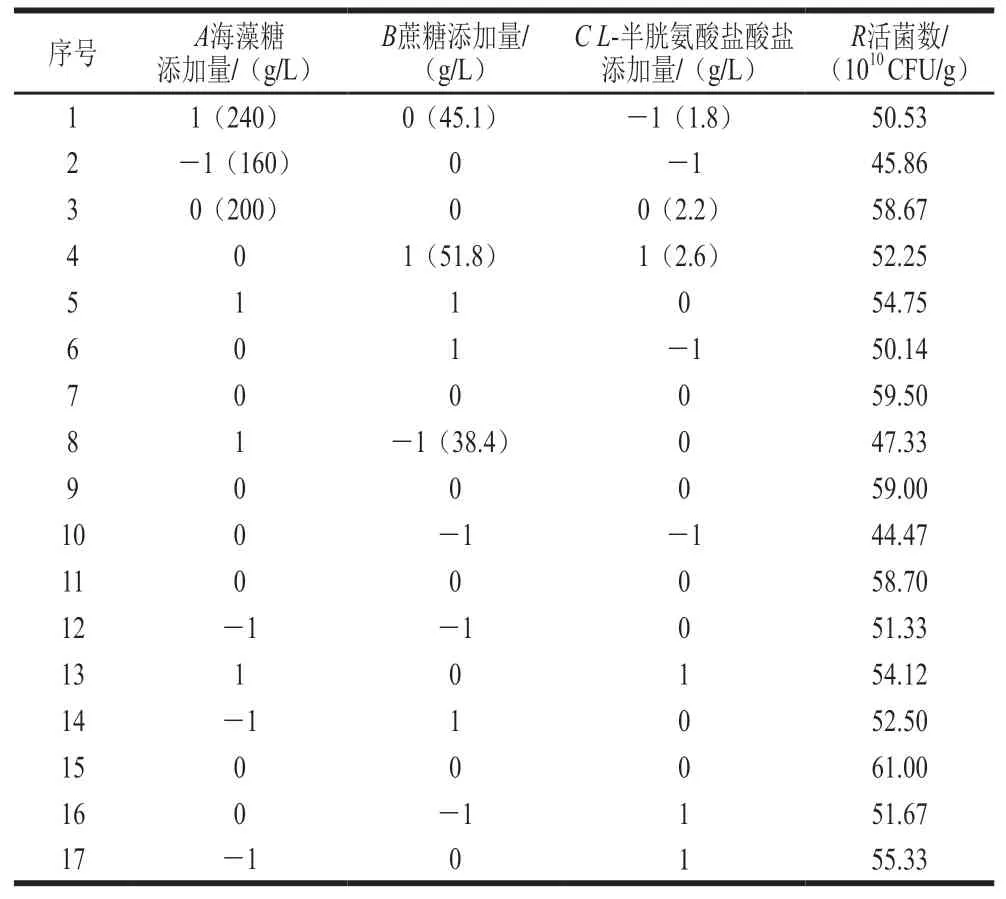
表 6 响应面试验设计与结果Table 6 Box-Behnken design with experimental results
2.3.2 响应面试验结果的方差分析
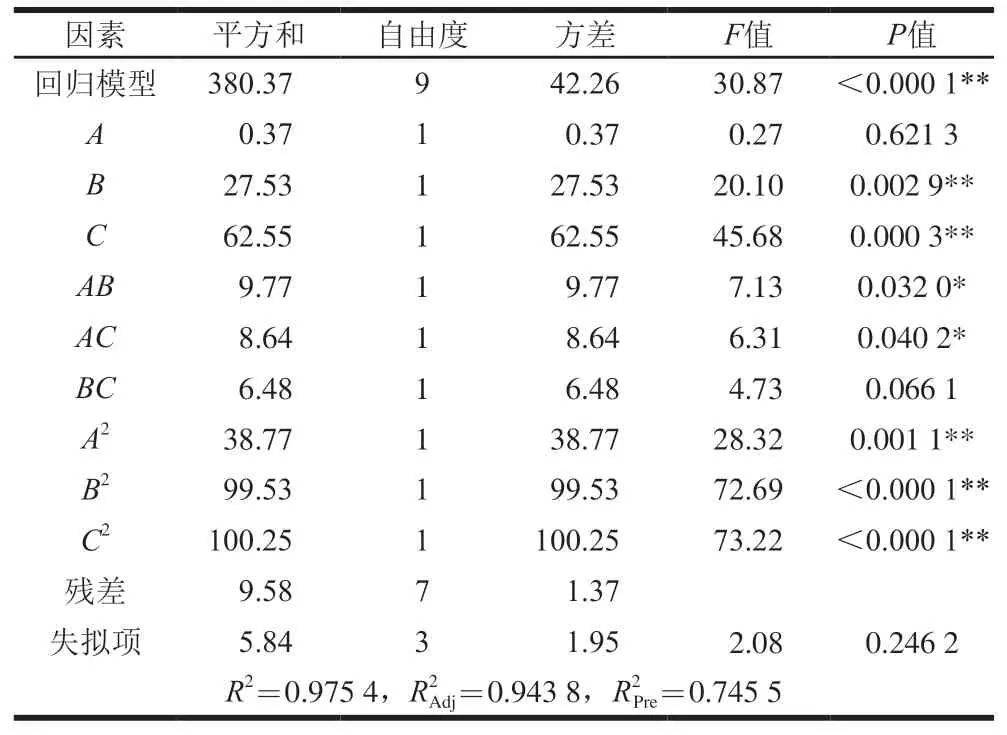
表 7 菌量响应面拟合回归方程的方差分析Table 7 Analysis of variance of regression model from Box-Behnken design
利用Design-Expert软件对实验数据进行分析,得到二次多项回归方程:R=59.37+0.21A+1.86B+2.80C+1.56AB―1.47AC―1.27BC―3.03A2―4.86B2―4.88C2。对上述回归模型进行方差分析,并对模型系数进行显著性检验。由表7可知,模型的F=30.87,P<0.000 1,且失拟项P>0.05,说明该模型显著。模型R2=0.975 4,说明拟合程度很好,且方差相差很小,说明模型可信度高,可以用此模型分析和预测乳双歧杆菌Z-1冷冻干燥保护剂配方。
对单因素来说,蔗糖和L-半胱氨酸盐酸盐添加量对活菌数均影响极显著,海藻糖添加量影响不显著,影响程度为C>B>A。对于交互作用来说,海藻糖和蔗糖、海藻糖和L-半胱氨酸盐酸盐添加量交互作用对活菌数均影响显著(P<0.05),蔗糖和L-半胱氨酸盐酸盐添加量交互作用对活菌数的影响不显著。模型的二次项对活菌数均影响极显著。
2.3.3 各因素交互作用分析
由图1可知,海藻糖和蔗糖添加量交互作用对活菌数影响的等高线图为椭圆形,说明海藻糖和蔗糖添加量交互作用对活菌数影响显著。当蔗糖添加量不变时,随着海藻糖添加量的增加,活菌数呈现先上升后下降的趋势;当海藻糖添加量不变时,随着蔗糖添加量增加,活菌数同样呈现先上升后下降的趋势。当海藻糖添加量为200 g/L、蔗糖添加量为46.78 g/L时活菌数达到最大值。
由图2可知,海藻糖和L-半胱氨酸盐酸盐添加量交互作用对活菌数影响的等高线为椭圆形,说明海藻糖和L-半胱氨酸盐酸盐交互作用对活菌数影响显著。当L-半胱氨酸盐酸盐添加量不变时,随着海藻糖添加量的增加,活菌数呈现先上升再趋于平缓的变化趋势;当海藻糖添加量不变时,随着L-半胱氨酸盐酸盐添加量的增加,活菌数同样呈现先上升再趋于平缓的变化趋势。当海藻糖添加量为200 g/L、L-半胱氨酸盐酸盐添加量为2.35 g/L时活菌数达到最大值。
由图3可知,蔗糖和L-半胱氨酸盐酸盐添加量交互作用对活菌数影响的等高线图近似圆形,说明交互作用影响不显著。虽然交互作用影响不显著,但当固定一个变量,活菌数会随着另一个变量的增大先上升后下降,随着因素值的改变,活菌数变化不明显。当蔗糖添加量为46.78 g/L、L-半胱氨酸盐酸盐添加量为2.35 g/L时活菌数达到最大值。
响应面图均为开口向下的凸面,故响应值R存在极大值,为进一步优化结果,根据Design-Expert软件得出海藻糖、蔗糖和L-半胱氨酸盐酸盐最优配比为海藻糖添加量200.51 g/L、蔗糖添加量46.16 g/L、L-半胱氨酸盐酸盐添加量2.31 g/L,其他成分添加量不变(脱脂乳粉100 g/L、乳清蛋白粉20 g/L、甘油4 g/L、异抗坏血酸钠10 g/L、谷氨酸钠8 g/L),在此条件下模型预测的冷冻干燥后活菌数为59.891 2×1010CFU/g。在上述优化所得冷冻干燥保护剂配方条件下进行重复实验,冻干处理后实际活菌数为57.43×1010CFU/g,与预测值接近。因此该模型可较好预测乳双歧杆菌Z-1冷冻干燥保护剂的效果。
3 讨 论
对乳双歧杆菌Z-1冷冻干燥粉活菌数影响最大的因素为L-半胱氨酸盐酸盐添加量,这可能与L-半胱氨酸盐酸盐是双歧杆菌增殖最重要的氨基酸有关,也可能是由于原保护剂配方中L-半胱氨酸盐酸盐添加量偏小,有较大的增加空间,优化效果显著。氨基酸类冷冻干燥保护剂可以在细胞膜和细胞壁间形成缓冲层,抑制冰晶生成[12]。L-半胱氨酸盐酸盐具有极强的亲水性,亲水性强的氨基酸易与菌体表面的蛋白质形成氢键,稳定其结构和功能完整性[13]。Yang Chanyuan等[14]研究表明,L-半胱氨酸盐酸盐可以使双歧杆菌存活率增加25%左右。海藻糖和蔗糖作为保护剂在冷冻干燥过程中被广泛应用,其中海藻糖的保护效果较其他糖类突出[15-16]。但本研究中海藻糖的保护效果并不显著,这主要与原保护剂配方中海藻糖添加量较大有关,而蔗糖添加量存在继续优化的空间。Malferrari等[17]研究表明,蛋白质和蔗糖的添加比例可影响蔗糖的保护效果,但海藻糖没有这种相关性。本研究中蔗糖的保护效果优于海藻糖,也可能与此有关。但在交互作用中,海藻糖与蔗糖、海藻糖与L-半胱氨酸盐酸盐的保护效果均得到加强,说明海藻糖在整个冷冻干燥保护剂体系中十分重要,这与海藻糖本身的分子结构[18]、具有抑制冰晶生成[19]、降低细胞流动性、提高玻璃态转化稳定性[20]和保护细胞内参与代谢的关键酶活力[21]有直接关系。
4 结 论
通过Plackett-Burman试验、最陡爬坡试验及响应面试验设计得出,海藻糖、蔗糖和L-半胱氨酸盐酸盐添加量是影响乳双歧杆菌Z-1冻干粉活菌数的主要影响因素。采用Design Expert V8.0.6软件对试验结果进行分析,得到乳双歧杆菌Z-1最佳冷冻干燥保护剂配方为海藻糖添加量200.51 g/L、蔗糖46.16 g/L、L-半胱氨酸盐酸盐2.31 g/L、脱脂乳粉100 g/L、乳清蛋白粉20 g/L、甘油4 g/L、异抗坏血酸钠10 g/L、谷氨酸钠8 g/L,经重复试验验证,此模型有较好的预测和指导作用。

