非布司他预防肿瘤溶解综合征的临床疗效与安全性研究Δ
陈 梅,凌 亚,刘宇航,李进冬#
(1.泰州市人民医院药学部,江苏 泰州 225300; 2.徐州医科大学药学院,江苏 徐州 221004)
肿瘤溶解综合征(tumor lysis syndrome,TLS)是肿瘤细胞在大量溶解后,细胞内的物质快速释放入血,进而导致的一系列并发症状,常见于急性白血病、淋巴瘤以及其他恶性血液病初始诱导化疗之后[1-3]。化疗期间,儿童和成人发生TLS的概率分别为4%和42%[4-5],临床主要表现为高尿酸血症、急性肾功能不全及高磷低钙血症等[6]。急性肾损伤是TLS的众多症状中最危急的,通常由尿酸沉积于肾小管所致。有文献报道,血尿酸(sUA)每升高1 mg/dl,TLS和肾损伤事件的风险将分别增加1.75倍和2.21倍[4]。因此,控制sUA在预防及缓解TLS中显得尤为重要[1-3]。本研究采用非布司他预防TLS取得了较好疗效,现报告如下。
1 资料与方法
1.1 资料来源
回顾性选取2015年12月至2018年12月泰州市人民医院收治的新诊断或复发难治的恶性血液病患者151例,采用医院的PASS系统2.2.9.3(四川美康医药软件开发有限公司)从以往的住院病历中获得所需要的数据,故属于非干预性研究,不需要直接接触患者,受试者的隐私和个人身份信息得到保护。纳入标准:年龄>18岁;化疗期间使用非布司他或别嘌醇>7 d。排除标准:严重肾功能不全(肌酐清除率<30 ml/min)者;已经接受非布司他或者别嘌醇治疗的高尿酸血症或痛风者;应用其他影响患者sUA的药物者,如丙磺舒、苯溴马隆等。主要资料包括:(1)患者的基本情况,年龄、性别、住院号及入院诊断;(2)患者预防静脉血栓栓塞症药物使用情况,药品通用名称、用法与用量、给药次数、用药时间及药品不良反应。根据治疗方案分为非布司他组55例、别嘌醇A组51例和别嘌醇B组45例。三组患者的基线资料相似,具有可比性,见表1。
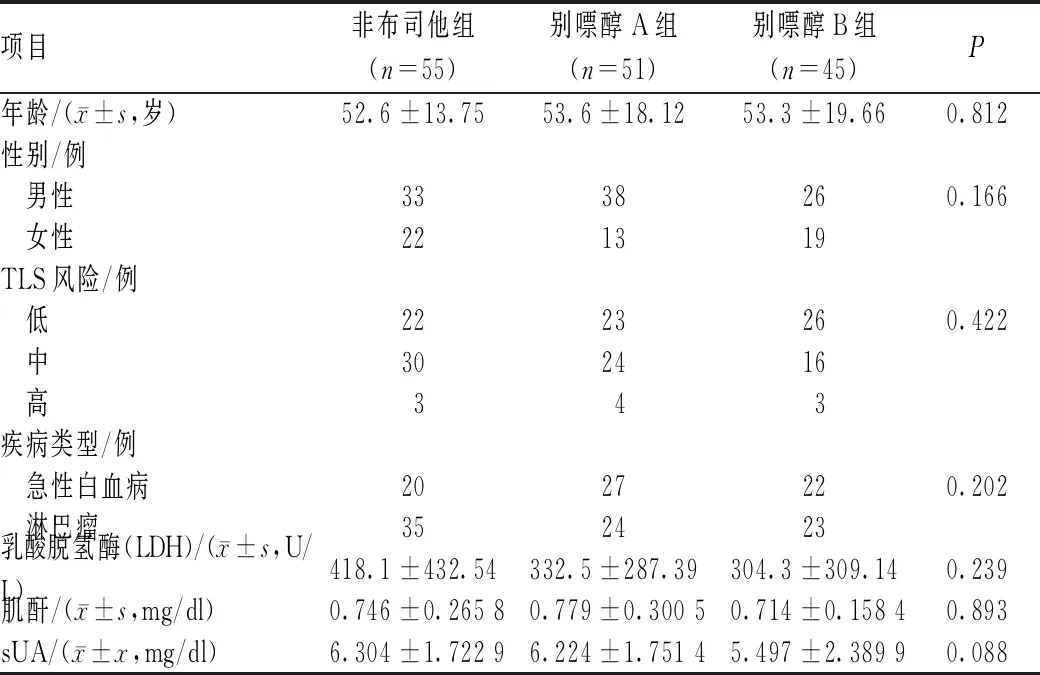
表1 三组患者基线资料比较
1.2 TLS风险评估
根据美国临床肿瘤学会出版的指南对患者化疗后的TLS风险进行评估,以期对不同风险TLS的化疗患者给予相应的预防措施[7]。该指南中根据血液病类型、化疗前白细胞计数、LDH以及肾功能状况评估患者在化疗期间发生TLS的可能性,将概率<1%、1%~5%和>5%分别定义为低风险、中等风险和高风险。TLS可以分为实验室TLS和临床TLS,见表2。在患者化疗3~7 d内符合至少2项指标即可诊断为实验室TLS,临床TLS需要在确诊实验室TLS的基础上出现下列临床症状中至少1项:肾损伤、心律失常、猝死及癫痫发作[8]。
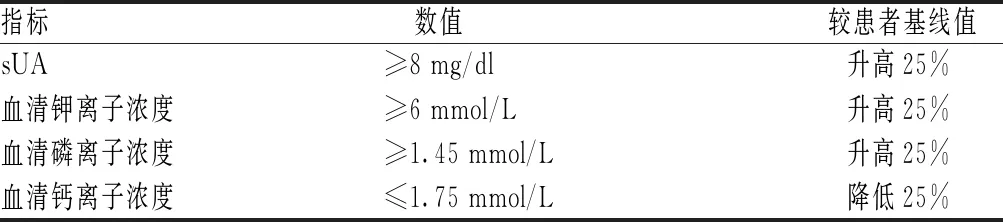
表2 实验室TLS诊断标准
1.3 方法
患者根据世界卫生组织以及美国恶性肿瘤相关指南推荐的白血病、淋巴瘤标准方案进行化疗。三组患者于化疗当日给予降尿酸药物预防,且至少服用7 d(通常化疗期间为7 d)。其中,非布司他组患者口服非布司他片(规格:40 mg)40 mg/d,1日1次;别嘌醇A组患者口服别嘌醇片(规格:0.1 g)300 mg/d,1日3次;别嘌醇B组患者口服别嘌醇片(规格同上)200 mg/d,1日2次。
1.4 观察指标与疗效评定标准
观察三组患者治疗前后的sUA、肌酐水平,评估sUA和肌酐改变百分率。sUA改变百分率(%)=(治疗后sUA-治疗前sUA)/治疗前sUA ×100%;肌酐改变百分率(%)=(治疗后肌酐-治疗前肌酐)/治疗前肌酐×100%。治疗期间收集实验室检查(丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶及胆红素等)数据,根据美国国家癌症研究所于2010年出版的不良事件常用术语标准来评估药物安全性[9]。但本研究未评估血液和淋巴系统、胃肠道系统的常见不良反应,因为其通常与化疗所伴随的药物细胞毒性相关。治疗失败定义为sUA>8 mg/dl[8]。
1.5 统计学方法

2 结果
2.1 三组患者治疗前后sUA水平比较
治疗后,三组患者sUA水平与治疗前的差异均有统计学意义(P<0.001)。方差分析比较,三组患者sUA改变百分率的差异有统计学意义(P=0.007);两两分析比较,非布司他组、别嘌醇A组患者sUA改变百分率的差异无统计学意义(P=0.132),但非布司他组患者sUA改变百分率明显优于别嘌醇B组,差异有统计学意义(P=0.002),见表3。表明非布司他与别嘌醇降低sUA疗效的差异与别嘌醇的药物剂量有相关性。

表3 三组患者治疗前后sUA水平比较
注:avsbvsc,P=0.007;avsb,P=0.13;avsc,P=0.002;bvsc,P=0.08
Note:avsbvsc,P=0.007;avsb,P=0.13;avsc,P=0.002;bvsc,P=0.08
2.2 三组患者治疗前后肌酐水平比较
肾功能方面,治疗后,三组患者肌酐水平与治疗前的差异均有统计学意义(P<0.001)。方差分析比较,三组患者肌酐改变百分率的差异无统计学意义(P=0.174),见表4。表明三组方案对降低肌酐水平均具有较好的疗效,非布司他与别嘌醇在肾功能改善方面的效果相当。

表4 三组患者治疗前后肌酐水平比较
注:avsbvsc,P=0.174
Note:avsbvsc,P=0.174
2.3 三组患者安全性比较
治疗期间,三组患者均未出现痛风或者TLS症状。非布司他组患者中,出现1级肝毒性3例,2级肝毒性1例;别嘌醇A组患者中,出现1级和2级肝毒性各1例;而别嘌醇B组无患者出现肝损伤症状。在回顾性研究期间,服用别嘌醇300 mg/d及200 mg/d的患者各有1例发生严重的过敏性皮疹反应,医师停药并改用非布司他继续预防TLS,该2例患者未被纳入本研究。
3 讨论
TLS是血液恶性肿瘤患者化疗后早期严重的并发症,sUA水平的控制在化疗期间非常关键,通常患者在化疗后48~72 h将会发展为高尿酸血症。英国肿瘤溶解综合征管理指南推荐,对于中或高风险的患者在化疗前给予别嘌醇或拉布立酶预防TLS,如果需要,低风险患者也可以给予别嘌醇进行预防[8]。虽然别嘌醇价格较低,但是发生皮疹、急性肝炎和嗜酸性粒细胞增多症等严重过敏反应的风险较高,且肾功能不全患者需要调整给药剂量[10]。拉布立酶是一种重组尿酸氧化酶,其药理作用是将sUA氧化为尿囊素,进而随尿液排出体外[11-13]。尽管该药起效迅速、效果肯定,但是其免疫原性和价格昂贵限制了其使用[14-15]。非布司他作为新型的降sUA药物,于2009年被美国食品药品监督管理局批准上市,是最近40年来首个被批准上市的抗痛风新药,于2013年2月在我国上市[16]。目前,该药在临床上已经被广泛用于慢性高尿酸血症以及痛风的治疗。虽然暂时没有相关指南推荐非布司他用于预防TLS,但是国外已有相关研究结果表明其临床疗效及安全性的优越性[17]。
非布司他对接受血液病化疗患者的TLS症状的预防效果良好[18-21],且与其剂量有显著相关性。Spina等[18]开展的随机双盲、多中心的Ⅲ期临床试验中,共纳入来自12个国家的恶性血液病患者346例,结果表明,非布司他(120 mg/d)在化疗期间降低sUA的疗效显著优于别嘌醇(300 mg/d)。Tamura等[19]纳入恶性血液病患者100例,随机分为两组,结果显示,化疗期间非布司他(60 mg/d)与别嘌醇(300 mg/d)疗效的差异无统计学意义。另外一项回顾性研究结果表明,非布司他(40 mg/d)与别嘌醇(300 mg/d)疗效的差异无统计学意义[21]。
本研究评估了非布司他在血液恶性肿瘤患者化疗期间预防TLS的临床效果,发现非布司他(40 mg/d)能够显著降低sUA水平。非布司他组、别嘌醇A组患者sUA改变百分率的差异无统计学意义(P=0.132),但非布司他组患者sUA改变百分率明显优于别嘌醇B组,差异有统计学意义(P=0.002)。提示别嘌醇降低sUA水平的疗效与药物剂量有相关性。此外,在肾功能方面,Takai等[17]研究结果显示,非布司他在化疗期间能够显著降低患者的肌酐水平,提高肾小球滤过率,从而起到肾脏保护作用,但是样本量太小。本研究结果显示,治疗后,三组患者的肌酐水平明显低于治疗前,差异均有统计学意义(P<0.001),与国外研究结果一致[17]。因此,非布司他可显著降低血液肿瘤患者化疗期间sUA、肌酐水平,其可能是预防TLS的有效药物。
临床试验结果表明,患者短期及长期应用非布司他的耐受性良好,不良反应与别嘌醇相似[17-21]。非布司他的不良反应存在于血液和淋巴系统(中性粒细胞减少、贫血、白细胞减少、血小板减少及发热伴中性粒细胞减少)、消化道系统(恶心、呕吐、腹泻及便秘)和内分泌系统(代谢紊乱、血糖升高)等[17-21]。而这些不良反应大多数与化疗所伴随的细胞毒性反应类似。本研究发现,别嘌醇组患者发生严重的过敏性皮疹反应2例,非布司他较别嘌醇可能具有更高的安全性。且少量患者服用别嘌醇后可发生皮肤反应,个别患者会转变为重症药疹,病死率极高[21-22],与本研究中2例过敏反应相似。因此,2013年原国家食品药品监督管理总局提醒,应小心别嘌醇引起的类似药疹的不良反应。因此,上述不良反应的发生在某些程度上限制了别嘌醇的使用范围。
综上所述,非布司他用于恶性血液病患者化疗期间能够有效预防肿瘤溶解综合征,且安全性较好。但本研究的局限性在于样本量较小。此外,单中心的人群样本有可能很难预测该结论是否能够适用于所有的患者。因此,需要随机、双盲、多中心的临床试验进一步验证。

