新型冠状病毒患者标本采集技术专家共识
米元元 黄海燕 朱丽群 张淑梅 燕朋波 张小红 郑兰平 王营营 龚贝贝 顾苏 王莹0 吴晓英 付小霞 刘转巧 高漫 白广红 包磊 张艳红 柳怡 赵鸽子 李文晓 陆箴琦 吴赞芳 韦彩云 孙雯敏 蔡喆燚 陈玉英 金歌 孙亮 庄若 曹松梅 吴艳 陈秋菊 韩瑜0 马雪 中华护理学会重症护理专业委员会
(1.华中科技大学同济医学院附属协和医院重症医学科,湖北 武汉 430022;2.江苏大学附属医院,江苏 镇江 212001;3.河南科技大学第一附属医院重症医学科,河南 洛阳 471000;4.天津市医院,天津 北辰 300400;5.湖北文理学院附属医院/襄阳市中心医院,湖北 襄阳 441000;6.复旦大学附属肿瘤医院护理部 复旦大学上海医学院肿瘤学系,上海 200032;7.皖南医学院弋矶山医院急诊科,安徽 芜湖 241000;8.广西南宁市第四人民医院,广西 南宁 530023;9.江苏省盐城市第一人民医院,江苏 盐城 224300;10.天津市第一中心医院,天津 300100;11.北京大学人民医院,北京 100044;12.河南省洛阳市第三人民医院,河南 洛阳 471002;13.陕西省结核病防治院,陕西 西安,710100;14.湖南中医药大学第一附属医院重症医学科,湖南 长沙 410000;15.中山大学附属第一医院,广东 广州 510080;16.郑州大学第一附属医院重症医学科,河南 郑州 450052;17.湖北医药学院附属人民医院,湖北 十堰 442000;18.中国人民解放军联勤保障部队第904医院,江苏 无锡 214044;19.南京大学医学院附属鼓楼医院,江苏 南京 210008;20.山东省立医院,山东 济南 250021;21.陆军军医大学大坪医院,重庆 400042)
标本采集结果作为新冠肺炎筛查及诊断的重要依据,在疾病控制方面发挥着重要的作用。而标本采集质量直接影响检验结果的真实性和准确性。规范临床医务人员进行标本采集,并加强培训和指导,是提高标本采集质量的重要保证。鉴于此,笔者及其团队通过系统检索文献并获取证据,经过2轮德尔菲法咨询,形成本专家共识,并顺利通过中华护理学会团体标准委员会的外部评审。本共识提出了新型冠状病毒肺炎患者标本采集技术的适用范围、术语、定义、缩略语、标本采集基本要求、操作程序、采集过程中意外事件的应急处理等内容,以期规范护理人员新冠肺炎患者标本采集行为,减少医务人员暴露,提高送检标本质量与合格率。
1 范围
本共识给出了新冠肺炎患者标本采集的基本要求、操作程序、意外事件预防及处理原则,不包含支气管和肺泡灌洗液标本的采集。本专家共识适用于各级各类医疗机构的医护人员。
2 术语和定义
下列术语和定义适用于本专家共识。
2.1标本采集(Specimen collection) 根据检查项目需求,采集患者的血液、体液(如胸腔积液、腹水)、分泌物(如鼻咽部分泌物)、排泄物(如尿、粪)等标本进行实验室检测,以辅助临床制定评估、诊疗决策的操作技术。
2.2微生物学检验标本(Clinical microbiological specimen) 临床病毒学、细菌学和真菌学检验(包括涂片镜检、培养、抗原、抗体和分子生物学技术等)所用的标本。
2.3拭子样本采集(Swab sampling collection) 用于采集含病原微生物标本的拭子,由两部分组成。(1)涂抹棒:柄部常为塑料或铝杆,柄部的一端是具有吸附作用的采样头,采样头材质包括脱脂棉、合成聚酯纤维、聚酰胺纤维、人造丝和泡沫聚氨酯等。(2)手柄:位于柄部的另一端,也可作为转运装置(容器或管)的帽。
2.4鼻咽拭子(Nasopharyngeal swab) 采集鼻部分泌物的拭子,采集后用于检测细菌、病毒。
2.5口咽拭子(Oropharyngeal swab) 采集咽部和扁桃体分泌物的拭子,采集后用于检测细菌、病毒。
2.6深咳痰液(Deep cough sputum) 在医务人员指导下患者由气道远端咳出的分泌物,痰液。
2.7支气管分泌物(Bronchial secretion) 由腺体或局部杯状细胞产生分泌物所组成,在正常情况下每天约10~100 mL。
2.8真空采血系统(Vvacuum blood collection system) 运用真空负压原理,通过特定的连接装置将人体静脉血液转移至标本盛装容器的器械组合。
3 缩略语
下列缩略语适用于本专家共识意见。
EDTA:乙二胺四乙酸(Ethylene diamine tetraacetic acid)
BSL:生物安全级别(Biosafety level)
4 基本要求
4.1医疗机构应制定并执行新冠肺炎标本采集与送检流程 见图1。
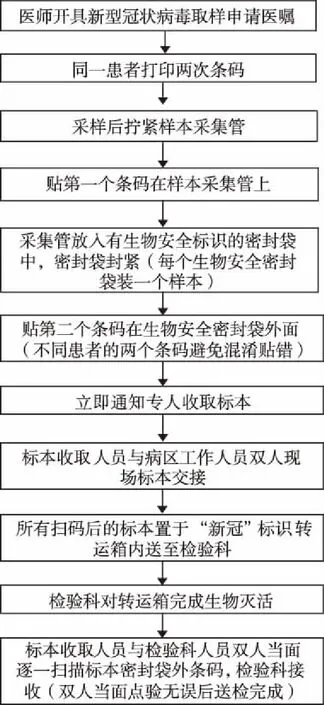
图1 新冠肺炎标本采集与送检流程图
4.2所有标本采集人员应掌握标本采集相应技术规范、操作规程、生物安全防护等,并考核合格[1-2]。
4.3应根据医嘱进行标本采集。
4.4应根据检验项目制定申请单,申请单提供的信息,可依据WS/T 640-2018的标准[3-4]。
4.5应对患者进行评估,根据评估结果选择标本采集的装置、部位和方法[5]。
4.6标本收集容器应遵循WS/T 224-2018规范[6]。
4.7标本采集过程中的感染控制应遵循WS/T 511-2016规范[7]。
4.8标本采集期间产生的医疗废弃物应按照WS/T 510-2016规范[8]进行处置。
4.9标本采集过程中应观察患者生命体征变化,及时识别并处理并发症,必要时停止标本采集。
5 操作程序
5.1操作前评估
5.1.1应评估患者的年龄、意识、自理能力、配合程度等综合因素[3]。
5.1.2采集呼吸道标本时,应评估患者的口鼻腔黏膜有无出血、血氧饱和度、呼吸功能等。
5.1.3采集血液标本,应评估血管条件、穿刺部位[6,9]。
5.2标本采集时机/适应证
5.2.1上呼吸道标本(鼻、口咽拭子) 应在发病1~7 d内采集,尽可能采集发病3 d内的鼻咽拭子标本[1-4,10]。
5.2.2下呼吸道标本 适用于有人工气道患者,重症患者优先采集下呼吸道标本[3,10]。
5.2.3核酸检测的血液标本 应釆集发病后7 d内的空腹血,使用含有EDTA抗凝剂的真空釆血管采集血标本5 mL[1]。
5.2.4抗体测定的血清标本 应釆集发病后7 d内和发病后第3~4周空腹血,使用无抗凝剂的真空釆血管采集血液标本5 mL[1]。
5.2.5粪便采样指征 粪便常规标本检查;患者出现腹腹泻等消化道症状。
5.3采集流程
5.3.1应根据标本采集医嘱及环境情况,准备采集用具(试剂盒或标本收集容器)。
5.3.2应核对患者信息、申请采集的项目、取样标识,标本采集容器先贴好条形码[3]。
5.3.3应嘱清醒的患者取舒适体位,解释标本采集的目的、方法及注意事项。
5.3.4鼻咽拭子采集
5.3.4.1患者头部后仰(约 70°),保持不动[11]。
5.3.4.2用拭子棒估测耳根到鼻孔距离[1,4]。
5.3.4.3自鼻孔垂直面部方向插入,深入距离最少应达耳垂部位到鼻尖长度的一半。遇到阻力后即到达后鼻咽,应停留数秒吸取分泌物(一般要求15~30 s),应旋转拭子3~5次[1-2,11]。
5.3.4.4宜轻轻旋转取出拭子,拭子头浸入装有2 mL裂解液的收集管或含 RNA 酶抑制剂的细胞保存液中[1]。
5.3.4.5顶端处折断无菌拭子杆,尾部弃去,旋紧管盖并用封口膜封闭[1,4]。
5.3.5口咽拭子采集
5.3.5.1嘱患者先用生理盐水或清水漱口[12]。
5.3.5.2将拭子放入无菌生理盐水中湿润。
5.3.5.3嘱患者坐下,头后倾,张大嘴,并发“啊”音[12]。
5.3.5.4用压舌板固定舌头,拭子越过舌根到咽后壁及扁桃体隐窝、侧壁等处[1,4]。
5.3.5.5应先用拭子适度用力来回擦拭双侧咽扁桃体至少3次,然后再咽后壁至少3次,3~5次为宜[2,11]。
5.3.5.6取出拭子,避免触及舌头、悬垂体、口腔黏膜和唾液[1,4]。
5.3.5.7将拭子头浸入含2~3 mL病毒保存液中[2]。
5.3.5.8靠近顶端处折断无菌拭子杆,尾部弃去,旋紧管盖并用封口膜封闭[1,4]。
5.3.6深咳痰液标本
5.3.6.1用无菌生理盐水漱口。
5.3.6.2深呼吸数次后深咳。
5.3.6.3将咳出的痰液直接放入痰液收集杯。
5.3.7有人工气道的患者,应采用人工吸痰方式留取支气管分泌物[10]。
5.3.8静脉血标本采集
5.3.8.1直接静脉穿刺采血 (1)采血部位应首选肘窝静脉,优先顺序依次为正中静脉、头静脉及贵要静脉;应避开有皮损、炎症、结痂、疤痕的血管[6,9]。(2)穿刺前应皮肤消毒,以穿刺点为中心,由内而外消毒2次,直径为5 cm[9]。(3)外周静脉输液结束后3 h,输注脂肪乳剂等代谢缓慢且严重影响检测结果的,宜在下次输注前采血。紧急情况必须在输液时采血时,宜在输液的对侧肢体或同侧肢体输液点的远端采血,并告知检验人员[13]。(4)应在穿刺点上方约6 cm处系止血带,扎止血带时间宜小于1 min[9]。(5)右手持针与皮肤成20°左右穿刺。(6)采血完毕,应按压穿刺点直至不出血。
5.3.8.2经静脉通路装置采血 (1)应使用最大的导管内腔采血。(2)输液中的静脉导管,采血前应停止输液,外周静脉导管停止输液3 h[13],中心导管停止输液10 min[9]。(3)移除导管接头,消毒导管接口。(4)可使用弃血法或推拉法(适用于重症监护病房患者)进行标本采集。经静脉通路装置采集血液标本步骤,见表1。(5)采集后,应立即用20 mL生理盐水冲封管,并更换新的输液接头。

表1 经中心静脉通路装置采集血液标本步骤
注:导管采集血标本仅限于外周静脉穿刺困难或怀疑导管相关性血流感染的患者。
5.3.8.3动脉血标本的采集 (1)宜使用专用血气针,如采用普通注射器抽血标本,应先抽取0.1 mL肝素溶液湿润(用生理盐水配成100 U/mL)注射器内壁后排尽[9]。(2)宜首选桡动脉、肱动脉等作为穿刺部位。(3)消毒皮肤待干。(4)应持注射器(或血气针)在两指间垂直或与动脉走向成40°左右刺入,有鲜红血涌出0.5~1 mL为宜[9]。(5)应加压按穿刺点5~10 min。(6)另一手拔针后,迅速刺入橡胶塞内(血气针即时套上针帽)隔绝空气。(7)应滚动混匀至少5s,标本放置时间应<1 h。
5.3.9粪便采集 根据患者自理能力,宜选择自然排便法或肛拭子法。
5.3.9.1自然排便法 患者在干燥清洁便盆(避免使用坐式或蹲式马桶)内自然排便后,挑取约3~5 g(黄豆大小)的便标本放于含2 mL生理盐水(有条件可添加RNA酶抑制剂)的无菌便盒中[1-2]。
5.3.9.2肛拭子 用肥皂水将肛门周围洗净,用消毒棉拭子轻轻插入肛门3~5 cm,再轻轻旋转拔出,立即放入含有3~5 mL病毒保存液的15 mL外螺旋盖采样管中,弃去尾部,旋紧管盖。本方法仅适用于排便困难的患者或婴幼儿,不推荐使用肛拭子做常规标本。
5.4废弃物处理原则
5.4.1应由经过培训的人员使用个人防护装备和设备处理危险废弃物[2]。
5.4.2含病原体的标本与标本接触过的医疗废物,应在产生地点先进行压力蒸汽灭菌或化学消毒处理,然后再用3层医疗垃圾袋盛装,标注“感染性废物”[2,8,14-17]。
5.4.3离开污染区前,应再次对封口包装表面采用1 000 mg/L的含氯消毒液均匀喷洒或在其外面加套一层医疗废物包装袋[8,14-19]。
5.4.4垃圾袋和利器盒应贴红色高感染性废弃物标识及“新冠”标签[2,15-18]。
5.4.5医疗废物应放入专用转运箱密闭转运,转运箱外应粘贴红色高感染性废弃物标识及“新冠”标签[15-18]。
5.4.6应对医疗废物进行登记,特别注明“新型冠状病毒感染的肺炎”或“新冠”[15-18]。
5.5采集过程中的观察与监测
5.5.1应注意观察患者的面色、呼吸、心率和血氧饱和度改变,若有异常反应须及时处理。
5.5.2血液标本采集时,应告知患者穿刺出现肿胀、疼痛等异常不适时,及时告知医务人员。
5.6标本保存与运输
5.6.1应将密闭后的标本装入密封袋,每袋限一份标本,依次装入标本盒、标本转运箱,并保持标本直立,避免剧烈摇晃[3,18,19]。
5.6.2特殊标本宜加特殊标识[3]。
5.6.3标本袋、标本转运箱、转运人员资质应遵循WS/T 640-2018规范[3]。
5.6.4转运人员应培训合格[13],标本应专人(至少2人)护送[18]。
5.6.5内部转运时,应采集之后30 min内运抵实验室,不宜超过2 h[1-2,4];外部转运时,宜定时定点转运交接[18]。
5.6.6涉及到病毒或核酸检测的标本应置于4 ℃冰箱保存,保存时间不超过24 h[2,18]。
5.6.7直肠拭子采集的标本应置于Cary-Blair运送培养基中送检。
6 标本采集期间标本溢洒的应急处理
6.1标本溢漏时,使用有效氯含量0.55%的消毒纸巾覆盖吸收溢出物,从溢漏区外围开始,逐步向中心区消毒,消毒时间为30 min以上后按医疗实验室废弃物处理。
6.2标本泄露产生气溶胶喷溅时采取三级生物安全防护[2]。
6.3发生标本泄露应立即更换手套。
6.4应保持空间密闭,避免不相关人员出入。
利益冲突 所有作者均声明不存在利益冲突。

