氧化锌/多孔石墨烯电化学免疫传感器检测食管癌肿瘤标志物CEA
景爱华,李 宇,许 琼,冯文坡
癌胚抗原(carcinoembryonic antigen,CEA)是一种重要的广谱肿瘤标志物,常用作早期诊断结肠癌和乳腺癌的特异性标志物,也与其他肿瘤标志物联合检测用于食管癌、肺癌及其他恶性肿瘤[1-5]。CEA的高灵敏检测在癌症的早期诊断和筛选疾病复发中扮演重要的角色。许多专业的检测手段,如放射免疫分析法、化学发光分析法、酶联免疫法等已经用于CEA的检测[6-8]。与传统的免疫方法相比,电化学免疫法因灵敏度高、成本低、检测速度快、易于实时原位检测吸引了更多的关注。石墨烯复合材料在免疫传感器领域的应用已屡见不鲜[9],例如Dong等[10]通过金纳米粒子固定水溶性石墨烯量子点,Zhu等[11]用金纳米粒子复合石墨烯,王丽娟等[12]使用金纳米颗粒和有机物壳聚糖来复合石墨烯,Huang等[13]利用Ag/Au纳米颗粒来包覆石墨烯,Wang等[14]用硫堇(Thi)/金纳米粒子(AuNPs)来修饰氨基官能石墨烯(NH2-G),Liu等[15]采用金纳米粒子/离子液体功能化还原氧化石墨烯(IL-rGO-AuNPs)复合材料来修饰电极,对CEA进行检测。
此外,复合材料因其结合多种材料的优点而在生物传感领域备受瞩目。纳米氧化锌(Zinc oxide,ZnO)是一种宽带隙半导体材料,具有生物相容性好、在生理环境中化学稳定性相对良好、比表面积大等优点,在光学、光电子学、传感器等领域有着广泛的应用[16-18]。
本研究中,首先获得多孔石墨烯(HGO),随后采用湿化学法将ZnO纳米粒子生长在HGO表面,构建了一种ZnO/HGO复合材料的电化学传感器,通过抗原抗体之间特异性结合实现对CEA的高灵敏检测。
1 材料与方法
1.1 仪器与试剂CHI660E电化学工作站(上海辰华仪器有限公司),三电极体系:工作电极为玻碳电极,参比电极为饱和甘汞电极,铂丝电极为对电极;FD-ID50冷冻干燥机(北京盛超科创生物科技有限公司);JEOL JSM IT100扫描电子显微镜(SEM);D8 ADVANCE X射线衍射仪(XRD)。CEA抗体(anti-CEA)、癌胚抗原(CEA)、牛血清白蛋白(BSA)购于上海生工生物工程公司,磷酸盐缓冲溶液由0.1 mol·L-1Na2HPO4和0.1 mol·L-1KH2PO4配制,其他试剂均为分析纯,使用前未经纯化处理,实验用水为去离子水。
1.2 HGO的制备GO和HGO都按照以前本实验室发表文献中所示方法获得[9]。GO通过改良的Hummer法制得,具体如下:首先,低温时将3 g KMnO4加入石墨、NaNO3、H2SO4混合液中(质量比为3∶1∶85)。接着,在35 ℃保持1 h,然后加入40 mL蒸馏水,0.5 h后,加入0 ℃蒸馏水100 mL。最后,加入5 mL H2O2(30%),用5%的稀盐酸和蒸馏水洗涤至溶液的pH值接近6。将产物于真空60 ℃条件下干燥,得到的褐色固体即为氧化石墨烯。重分散于一定的蒸馏水中超声分散处理30 min。静置后取上层清液,即得GO。HGO的制备:将5 mL 30%的H2O2溶液与50 mL 2 mg·mL-1的GO溶液混合,然后在100 ℃的温度下加热并搅拌2 h。之后离心、洗涤、重分散,最终制得2 mg·mL-1的深色HGO悬浮液,备用。
1.3 ZnO/HGO复合物的制备ZnO/HGO复合物的获得是通过采用水热法在HGO表面生长ZnO纳米颗粒。首先将制备好的HGO 50 μL滴在玻碳电极表面,然后置于40 ℃烘箱内烘干。然后面朝下放置在0.05 mol·L-1Zn(NO3)2-NH3H2O (V/V,1∶1)混合液200 mL中,60 ℃恒温一定时间。
1.4 电化学免疫传感器的制备将ZnO/HGO/GCE修饰电极置于anti-CEA溶液(0.3 ng·mL-1)中,4 ℃下孵育12 h。接着,将电极浸于质量分数为0.25% BSA(w/w)溶液中,在37 ℃下孵育40 min ,封闭非特异性吸附活性位点。最后放入CEA溶液中,37 ℃下孵育1 h,即制得电化学免疫传感器并置于4 ℃的冰箱中保存待用。
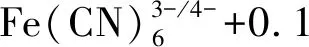
2 结果
2.1 材料的表征对所制备的ZnO/HGO材料进行表征。图1中片层堆积的HGO表面,覆盖颗粒状ZnO,ZnO/HGO整体呈现比较有序的致密堆叠结构。结构间有空隙,形成三维状,可以有效增大修饰电极表面积。XRD衍射图如图2,其中,ZnO/HGO衍射峰中31.6°、34.5°、35.1°、47.1°、56.7°、62.6°为ZnO的衍射峰,分别对应于(100)、(002)、(101)、(102),(110)、(103)。这些峰与ZnO的六方纤锌矿晶体结构(JCPDS文件编号99-0111)完全一致[19]。表明水热生长在HGO表面上的ZnO具有比较高的晶体质量。
2.2 修饰电极的电化学行为CV和电化学EIS是考查电极表面常用的电化学检测方法。图3-4是玻碳电极(GCE)和修饰了ZnO/HGO、anti-CEA、BSA、CEA后的CV和EIS图。从图3中,当电极上依次修饰上ZnO/HGO/GCE(a),anti-CEA(b),BSA(c)和CEA(d)后,峰电流逐渐降低。这是由于随着anti-CEA,BSA和CEA修饰在电极表面,这些生物分子不导电,阻碍了电子在这些分子界面的传递,导致氧化还原峰电流随着修饰步骤进展而逐渐降低。图4中可以看出,随着玻碳电极表面逐步修饰了ZnO/HGO、anti-CEA、BSA、CEA后,EIS谱中容抗弧半径越来越大,这也是因为anti-CEA、BSA、CEA等蛋白质生物分子不导电,阻碍了电极表面电子的有效传递过程,从而在极化电阻上显示出逐渐增大的情况。该结果同图3所示CV的结果相对应,表明免疫传感器顺利制备出来。

图1 ZnO/HGO扫描电镜图
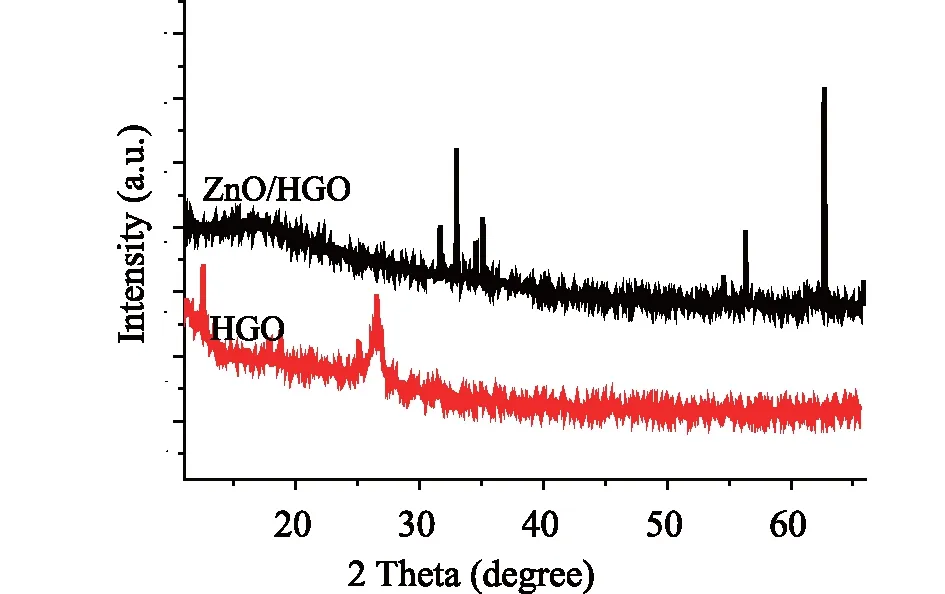
图2 ZnO/HGO和HGO的XRD衍射图
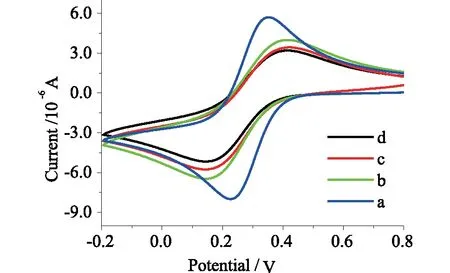
a-d:ZnO/HGO/GCE、anti-CEA/ZnO/HGO/GCE、BSA/anti-CEA/ZnO/HGO/GCE、CEA/BSA/anti-CEA/ZnO/HGO/GCE图3 不同修饰电极的CV图
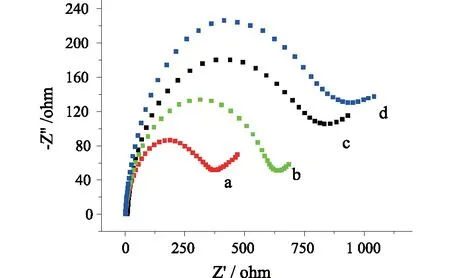
a-d:ZnO/HGO/GCE、anti-CEA/ZnO/HGO/GCE、BSA/anti-CEA/ZnO/HGO/GCE、CEA/BSA/anti-CEA/ZnO/HGO/GCE图4 不同修饰电极的EIS图
2.3 不同实验条件的影响
2.3.1 pH的影响分别考察在pH 6.8~7.6的PBS溶液中,免疫传感器的电流响应情况。如图5可见,在pH 6.8~7.4范围内,电流随着pH 的增大而增大,pH 7.4时电流峰值达到最大;当pH由7.4增大到7.6时,峰电流又随着pH的增大而降低,峰电流在pH7.4时达到最大值,这和体液环境的pH相似。在实验过程中,选择pH 7.4的测试底液。
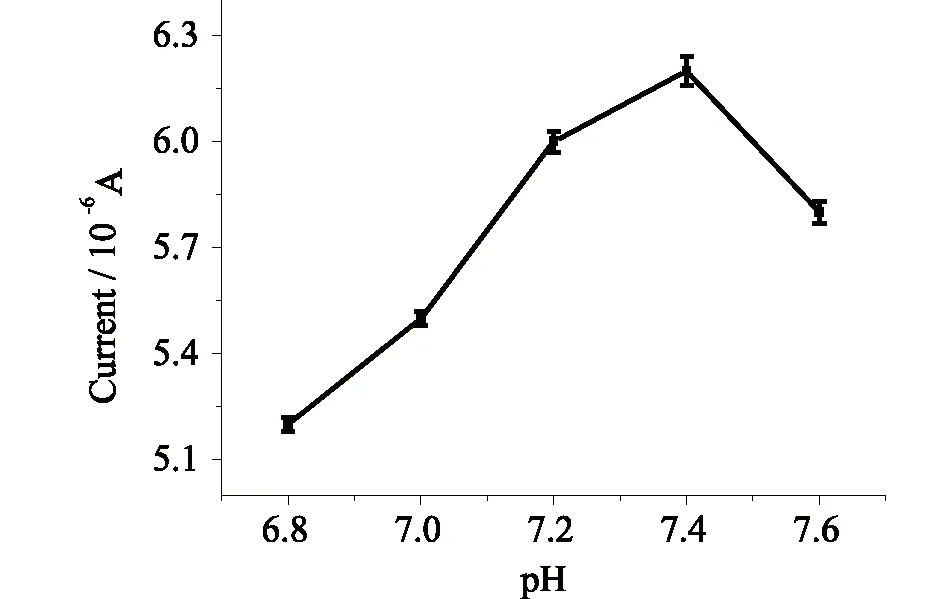
图5 pH的影响
2.3.2 CEA孵育时间的影响传感器于相同浓度的CEA 标准溶液中孵育不同时间的电化学响应情况如图6所示,随着孵育时间延长,抗原与抗体结合量逐渐增大,响应增强,在40 min后,传感器响应情况趋于平衡,抗原抗体的结合达到饱和。选择孵育时间为40 min。
2.4 传感器的响应特性在优化条件下,利用免疫传感器对不同浓度的CEA进行测定,记录它们的差分脉冲伏安信号。从图7可见,随着CEA浓度的增加,CEA/BSA/anti-CEA/ZnO/HGO/GCE免疫传感器的峰值电流也逐步增加。图8为电流响应随CEA浓度变化的线性关系图,校准曲线显示峰电流变化值与CEA的对数浓度在0.1~40 ng·mL-1范围内呈现良好的线性关系,线性方程分别为,△I=5.95+1.48 log CCEA(ng·mL-1),相关系数为0.9932(S/N=3),检出限为0.07 ng·mL-1。将本方法与文献报道的方法进行了比较,见表1。结果表明,本研究制备的传感器与其他研究具有相似的灵敏度、线性范围和检出限。
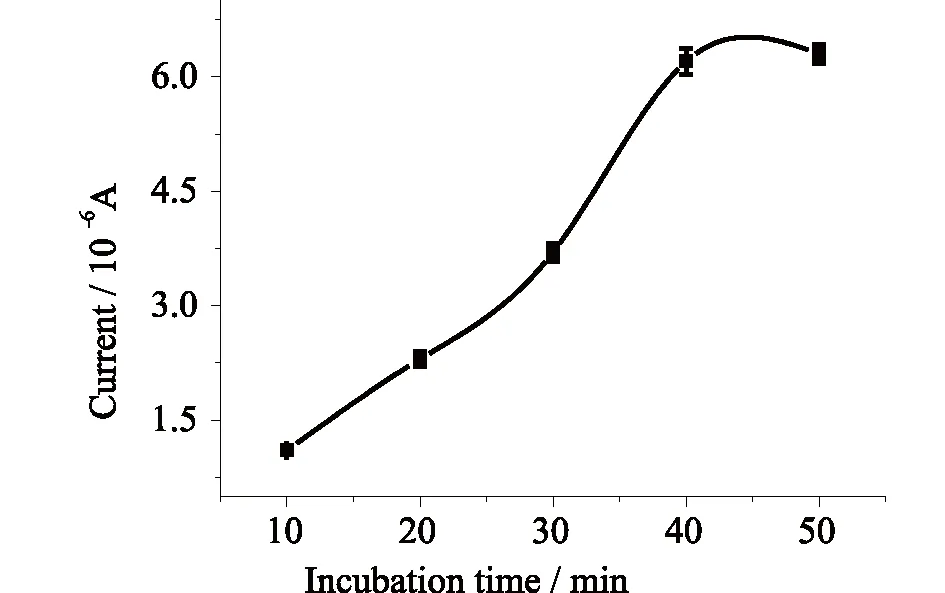
图6 CEA孵育时间的影响
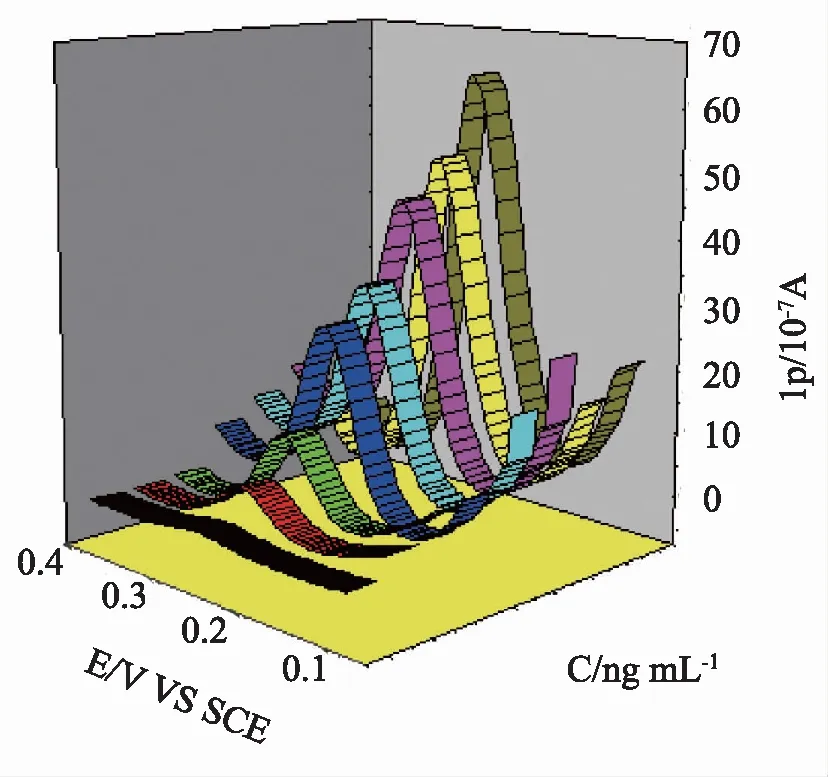
图7 免疫传感器对不同浓度CEA的DPV响应(0.1、0.2、0.5、1.0、5.0、10、20和40 ng·mL-1)
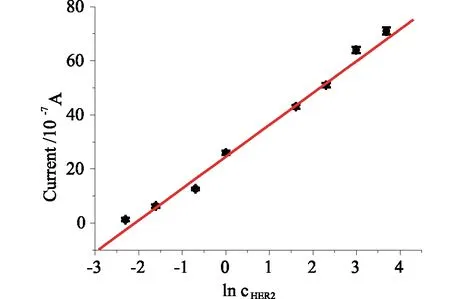
图8 免疫传感器对CEA的校正曲线
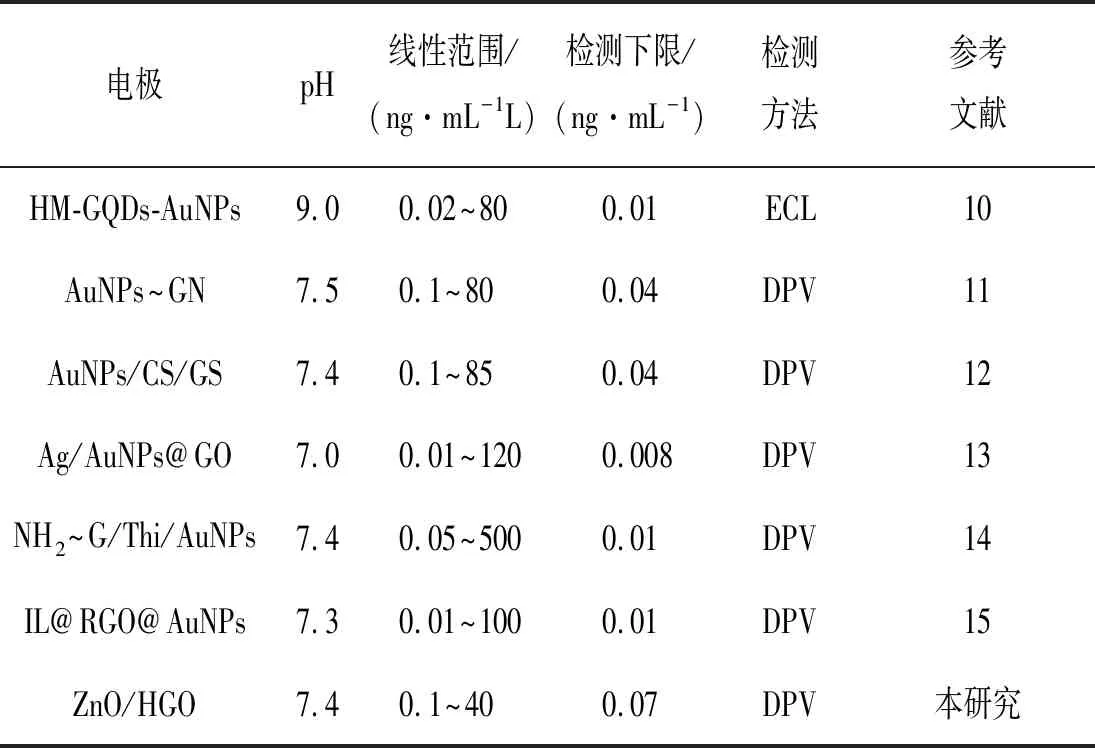
表1 不同文献报道免疫传感器检测CEA比较
2.5 特异性、重现性和稳定性本研究引入了几种人体环境可能存在的干扰物来探讨该免疫传感器的特异性,包括L-半胱氨酸(L-Cysteine)、甲胎蛋白(AFP)、葡萄糖(Glucose)、牛血清蛋白(BSA)、人免疫球蛋白(human IgG)、尿酸(UA)。检测情况如图9所示,CEA浓度低(1 ng·mL-1)时获得检测信号的强度远远高于其他干扰物质浓度高(50 ng·mL-1)时的信号强度(n=5),这表明使用该免疫传感器测定CEA时,干扰物质不会对CEA的测定产生干扰,免疫传感器特异性良好。重现性是评价免疫传感器性能的一个重要指标。本实验中,使用相同的方法制备5支免疫传感器,分别用于测定10 ng·mL-1CEA,所得的峰电流的相对标准差为3.6%,可见该免疫传感器重现性良好。此外,研究发现,该免疫传感器在4 ℃下保存2周后,仍旧能够保留原电流响应强度的96%,可见其稳定性良好。
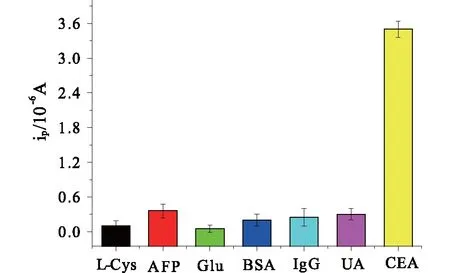
图9 免疫传感器的特异性
2.6 样品测定用所制电化学免疫传感器测定食管癌患者血清样品,取PBS溶液稀释10倍的血清样品进行测定,结果如表2所示,相对标准偏差3.5%~5.7%,回收率93.4%~103.2%。说明该方法测定食管癌患者血清中的CEA含量,所得结果准确可信。
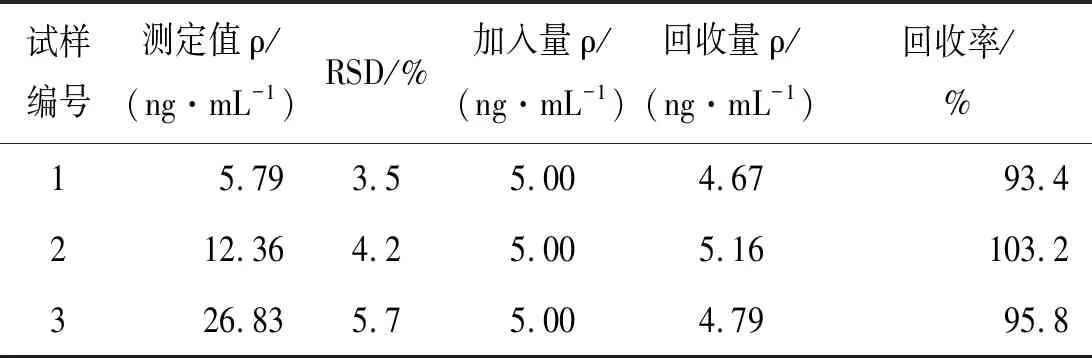
表2 样品测定
3 讨论
本实验利用ZnO/HGO构建了一种新型的CEA电化学免疫传感器。首先通过湿化法获得多孔石墨烯(HGO),这是一种二维基面上具有纳米级孔隙的碳材料,它不仅能提高物质运输效率、增大了比表面积、增多了活性位点,还能够有效地防止石墨烯的团聚,随后采用湿化学法将ZnO纳米粒子生长在HGO表面,构建了一种ZnO/HGO复合材料的电化学传感器,将ZnO宽带隙、生物相容性好、在生理环境中化学稳定性相对良好、比表面积大等优点,与石墨烯优良的导电性、活性电位结合起来,具有较大的比表面积、优良的生物相容性以及良好的催化作用,不仅大大增加了生物分子的固定量,还显著提高了传感器的检测灵敏度和稳定性。
随后该研究将免疫学方法与电化学方法相结合,以[Fe(CN)6]3-/4-为电化学探针,通过抗原抗体之间高度的特异性结合实现对CEA的高灵敏检测,取得了较宽的响应范围0.1~40 ng·mL-1,较低的检测下限0.07 ng·mL-1,最后将该免疫传感器用于食管癌患者血清样品中CEA的检测,效果良好,相对标准偏差3.5%~5.7%,回收率93.4%~103.2%。说明该方法测定食管癌患者血清中的CEA含量,所得结果准确可信。与传统的免疫方法相比,此免疫传感器制作简单、使用方便、成本低、灵敏度高、检测速度快、易于实时原位检测。在生物医学、临床诊断、健康检测等方面具有潜在的应用价值。

