牙龈卟啉单胞菌在食管癌变过程中的作用研究
孟倩倩,原 翔,刘怡文,杨海军,张耀文,刘安祥,高社干,周福有
牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg)为寄居于口腔牙龈上皮细胞内的厌氧菌,该病原菌的生长会影响整个口腔微生态的平衡,导致炎症反应。慢性炎症与肿瘤的发生密切相关,Pg生长引发的长期炎症可促进肿瘤的发生[1]。作者前期研究发现Pg感染与食管鳞癌的相关性[2],对其促癌机制也进行了相应研究[3-4],但尚无Pg感染促进食管癌变过程的直接证据。作者针对Pg感染在食管癌前病变进展为食管癌过程中的作用,进行了研究,现报道如下。
1 材料与方法
1.1 研究对象选取2007年2月至2012年12月在安阳市肿瘤医院(河南科技大学第四附属医院)经内镜活检病理诊断为食管癌前病变的患者73例,随访5 a后再次行内镜活检病理检查,按5 a后病理诊断结果分为两组:5 a后进展为食管鳞癌者为观察组(33例),5 a后仍为癌前病变者为对照组(40例)。本研究经过安阳市肿瘤医院伦理委员会审核同意。
1.2 研究材料Pg抗兔单克隆抗体(abcam公司),SP超敏试剂盒(中杉金桥),苏木素染液、中性树胶(迈新生物公司),其他试剂(索莱宝公司)。多功能酶标仪、冷冻离心机(美国Thermo公司),组织脱水机、包埋机、切片机、烤片机、摊片机(美国莱卡公司),显微镜(日本Nikon公司),涡旋振荡器(美国Eppendorf公司)。
1.3 方法所有食管病变石蜡组织4 μm厚连续切片,采用链霉菌抗生素蛋白—过氧化物酶连接法(SP法)进行免疫组织化学检测,测定食管病变组织样本中Pg的表达情况。
1.4 结果判定标准随机选取5个高倍镜视野观察(×200),按照组织切片的染色强度和染色面积进行半定量分析,具体的标准如下:①染色强度评分标准:细胞未染色者为阴性,计为0分;细胞染色较弱,呈浅黄色者为弱阳性,计为1分;细胞染色结果呈棕黄色者为中度阳性,计为2分;细胞染色较强,呈棕褐色者为强阳性,计为3分。②染色面积评分标准:阳性细胞率≥0%且<5%,计为0分;阳性细胞率≥5%且<25%,计为1分;阳性细胞率≥25%且<50%,计为2分;阳性细胞率≥50%且<75% ,计为3分;阳性细胞率≥75%,计为4分。③免疫组化总分=染色强度评分乘以染色面积评分,总分0分表示阴性(-);总分≥1分表示阳性。
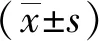
2 结果
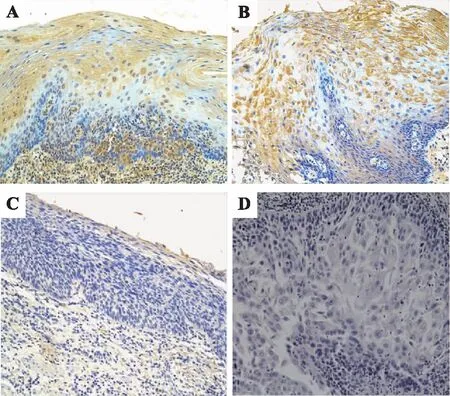
观察组中5 a前Pg感染阳性率42.40%,免疫组化评分6.33;5 a后Pg感染阳性率54.50%,免疫组化评分10.17。5 a后Pg感染阳性率增加了12.10%,组内免疫组化评分比较P=0.034,差异有统计学意义(P<0.05)。对照组在5 a前Pg感染阳性率40.00%,免疫组化评分2.93;5 a后Pg感染阳性率45.00%,免疫组化评分7.77。5 a后Pg感染阳性率增加了5.00%,组内免疫组化评分比较P=0.038,差异有统计学意义(P<0.05)。5 a前观察组患者的Pg阳性率高于对照组,观察组免疫组化评分也明显高于对照组,组间免疫组化评分比较P=0.023,差异有统计学意义(P<0.05);5 a后观察组患者的Pg阳性率明显高于对照组,观察组免疫组化评分也明显高于对照组,组间免疫组化评分比较P=0.032,差异有统计学意义(P<0.05)。见表1、图1-4。

表1 两组在5 a前、5 a后样本中Pg的阳性表达情况 例(%)
A:1例Pg感染阳性患者5 a前的免疫组化结果;B:同一Pg感染阳性患者5 a后的免疫组化结果;C:1例Pg感染阴性患者5 a前的免疫组化结果;D:同一Pg感染阴性患者5 a后的免疫组化结果。图1 观察组Pg免疫组化结果(×200)
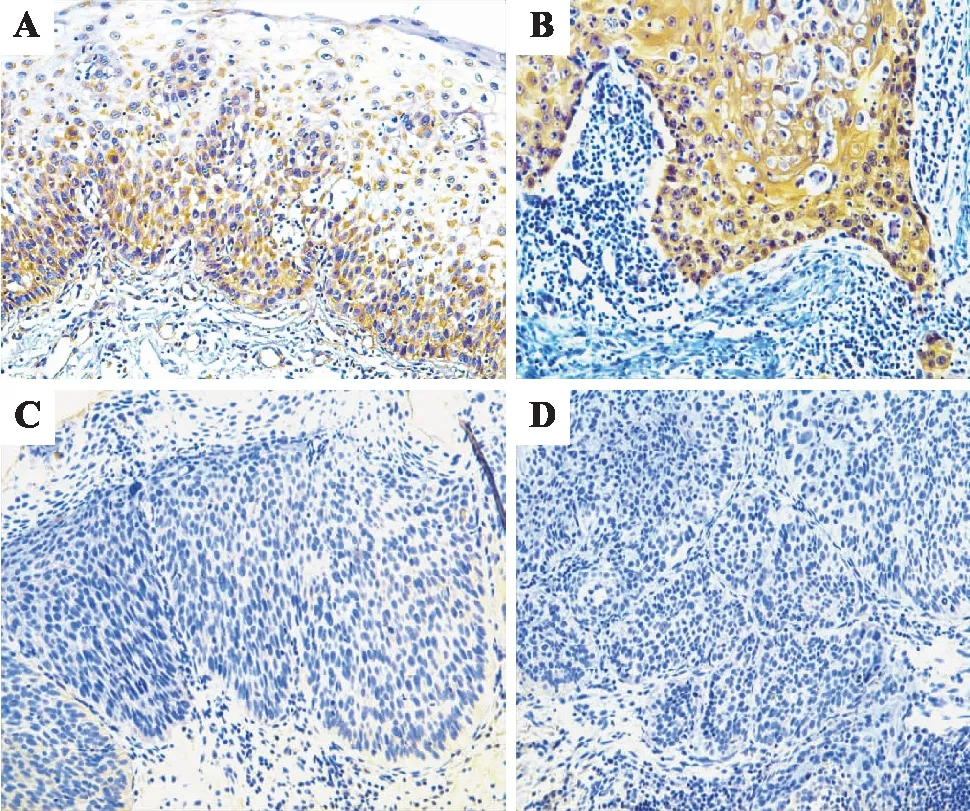
A:1例Pg感染阳性患者5 a前的免疫组化结果;B:同一Pg感染阳性患者5 a后的免疫组化结果,C:1例Pg感染阴性患者5 a前的免疫组化结果;D:同一Pg感染阴性患者5 a后的免疫组化结果。图2 对照组免疫组化结果(×200)
A:观察组5 a前后Pg感染率情况;B:对照组5 a前后Pg感染率情况;C:观察组及对照组5 a前后Pg感染率的比较。图3 两组5 a前后Pg感染率对比柱状图
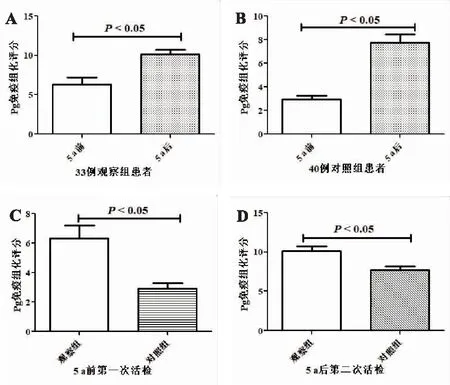
A:观察组5 a前、5 a后Pg免疫组化评分的比较;B:对照组5 a前、5 a后Pg免疫组化评分的比较;C:两组5 a前Pg免疫组化评分的比较;D:两组5 a后Pg免疫组化评分的比较。图4 两组5 a前后Pg免疫组化评分柱状图
3 讨论
我国食管癌在病因和组织学发生等方面与西方显著不同,全球每年新增50万例食管癌患者中,一半以上发生在中国;食管鳞癌是我国主要组织学类型,占95%;食管鳞状上皮从正常→各级癌前病变(基底细胞过度增生、不典型增生、原位癌)→早期浸润鳞癌的多阶段演进过程是中国人食管鳞癌主要组织学发病模式[5]。影响食管癌发生的因素较多,吸烟、饮酒、食管黏膜损伤、人乳头状瘤病毒感染及遗传均可能增加食管鳞癌的发生风险。
由于我国食管鳞癌的确切病因和发病机制尚不清楚,食管癌一级预防即病因学预防也无法实施,二级预防的“三早”(早期发现、早期诊断、早期治疗)一直是我国食管癌防控的主要战略。近年来细菌感染作为食管鳞癌病因学之一,研究工作取得较大进展,Pg感染作为食管鳞癌的发病危险因素的研究也逐渐增多,为下一步食管鳞癌的一级预防提供了思路。本研究探讨Pg是否参与促进食管癌变的过程,为Pg感染作为食管鳞癌发生发展的危险因子提供直接证据。
本研究结果显示,观察组的病变组织中5 a前、后Pg感染阳性率和免疫组化评分均明显高于对照组,表明在食管癌前病变患者中,Pg感染阳性者相比阴性者更易于进展为食管鳞癌,进一步验证Pg感染可能为食管癌的致病危险因素之一,Pg感染可能参与了癌前病变进展为食管癌的过程,增加了食管癌变的风险。Pg感染促进食管癌变的可能机制:人体口腔与食管在解剖学结构上相互连通,在组织结构上均为鳞状上皮组织,口腔上皮细胞感染的Pg可能会转移寄居于机体的食管上皮组织,导致食管上皮细胞Pg感染;感染改变食管黏膜组织局部的微环境,影响微生物的分布比例,促进食管黏膜组织发生慢性炎症反应,加速局部组织的损伤,进一步会影响细胞中抑癌基因和促癌基因的表达水平,诱导细胞的恶性转化,从而诱发食管鳞癌[6]。
作者前期研究也表明食管癌患者的正常黏膜组织与癌组织间的微生态菌群生物结构存在显著差异,肿瘤组织中Pg丰度显著高于癌症患者的正常黏膜组织和健康人的黏膜组织[7],从而揭示了Pg可能会通过影响微生物群落与宿主相互作用而参与食管癌的发病过程。近期研究显示,Pg会随唾液进入消化道,食管癌组织的Pg感染率明显高于贲门癌及胃癌,也间接提示Pg在食管癌发病中作用的重要性[3,8]。本研究中所有5 a前Pg感染阳性的患者在5 a后仍然为阳性,一定程度上反映了机体的食管黏膜一旦感染Pg,单纯依靠组织自身的防御免疫系统无法自行清除。本研究为今后研发抗Pg疫苗或清除Pg感染的方法来降低食管癌的发病率提供依据,为食管癌的预防提供了一个新的方向和视角。

