健康孕妇各妊娠期及产后铁代谢指标水平变化及参考区间建立
尹明秀,周文杰,于 凡,刘 欢△
(四川大学华西第二医院:1.检验科;2.出生缺陷与相关妇儿疾病教育部重点实验室,四川成都 610041)
缺铁是全球最常见的微量元素营养缺乏症。缺铁性贫血孕妇在生产时容易出血,且患败血症的风险也会增加[1]。妊娠期间铁储存量少,而铁需求量增加近10倍[2],故妊娠期缺铁在临床上较为常见。2016年的一项调查显示,我国大、中城市孕妇缺铁的患病率为48.16%,缺铁性贫血的患病率为13.87%,其中妊娠早、中、晚期缺铁性贫血的患病率分别为1.96%、8.40%、17.82%;县、乡级地区孕妇由于缺乏妊娠期营养保健,患病率可能更高[3]。此外,妊娠期高铁也会影响孕妇健康,高血红蛋白(Hb)或高血清铁蛋白(SF)可使妊娠期糖尿病的发生风险分别增加50%和2倍以上[4]。孕妇在没有贫血症状的情况下诊断缺铁较为困难,铁状态的常规检查包括血液学指标和铁代谢指标。其中Hb是筛查缺铁最简便、快捷的血液学指标,但其检出意味着已经是贫血晚期,无法早期辨别出缺铁性贫血。此外,除缺铁外,导致贫血的其他各种疾病也会引起Hb缺乏,故用Hb来评估人体铁状态的特异性较差;因此,临床上主要用铁代谢指标来监测孕妇铁状态。由于妊娠期的生理变化,使用非妊娠妇女的铁代谢指标参考值可能会导致孕妇缺铁的漏诊或误诊,故本研究通过连续的纵向研究,观察健康孕妇铁代谢指标的变化,建立健康孕妇各妊娠期及产后的铁代谢指标参考区间,以期为临床科学补铁提供依据。
1 资料与方法
1.1一般资料 选择2013年9月至2014年8月于本院产科就诊的133例妊娠小于12周的健康孕妇为研究对象。妊娠时间从末次月经的第1天开始计算,如孕妇不确定末次月经的日期,则使用超声检查进行评估。研究对象年龄(30.4±4.2)岁,体质量指数(BMI)为(20.4±2.3)kg/m2,孕龄(271.0±7.2)d,分娩时出血量(278.0±166.0)mL;新生儿出生体质量(3 397.9±409.1)g,Apgar评分第1分钟为(9.8±0.5)分,Apgar评分第3分钟为(9.9±0.3)分,Apgar评分第5分钟为(10.0±0.0)分。纳入标准:单胎妊娠、初产妇;同意加入本研究,并签署知情同意书。排除标准:BMI>30 kg/m2或<18 kg/m2;有吸烟史;合并糖尿病、高血压、肝病、肾病、血液或代谢系统疾病等;多胎妊娠;妊娠期贫血(妊娠早期Hb<110 g/L,妊娠中期Hb<105 g/L,妊娠晚期Hb<110 g/L);血压≥140/90 mm Hg;合并先兆子痫或子痫、妊娠期糖尿病、妊娠期肝内胆汁淤积、前置胎盘等;早产或过期产;超敏C反应蛋白(hs-CRP)>5 mg/L;妊娠期或产后12~16周的生殖道异常;产后出血(阴道分娩>500 mL,剖宫产>1 000 mL);胎儿生长障碍,平均Apgar评分低于8分;胎儿出生时体质量<2 500 g或>4 000 g。本研究经本院伦理委员会批准。
1.2方法
1.2.1标本采集 所有研究对象分别于妊娠早期(妊娠12周末以前)、妊娠中期(13~27周末)和妊娠晚期(28~40周末)及产后6~12周采集血液标本。采集方法:研究对象静坐休息30 min,由专业采血技术人员采集空腹静脉血标本,其中生化指标使用含有分离胶的真空管采集,血液学指标使用乙二胺四乙酸二钾(EDTA-K2)抗凝真空管采集。
1.2.2检测方法 所有生化指标均采用Hitachi 7600-010全自动生化分析仪进行检测。SF、可溶性转铁蛋白受体(sTfR)采用免疫透射比浊法检测,转铁蛋白(TRF)采用免疫沉淀测定法检测,血清铁(SI)采用费伦法检测,总铁结合力(TIBC)通过计算得出,转铁蛋白饱和度(TS)为SI占TIBC的百分比。采用SysmexXE-2100全自动血细胞分析仪及其配套试剂盒检测网织红细胞血红蛋白含量(Ret-He)。
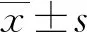
2 结 果
2.1各妊娠期及产后铁代谢指标水平比较 各妊娠期和产后铁代谢指标水平比较,差异均有统计学意义(P<0.05)。Ret-He水平在妊娠中期最高,在产后最低;SF、TS水平随妊娠期进展逐渐降低,在产后升高;sTfR水平随妊娠期进展逐渐升高,在产后达到最高;SI水平随妊娠期进展逐渐降低;TRF、TIBC水平随妊娠期进展逐渐升高,在产后降低。见表1。
2.2各妊娠期及产后铁代谢指标参考区间 Ret-He、SF、sTfR、SI、TRF、TIBC及TS在各妊娠期及产后的参考区间范围均不同。Ret-He在妊娠晚期的参考区间范围最宽,为26.2~41.0 pg;TS在妊娠晚期的参考区间范围最宽,为5%~65%。见表2。

表1 各妊娠期及产后铁代谢指标水平比较

表2 各妊娠期及产后铁代谢指标参考区间
3 讨 论
成年女性缺铁的原因主要为月经期和妊娠期铁丢失,妊娠期缺铁在孕妇中极为常见,铁需求随着妊娠期进展而增加,妊娠中期和妊娠晚期孕妇缺铁的风险最高。约1/3的孕妇妊娠中期和妊娠晚期存在轻度至中度缺铁,到达妊娠晚期时铁需求量可达6.6 mg/d[5-6]。孕妇铁缺乏对胎儿及孕妇都存在较大影响,有研究发现,随着胎龄增加,孕妇铁结合能力下降,Hb急剧降低,孕妇病死率有增高趋势[5]。也有研究表明,缺铁小鼠的后代甲状腺素和三碘甲状腺原氨酸水平分别减少了67%和43%,且脑组织铁减少了25%,提示孕妇缺铁不仅会导致孕妇和胎儿贫血,还会导致新生儿低甲状腺素血症,且新生儿铁耗尽会损害大脑早期发育[7-8]。妊娠早期补铁15~30 mg/d可改善新生儿铁状态,也可预防或逆转大脑发育异常[9]。定期食用鱼类和豆类,摄入一定量的牛奶,能在妊娠期间优化铁状态[6]。诊断缺铁的“金标准”是骨髓含铁血黄素染色,但该检查具有侵入性,且不能用于妊娠期筛查,故临床目前主要采用铁代谢指标检测来监测孕妇铁状态。
由于妊娠期的各种生理变化,孕妇铁代谢指标水平也会随妊娠期进展发生改变。在所有监测铁和铁储存状态的指标中,SF为最实用的指标,在非妊娠健康人群中,其水平<15 ng/mL提示体内铁储存耗尽[6]。本研究结果显示,SF水平随妊娠期进展逐渐降低,在产后升高,与SHINART等[10]研究结果一致,这可能是妊娠期间血浆生理性扩张,红细胞生成增加及胎儿胎盘对铁的需求增加所致。但有研究发现,SF是一种急性期反应蛋白,在炎性反应和很多传染性疾病时均有不同程度的升高。炎性反应发生时,骨髓铁储存耗尽,而血清SF水平仍然很高,SF的水平不能完全评估铁缺乏[11],故本研究排除了hs-CRP>5 mg/L的孕妇,以排除急性炎性反应对SF水平的干扰。sTfR是红细胞的表达前体,反映红细胞的生成活性和细胞铁状态,是缺铁性红细胞生成的标志物[12],且sTfR水平升高可能与妊娠相关的组合红细胞生成有关[13]。sTfR作为铁代谢指标的主要优点是受感染和炎性反应的影响小。有研究评估了sTfR作为铁代谢生物标志物的有效性,并与“金标准”骨髓含铁血黄素染色进行比较,结果显示,sTfR是机体炎性反应时能较好反映铁代谢状态的生物标志物之一[14]。本研究中,sTfR水平随妊娠期进展逐渐升高,在产后达到最高。绝对缺铁时,TS、SI、SF水平均降低,但TS和SI特异度较低且存在昼夜变化,故较少用于临床诊断。随着妊娠期进展,胎儿生长的铁需求与胎儿体质量成比例的稳定上升,大多数铁累积发生在妊娠晚期,故TIBC和TRF水平在妊娠晚期达到最高。Ret-He水平取决于网织红细胞中Hb的含量,是诊断缺铁性贫血的“金标准”,反映了骨髓红细胞生成活性,可用作铁状态评估的标志物[14]。孕妇和胎儿之间的血液循环通过胎盘进行氧气交换,妊娠中期胎儿的氧气消耗量最高,Hb水平达到峰值,故妊娠中期Ret-He水平最高。
因为妊娠期间红细胞生成增加是正常的生理现象,故妊娠期间的铁代谢指标参考区间不同于非妊娠健康人群。本研究对妊娠早、中、晚期及产后孕妇铁代谢指标进行了参考区间制订,结果显示,Ret-He、SF、sTfR、SI、TRF、TIBC及TS在各妊娠期及产后的参考区间范围均不同。Ret-He在妊娠晚期的参考区间范围最宽,为26.2~41.0 pg;TS在妊娠晚期的参考区间范围最宽,为5%~65%。本研究各妊娠期铁代谢指标的参考区间与其他相关研究结果大致相同[15]。
本研究的局限性在于无法确定补铁量对参考区间结果的影响,因为约95%的孕妇表示曾使用过一些补铁或含铁的多种维生素产品,但在问卷调查中其均无法描述补铁的剂量和持续时间,且评估孕妇的膳食铁摄入量也很困难,这导致本研究结果可能存在一定的偏倚,故后续研究将在排除这一干扰后进行。
4 结 论
综上所述,健康孕妇各妊娠期和产后铁代谢指标水平及参考区间存在差异。建议临床通过铁代谢指标检测来评估孕妇的铁状态,合理指导补铁治疗。此外,还可通过建立各地区健康孕妇各妊娠期的铁代谢指标参考区间,以提高临床诊断的准确性。

