不同闭合方式在降低胰体尾切除术后并发症的效果观察
傅南涛,李勇,陈海宾,李轲,涂江波
(南昌大学第一附属医院肝胆胰外科,江西 南昌 330006)
胰体尾切除术(distal pancreatectomy, DP)是治疗胰体尾部良恶性肿瘤、外伤、慢性胰腺炎等疾病的标准手术方式,胰瘘是其最重要的并发症[1];不仅增加手术时间和住院费用,而且有诱发腹腔出血、腹腔感染、腹腔积液等危险。近年来,切割闭合器(Endo-GIA stapler)广泛运用于DP,有完全取代手工缝合的趋势。本研究回顾分析了2014年1月至2018年8月我科收治的88例病人临床资料,旨在讨论切割闭合器在降低DP术后并发症尤其是胰瘘方面的优势。
资料与方法
一、一般资料及分组
本研究回顾分析了88例胰体尾部病变病人的临床资料,所有病人均行开腹胰体尾切除或腹腔镜胰体尾切除,其中男性26例,女性62例;年龄为(50.8±14.1)岁,年龄范围为15~85岁。选取的病人均完整切除病灶,并经过术后病理明确诊断。疾病构成如下:胰腺导管腺癌17例,实性假乳头状瘤12例,胰腺囊腺瘤28例,胰腺囊肿8例,假性囊肿7例,神经内分泌肿瘤10例,慢性胰腺炎3例,黏液性囊腺癌2例,胰腺腺泡细胞癌1例。根据手术方式及胰腺残端处理情况,分为手工缝合组、开腹闭合器组及腹腔镜闭合器组,其中手工缝合组24例,开腹闭合器组40例,腹腔镜闭合器组24例。所选取病人收入标准包括:病灶位于胰腺远端、无其他脏器侵犯、未联合其他脏器手术、病例资料完整等。以上所有收集资料均得到医院伦理委员会许可,病人或病人家属知情并同意。
二、手术方式
根据病人情况选择腹腔镜或开腹手术;开腹手术方式如下:向上游离胰腺后侧,显露脾动静脉,于胰体尾下缘相对无血管区切开后腹膜,由下向上钝性游离胰体尾部后侧并与上缘切口会师,建立胰体后方通道,在肠系膜上静脉、门静脉前方悬吊胰颈,胰腺残端处理:闭合器组采用直线切割闭合器离断胰颈残端,缝扎或电灼止血,再以4-0 Prolene线连续缝合加固;手工缝合组则胰腺颈部予电刀切割胰腺,断面电凝止血,再使用Prolene线缝合关闭。根据胰腺肿瘤病理性质、肿瘤与脾脏位置等特点决定是否保留脾脏。常规于胰腺断端附近置一双套管自左侧腹壁引出,逐层关腹。
腹腔镜手术方式如下:脐下缘穿刺建立气腹,脐下缘置入10 mm Trocar作为进气和观察孔,右锁骨中线、右腋前线肋缘下5 cm分别置入5 mm、12 mm Trocar作为主操作孔,左锁骨中线、左腋前线肋缘下5 cm分别置入5 mm、12 mm Trocar作为副操作孔。游离胰颈部下缘,显露脾静脉和肠系膜上静脉,从胰体部上缘向下钝性游离胰体部后侧并与下缘切口会师,建立胰体后方隧道,穿过细导尿管提起胰颈部,肠系膜上静脉前方用Endo-GIA切断闭合胰颈部,电凝止血,4-0 Prolene线连续缝合胰腺近侧断端,脾脏是否保留同样与肿瘤性质及部位有关。常规于胰腺断端附近置一双套管自左侧腹壁戳孔引出并固定,缝合戳孔。
三、术后治疗
根据病人身体状况给予相应的肠内营养或肠外营养,常规抗感染、补液,术后无感染征象时,可考虑停用抗生素。检测病人术后血常规、血白蛋白和血糖的变化。术后如有持续性发热,复查CT,并可行血培养或引流液细菌培养;术后如血红蛋白持续性下降,引流管有鲜红色血液引出,考虑有腹腔出血,补液及止血药物处理,当血红蛋白低于70 g/L,输血治疗;如术后凹陷性水肿,血白蛋白偏低,静脉滴注补充人血白蛋白,血糖过高时给予药物控制血糖。注意观察引流液的性状及引流量,预防性使用生长抑素,予4 ml奥曲肽配50 ml生理盐水微量泵泵入。术后3 d测定腹腔引流液的淀粉酶情况判断有无胰瘘。
胃肠道恢复通气后可考虑拔除胃肠减压管。在引流管通畅情况下,如腹水淀粉酶正常,引流量少于20 ml时可考虑拔除引流管。病人未诉明显特殊不适,生命体征平稳,引流管拔除后安排出院;少数生化漏或B级瘘病人因病情平稳,带管出院,带管时间根据引流量及引流液性质决定,连续3 d无明显液体引出且无明显腹部症状时嘱病人入院拔管,引流管多在出院后1周内拔除,本次研究引流管拔除时间纳入了病人带管出院后留置引流管的时间。
四、研究方法
比较三组病人术前一般状况、术中相关情况及术后并发症发生等情况,观察指标包括:病人年龄、性别、体质量指数、手术时间、出血量、术前白蛋白及血糖、术后第1天白蛋白及血糖、拔管时间、并发症发生情况等。其中并发症的定义如下:
1.胰瘘 采用的是国际胰腺外科研究组(ISGPS)发布的2016版术后胰瘘的定义和分级标准,即术后>3 d时,引流液淀粉酶含量大于血清淀粉酶正常值上限的3倍,且与临床治疗预后相关[2]。
2.腹腔出血 根据中华医学会外科学分会胰腺外科学组对腹腔出血的定义标准,腹腔内出血指来自于腹腔内动静脉断端、手术创面、假性动脉瘤等部位的出血。轻度出血血红蛋白水平降幅<30 g/L,临床症状较轻,通过输血、补液、抗凝药物治疗多能控制;重度出血的病人失血量较大,血红蛋白水平降幅≥30 g/L,甚至有心率加快、低血压、少尿等低血容量性休克的表现,补液、输血的同时,需要介入或者手术止血[3]。
3.腹腔积液 手术后引流管拔除较早时,胰尾部渗出形成假性囊肿,胰液漏出被网膜包裹成包裹性积液;腹部B超可探查到圆形或椭圆形液性暗区。
4.腹腔感染 ①手术3 d以后病人体温仍超过37.5 ℃;②血白细胞计数及中性粒细胞分类超过正常水平;③腹腔引流液行细菌培养结果阳性;④排除肺部、泌尿道其他部位感染,满足以上条件可诊断为腹腔感染。
五、统计学方法
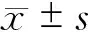
结 果
三组数据在年龄、性别、体质量指数、术前血红蛋白、白蛋白及血糖等方面差异均无统计学意义(表1)。脾脏是否保留也与手术方式无明显相关性。在手术时间上,与手工缝合组比较,腹腔镜切割器组手术时间更短(P<0.05)。对比三组术后住院时间,腹腔镜闭合器组住院时间有更短趋势,但统计学比较P>0.05;手工缝合组与开腹闭合器组住院时间大体相同,差异无统计学意义(表2)。腹腔镜闭合器组术后胃管拔除时间较短,与开腹闭合器闭合组对比差异有统计学意义(P<0.05)。
由于病理类型多样,本文仅分类为良性病变及恶性肿瘤,统计结果显示三组数据在病理良恶性方面无明显差异,恶性肿瘤占三组百分比分别为:16.7%、25.0%、25.0%。而三组间总并发症率,如胰瘘、腹腔出血、腹腔积液、腹腔感染等均无明显差异。88例病人出现并发症者有30例(34.1%),发生胰瘘19例(21.6%),其中6例为手工缝合组,8例为开腹闭合器组,5例为腹腔镜闭合器组。其中C级胰瘘有2例(2.3%),手工缝合组和闭合器组各有1例,手工缝合组C级瘘病人因腹腔大出血抢救无效而死亡,可能与漏出胰液腐蚀腹腔内血管有关;另1例C级瘘病人出院后再次入院,并出现心肺肾功能衰竭(病人既往无相关疾病且入院相关检查提示心肺肾无明显异常),积极治疗后身体状况无明显改善,病人家属放弃治疗,要求自动出院。余病人出现并发症行对症治疗,均治愈后出院。将血糖均值对比发现,术后第1天病人血糖均值(>7.0 mmol/L)明显高于术前病人血糖均值(<6.0 mmol/L)。三组病人总体住院费比较,手工缝合组最低,但差异无统计学意义。
讨 论
DP术后并发症包括胰瘘、腹腔出血、腹腔感染、腹腔积液等,其中胰瘘是其最主要的并发症,胰液含有大量消化酶,腐蚀腹腔血管可导致腹腔出血;漏出的胰液可被周围网膜组织包裹形成包裹性积液,同时胰瘘也可以使组织坏死诱发腹腔感染,甚至发展至败血症;本次研究88例病人中术后并发症发生率为34.1%,其中胰瘘发生率21.6%。DP术后并发症及胰瘘发生率均较高。其中出现C级胰瘘2例,手工缝合组、开腹闭合器组、腹腔镜闭合器组发生B级胰瘘概率分别为20.8%(5/24)、20%(8/40)、16%(4/24)。近年来本院腔镜技术较成熟,学习曲线对胰瘘发生影响较小,但考虑到术者不同,本文不能排除手术者因素对三组结果的干扰。
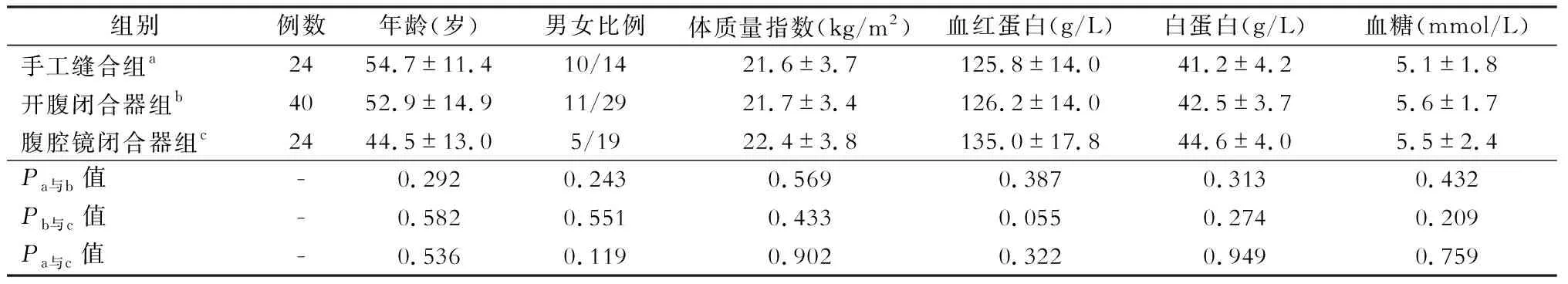
表1 三组病人术前一般资料比较
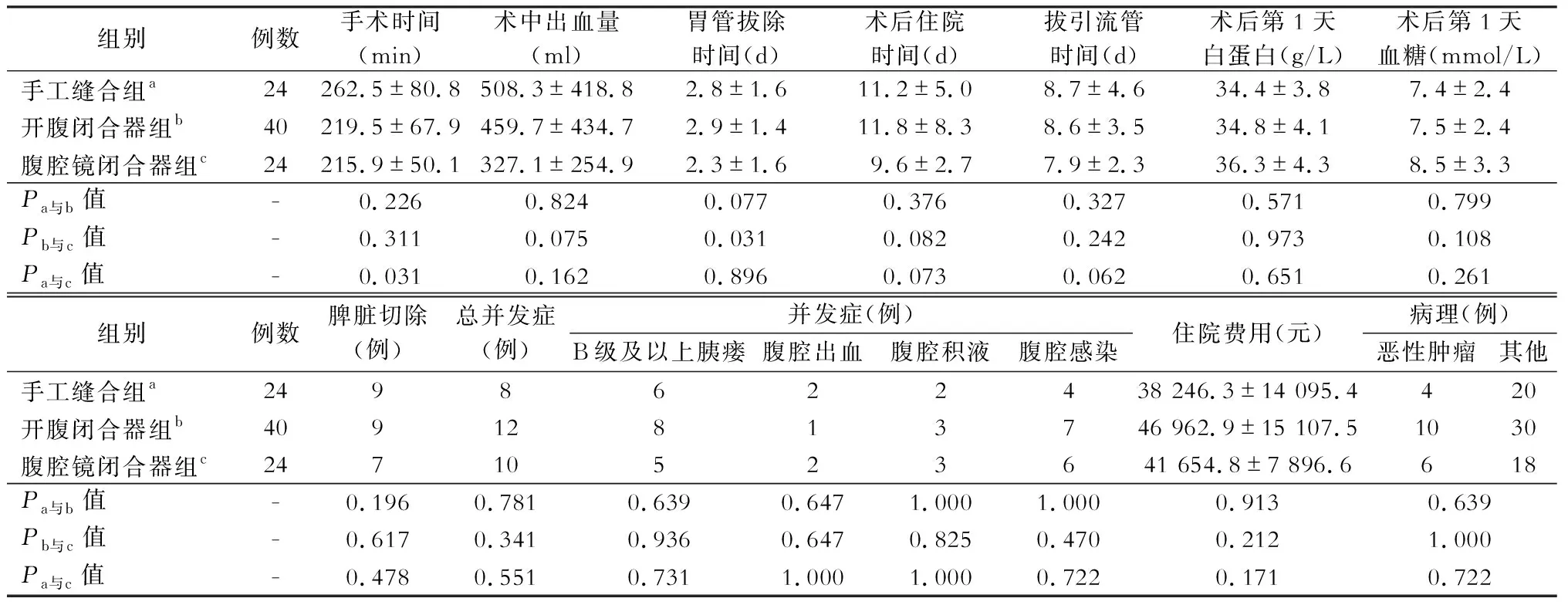
表2 三组病人术中及术后相关指标比较
降低DP术后胰瘘发生率是目前胰腺外科研究的重要方向。而胰腺残端处理方式被认为与胰瘘紧密相关[4-7],手工缝合和直线切割闭合器闭合是离断胰腺常用方式。自从1979年Pachter等[8]首次报道使用切割闭合器处理胰腺残端以来,切割闭合器在各治疗中心得到广泛运用。与手工缝合相比,它可减少手术步骤,缩短手术时间,目前有替代手工缝合的趋势。但针对切割闭合器能否降低术后并发症发生率尤其是预防胰瘘这一话题,目前还是有很大争议。我国学者赵玉沛等[9]回顾性分析109例DP术后的临床资料,切割闭合器组与手工缝合组病人的术后胰瘘发生率分别为21.4%和41.5%;切割闭合器在降低胰瘘发生率方面优于手工缝合,他认为可能的原因是胰腺残端胰管不扩张,很难结扎及缝合,切割闭合器能更好地封闭胰管。然而Shimada等[10]却持有相反的观点,他将144例病人随机分为闭合器组和手工缝合组,分别统计B级或C级胰瘘的发生率,切割闭合器闭合组B级或C级胰瘘发生率为50%,非吻合器组为41%,两种封闭技术在预防胰瘘方面无明显差距,手工缝合应该被视作标准手术闭合方式。本次研究分别将手工缝合、开腹切割器闭合、腹腔镜切割器闭合三组临床数据对比,发现手工缝合组与另外两组在手术并发症及胰瘘发生率方面并无明显差异。此外本研究提示手工缝合组手术时间更长,可能与手术过程中电刀切割及缝合所消耗时间有关,此外手术时间长短也与施术者手术熟练度有关,本次收集的病例并非出自同一主刀,故不能忽略术者因素对手术影响。三组病人在拔胃管或引流管时间、术后住院时间等术后恢复情况上差异均无统计学意义,但腹腔镜闭合器组病人术后恢复时间较另外两组相对稍短,这与腹腔镜手术对组织损伤小有关。三组病人总体住院费用也有所不同,其中开腹闭合器组与腹腔镜闭合器组差异并不明显,胰瘘与增加住院费用密切相关,术后住院时间也是增加住院费用的重要因素,此外术前诊疗的费用对总费用也有影响。
切割闭合器吻合钉密集,切缘整齐,可完全钉合薄胰腺残端;而处理较厚胰腺时,闭合器容易压碎胰腺组织,撕裂胰腺实质,不能完全钉合厚胰腺组织,导致残端不全闭合,胰液反而容易从未关闭的小胰管漏出[11-14]。高红桥等[7]分析了186例DP病人胰腺残端处理方式,其研究发现PD术中选择性缝扎主胰管或 Prolene线连续缝合残端能降低胰瘘发生率,而闭合器钉合胰腺残端要根据胰腺大小和质地选择性使用,闭合器处理厚胰腺易导致胰腺组织破碎,增加胰瘘风险。为了减少切割闭合器对胰腺实质的撕裂,Hirashita等[14]提出了“10 min法”的延迟压榨技术,即使用肠钳压缩胰腺远端5 min,然后用3 min左右时间缓慢关闭闭合器,等待2 min后击发,此方法能够使压迫组织液均匀分布,一定程度避免胰腺撕裂,减少胰瘘的发生。此外,还有学者认为纤维蛋白胶封闭胰腺残端可降低胰瘘,可能是因为纤维蛋白胶可促进成纤维细胞增殖和胶原蛋白合成,可以起到黏合封闭残端的作用[4-5,15]。
除手工缝合及闭合器闭合胰腺残端外,胰空肠吻合及胰胃吻合也是残端的处理方式。在胰腺残端完全闭合时,假如Oddi括约肌收缩,将引起胰液向十二指肠流出的阻力增加,胰管压力增高,胰小管和胰腺腺泡破坏,胰液外溢。当主胰管持续引流从手术残端进入胃或空肠,胰管内压力下降,胰液不再外溢,临床胰瘘的发生率降低[16]。然而胰腺远端与胃或空肠吻合,增加了吻合口,吻合口周围的胃液或者肠液能够激活胰酶,反而增加胰瘘风险。Uemura[16]和Kawai等[17]均分析过胰腺远端与空肠或胃吻合这两类方式的相关临床数据,结果提示DP术中这两类吻合方式在预防胰瘘方面较手工缝合无明显优势,不能降低胰瘘。保持胰管通畅,舒张Oddi括约肌可以降低胰腺导管压力,有学者提出DP术前经内镜逆行胰胆管造影(ERCP)下置入胰管内支架或注射肉毒杆菌毒素于Oddi括约肌,来降低胰瘘的发生[18-20];然而这些方式的有效性需要进一步的研究数据证明。此外,据报道腹腔镜胰体尾切除术与开腹胰体尾切除术相比,可以减少术中出血、缩短术后住院时间[21-22],本次研究显示腹腔镜胰体尾切除术在手术时间、术中出血量及术后住院时间与开腹组差异无统计学意义,而降低并发症及胰瘘发生率方面也无明显优势。
综上,运用切割闭合器和行腹腔镜手术并不能降低胰体尾切除术后胰瘘发生率;直线切割闭合器不能完全替代手工缝合,手工缝合仍是胰体尾切除术中离断胰腺的重要手段。

