吲哚菁绿荧光显像技术打开“肝脏四扇门”在腹腔镜精准肝切除中的应用
谢国伟,吴泓
(四川大学华西医院肝脏外科,四川 成都 610041)
肝癌是消化系统常见的恶性肿瘤之一,据国际癌症研究中心发布报告[1]显示,2018年全世界肝癌新发病例数约84.1万,占所有恶性肿瘤新发病例的4.7%,排名第6位;全球肝癌死亡人数约78.2万,占当年所有恶性肿瘤死亡病例的8.2%,居第4位,严重威胁人类的生命健康安全[2]。手术治疗是目前公认的肝癌首选治疗方式,包括传统开腹肝切除术和腹腔镜肝切除术,然而肝癌初次手术切除后5年复发率高(可在70%以上)[3]。自1991年美国Reich等[4]报道首次完成腹腔镜肝切除术以来,腹腔镜肝切除术在世界范围内逐渐开展。2009年日本Ishizawa等[5]首次使用ICG荧光显像技术指导肝切除术后,ICG荧光腹腔镜技术快速发展[6-9],肝癌手术治疗逐渐进入“微创化”与“精准化”的时代。本研究回顾四川大学华西医院肝脏外科2017年4月至2019年10月期间收治的103例行腹腔镜肝切除术病人的临床资料,探索腹腔镜肝切除术中应用ICG荧光显像技术(indocyanine green fluorescence imaging,FI-ICG)打开“肝脏四扇门”的手术方式治疗肝细胞癌的疗效。
资料与方法
一、一般资料
共103例符合纳入标准的病人接受全腹腔镜手术,包括研究组(联合ICG荧光显像技术打开“肝脏四扇门”的腹腔镜肝切除病人)38例,对照组(常规腹腔镜肝切除病人)65例。所有病人均为初次手术,术前未行其他外科治疗。所有病人术前肝功能均为Child-Pugh A级,吲哚菁绿15 min滞留率(ICG-R15)小于20%,术后病理诊断证实均为肝细胞癌。两组病人的术前基线资料见表1,两组比较差异均无统计学意义。所有病人手术前均签署手术知情同意书,符合医学伦理学规定。

表1 两组病人术前一般资料比较
注:“+”表示阳性,“-”表示阴性;HBsAg.乙型肝炎表面抗原;HBV DNA.高精度乙型肝炎DNA复制量;AFP.甲胎蛋白;PIVKA-Ⅱ.异常凝血酶原Ⅱ;ICG-R15.吲哚菁绿15 min滞留率;Hb.血红蛋白;PLT.血小板计数;TBIL.总胆红素;ALB.血浆白蛋白;ALT.丙氨酸转氨酶;AST.天冬氨酸转氨酶;PT.凝血酶原时间;AFP与PIVKA-Ⅱ采用Wilcoxon秩和检验,性别与肿瘤数目采用校正的χ2检验
二、纳入标准与排除标准
根据国内外文献报道的腹腔镜肝切除术以及ICG荧光显像技术的适应证与禁忌证[10-11],结合本团队临床经验,总结联合ICG荧光显像技术打开“肝脏四扇门”的腹腔镜肝切除术的纳入标准为:①病人一般情况良好,无严重的心、肺、脑、肾等重要脏器功能障碍;②肝功能Child-Pugh A 级,或B级经短期护肝治疗后能恢复至A级;③肝脏储备功能较好,术前ICG-R15≤20%;④单发肿瘤直径≤10 cm,或多发肿瘤局限于一段、一叶或半肝内;⑤无重要血管侵犯及静脉癌栓;⑥肿瘤无远处转移。
排除标准:①一般情况较差,无法耐受手术或无法耐受长时间气腹状态者;②ICG或碘过敏者;③肝硬化较重,术前肝功能Child-Pugh B级或C级者;④肝脏储备功能中、重度受损,术前ICG-R15>20%者;⑤肿瘤较大,估计腹腔镜无法完整切除者;⑥肿瘤紧邻或直接侵犯大血管者;⑦肿瘤紧邻第一、第二或第三肝门,影响暴露和分离者;⑧术前影像学提示肿瘤存在肝内多发转移、淋巴结转移或远处转移;⑨术前影像学评估腹腔内重度粘连者;⑩术后病理证实非肝细胞癌者[12]。
三、手术方法
全身麻醉满意后,病人取仰卧分腿位,头高足低,右侧抬高约30°。气腹针穿刺脐周1 cm处,常规建立气腹,气腹压维持在12~14 mmHg之间,采用“五孔法”进行手术操作[13]。研究组腹腔镜镜头进入腹腔后,开启荧光模式,全面细致地探查肝脏和腹腔,初步了解肝脏整体形态、肿瘤情况、腹腔内有无粘连、腹水及肿瘤播散灶等,位于肝脏浅表的肿瘤(距肝脏表面不超过1 cm)会显影荧光(图1A)。首先根据肿瘤位置,适当游离肝周韧带和粘连,结合术前影像学证据与术中彩超探查肿瘤所在肝段门静脉分支情况,酌情打开“肝脏四扇门”,暴露肿瘤所在肝段Glisson蒂(图1B),可以选择正染法穿刺目标肝段门静脉分支,注射ICG 1~5 ml(0.05 mg/ml)对目标肝段进行荧光染色。也可以选择反染法,结扎、离断目标肝段Glisson蒂后,通过外周静脉注射ICG 5~10 ml(0.05 mg/ml),使目标肝段以外的正常肝组织显影荧光(图1C),通过荧光对比反衬显示目标肝段,再沿荧光染色标记的肝段边界切除肝实质(图1D)。切断肝实质过程中使用ICG荧光实时导航,不断修正切肝平面。若目标肝段门静脉分支较细,或目标肝段Glisson蒂暴露困难,染色失败,则联合ICG荧光显像技术与术中彩超探查肝脏肿瘤边界,距离肿瘤边界1~2 cm处划定肝切缘,切肝过程中随时切换荧光模式探查肿瘤,保证足够切缘。沿途遇到的所有血管、胆管,需根据管道直径选择合理的离断方式:小于3 mm的小血管和小胆管可以用超声刀、百克钳等止血器械直接凝闭,较大的血管可以先用钛夹、Hem-o-lok夹等夹闭后离断;大的静脉和胆管可以使用内镜的直线切割闭合器直接离断,必要时进行缝合。若术中出血无法控制,应及时中转开腹手术止血。
对照组行解剖性肝切除使用美蓝染色标记法,无法行解剖性肝切除术者,则通过术中彩超距肿瘤边界1~2 cm处划定肝切缘,切除肿瘤。
四、观察指标
本研究主要观察指标包括手术方式、手术时间、术中出血量、术后住院时间、术后并发症发生率及类型、术后肝功能等查血指标以及1、2年无瘤生存率(disease-free survival rate,DFS)和1、2年总生存率(overall survival rate,OS)等。
五、统计学方法
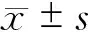
结 果
一、术中和术后资料
本研究中所有病人均由度过学习曲线的同一术者完成腹腔镜手术,术后按加速康复模式实行统一管理,达到出院标准后准予出院。与对照组相比,研究组病人的手术时间更短[(214.55±75.28) min 比(251.74±91.57) min,P<0.05],术中出血量更少[(167.63±159.72) ml比(251.08±213.34) ml,P<0.05],术后住院时间更短[(4.45±1.52) d比(5.92±2.59) d,P<0.05],而其他观察指标差异无统计学意义,包括手术方式、术后并发症发生率等。研究组共有22例病人成功行ICG解剖性肝段染色,并完成标准解剖性肝切除;对照组共37例病人成功行美蓝染色,完成解剖性肝切除。研究组38例病人术后发生并发症者3例,均为肺部感染。对照组65例病人术后发生并发症者10例,其中肺部感染4例,大量胸腔积液1例,大量腹水2例,肝衰竭、肝性脑病1例,消化道出血1例,腹腔感染、切口感染1例。两组病人术中、术后资料及手术方式见表2~表4。

表2 两组病人术中资料比较
注:MVI.微血管侵犯,“0”未发现MVI,“1”表示MVI≤5个,“2”表示MVI>5个;切缘距离、分化程度与MVI采用Wilcoxon秩和检验(T值);卫星灶采用校正的χ2检验

表3 两组病人术后资料比较
注:并发症与术后输血采用校正的χ2检验;Hb.血红蛋白;TBIL.总胆红素; ALT.丙氨酸转氨酶;AST.天冬氨酸转氨酶;ALB.血浆白蛋白

表4 两组病人具体手术方式(例)
二、预后资料
病人术后1个月开始复查,其后每3个月定期随访,监测肝功能、甲胎蛋白、异常凝血酶原等指标,检查腹部彩超,如有异常进一步完善CT、MRI等检查。由于实施手术时间的差异,病人随访时间6~36个月不等,中位随访时间为13个月。研究组与对照组病人术后1年/2年的总生存率差异无统计学意义(97.4%/94.7%比95.4%/89.2%,P>0.05),1年/2年的无瘤生存率差异也无统计学意义(86.8%/76.3%比84.6%/80.0%,P>0.05)。生存分析绘制的总生存时间与无瘤生存时间的生存曲线见图2和图3。
讨 论
自1985年Makuuchi等[14]首次提出“解剖性肝切除”这种创新性的肝癌切除理念后,“解剖性肝切除”概念很快被全世界肝胆外科医生接受。“解剖性肝切除”理念认为肝癌细胞主要通过侵犯癌旁的门静脉分支,形成微血管癌栓,并随着门静脉血流在其支配的肝实质内播散,形成微转移灶,这是肝癌在肝内转移的主要方式,解剖性肝切除术是系统地沿着门静脉将一个肝段及其所属的门静脉分支支配的所有肝实质区域连同肝动脉一并切除,尽可能达到根治性切除肿瘤。但要真正做到解剖性肝切除,存在几个技术要点,包括确定肝段的边界,全程显露肝段间的静脉以及目标肝段Glisson蒂根部离断[15],因此,并不是所有的肝脏肿瘤都能做到标准的解剖性肝切除。2006年我国董家鸿教授在“解剖性肝切除”理念的基础上进一步提出“精准肝切除”的概念,认为“精准肝切除”是21世纪肝癌治疗的新理念[16],追求以最小的侵袭性,达到根治性切除肝脏肿瘤的效果,最大限度保护残肝功能,提高病人长期预后。
如今“微创”与“精准”的理念已经深入肝癌手术治疗的方方面面[17]。为了更精准地解剖肝脏,做到解剖性肝切除,吴泓教授结合肝脏结构特点,总结自身临床经验,从手术入路的角度,提出了打开“肝脏四扇门”的肝脏解剖方法。所谓“肝脏四扇门”指的是肝脏门静脉系统走行的四个区域,通过解剖这四个门静脉走行区域,可以清晰暴露肝脏各段主要的Glisson蒂,以便行各种解剖性肝切除术。“肝脏第一扇门”指肝门部左、右门静脉分叉的“主门脉裂区域”,打开后可以识别左、右门静脉分支主干,方便行左、右半肝的切除;“肝脏第二扇门”指肝圆韧带处“脐裂静脉”走行的“脐裂区域”,被认为是左肝的“门”,打开后可以清晰暴露左肝Ⅱ、Ⅲ段与Ⅳ段的Glisson蒂,对于左肝各段的解剖性切除有指导性作用;相对的,“肝脏第三扇门”是胆囊窝处“前裂静脉”走行的“前裂区域”,主要位于肝实质内,被认为是右肝的“门”,打开后可以显露右肝Ⅴ、Ⅷ段与Ⅵ、Ⅶ段的Glisson蒂,对于行右肝各段的解剖性切除是必要的;“肝脏第四扇门”则是指门静脉主干或主要分支发出的连接尾状叶的“门短静脉”走行区域,存在较大个体差异,是通往尾状叶的“门”,打开后可以行尾状叶的解剖性切除。打开“肝脏四扇门”是肝脏各段解剖性切除的基础,在ICG荧光显像技术引导的腹腔镜肝切除术中,打开“肝脏四扇门”后,不仅可以直接穿刺目标门静脉分支行正染法ICG荧光造影,使目标肝段染色,也可以结扎目标肝段Glisson蒂后,再行反染法ICG荧光染色,在一定程度上降低了术中彩超引导下穿刺目标门静脉的难度,是ICG荧光显像技术引导的腹腔镜肝切除术的关键技术之一。
本文研究组行腹腔镜解剖性肝切除术的病人均成功进行ICG肝段荧光染色,而行非解剖性肝切除术的病人则采用肿瘤荧光显影定位肿瘤,同时联合术中彩超确定肝切除线,切肝过程中使用荧光探查,保证足够切缘。对照组行腹腔镜解剖性肝切除术的病人采用美蓝染色标记法,非解剖性肝切除术病人则通过术中彩超确定肝切除线后,切除病灶。ICG荧光显像技术对肝段标记的效果,较传统的肝段标记法具有明显优势。有研究表明[8],ICG荧光染色标记肝段成功率可高达95.8%,远远高于传统缺血线标记法的41.7%;而且ICG荧光染色效果稳定持久,可以获得8 h以上稳定的肝实质染色,远远高于美蓝染色标记时间,且不容易洗脱。
本研究中,以腹腔镜左半肝解剖性切除为例,首先使用超声刀游离肝圆韧带,接着尽可能松解镰状韧带、左三角韧带、左冠状韧带和肝胃韧带,使左半肝游离,再沿左肝蒂Glisson鞘和肝方叶之间的间隙进行解剖,打开“肝脏第一扇门”,必要时降低肝门板,充分暴露肝门部左、右肝管汇合区域,一般可显露2 cm左右的肝外胆管,识别左、右肝蒂后,解剖左肝蒂,游离门静脉左支、左肝动脉和左肝管(图1B),结扎门静脉左支、左肝动脉和左肝管后,从外周静脉注射ICG 5~10 ml(0.05 mg/ml),通过反染法显示左半肝(图1C),联合术中超声探查中肝静脉,结合左半肝ICG荧光染色标记、缺血线和中肝静脉走行共同确定肝切除线(图1D),切开肝实质过程中使用ICG荧光实时导航,严格按照ICG荧光染色范围切除肝实质,左肝静脉使用直线切割闭合器直接离断。
本研究中,与对照组相比,研究组病人的手术时间更短[(214.55±75.28) min比(251.74±91.57) min,P<0.05],术中出血量更少[(167.63±159.72) ml比(251.08±213.34) ml,P<0.05],术后住院时间更短[(4.45±1.52) d比(5.92±2.59) d,P<0.05],说明联合ICG荧光显像技术打开“肝脏四扇门”的腹腔镜精准肝切除术能够精准地定位肿瘤、解剖目标肝段Glisson蒂、划定切缘、实时导航离断肝实质,减少了术中彩超探查次数,在彻底切除肿瘤的同时,最大限度地保留了残肝体积和功能,避免了不必要的血管损伤,有利于术后病人肝功能恢复,进而缩短了术后住院时间[18]。
联合ICG荧光显像技术打开“肝脏四扇门”的腹腔镜精准肝切除术在术中探查肿瘤、暴露目标肝段Glisson蒂、肝段荧光染色、实时导航切肝过程等方面优于常规腹腔镜肝切除术,手术时间更短,术中出血量更少,手术创伤相对更小,术后住院时间更短,具有更好的围手术期收益,其安全性和有效性值得肯定。然而本研究病例数较少,随访时间较短,未来研究还需要在更多病例数和更长随访时间的基础上进一步论证该技术对病人远期生存的影响。尽管该技术仍处于探索阶段,但其表现出来的“微创”与“精准”的优势必将进一步推动“肝癌精准治疗”的发展。

