IDO1抑制剂对葡聚糖硫酸钠诱导小鼠溃疡性结肠炎的作用及其对MyD88信号通路的影响
田敏秀, 彭 帅, 沈 磊
武汉大学人民医院消化内科 消化系统疾病湖北省重点实验室,湖北 武汉 430060
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),其特征在于慢性复发性肠道炎症[1]。IBD的发病机制至今尚未完全明确,可能与多种因素有关,目前认为该病的发病与遗传易感性、胃肠道益生菌和致病菌失衡、肠上皮黏膜完整性受损及机体免疫功能失调等综合因素的相互作用有关,其中机体免疫调节异常可能是IBD最基本的发病机制[2]。色氨酸代谢主要通过5-HT途径和犬尿氨酸途径[3]。吲哚胺2,3-双加氧酶1(IDO1)是一种细胞内含血红素的酶,是催化色氨酸沿犬尿氨酸途径分解代谢的初始和限速步骤的酶[4]。IDO1作为免疫功能调节剂的概念来自于观察到IDO1对色氨酸的消耗可以抑制细胞毒性T细胞活化[5]。本课题拟探讨IDO1抑制剂(Epacadostat)对葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎的作用及对结肠组织中MyD88信号通路的影响。
1 材料与方法
1.1 实验材料实验动物:SPF级C57BL/6雄性小鼠30只,6~8周龄,体质量约20 g,购自北京华阜康生物科技有限公司。正式实验开始前7 d购入小鼠,置于SPF环境中适应1周,实验室温度为(21±2)℃,湿度为(50±5)%,12 h/d交替光照与黑暗。实验药品:DSS购自美国MP Biomedicals公司(CAS:9011-18-1),Epacadostat(纯度100%)购自上海TargetMol公司(CAS:1204669-58-8)。PCR反转录试剂盒购自美国Sigma公司,兔多抗GAPDH购自杭州贤至生物有限公司,兔多抗NF-κB p65与兔多抗FOXP3(55 kD)购自武汉三鹰生物技术有限公司,兔多抗RORγt购自北京Bioss公司。
1.2 实验分组30只小鼠采用随机数字表法分为空白组、模型组、Epacadostat低、中、高干预组(5 mg/kg、10 mg/kg、15 mg/kg),每组6只,SPF环境下饲养。药物干预:空白组不予以任何处理,模型组连续4 d于固定时间给予0.3 ml二甲基亚砜(DMSO)溶液(质量浓度为50 g/L的DMSO生理盐水溶液)灌胃,药物干预组连续4 d于固定时间给予含Epacadostat(5 mg/kg、10 mg/kg、15 mg/kg)的0.3 ml DMSO溶液灌胃;造模:从第五天开始,模型组及药物干预组小鼠每天自由饮用质量浓度为30 g/L的DSS溶液,空白组小鼠每天予正常饮水。于实验第12天采用颈椎脱臼法处死小鼠,迅速解剖,取小鼠全部结直肠及回盲部,测量结肠长度;取病变明显处结肠组织标本(约5 mm×10 mm),质量浓度为40 g/L的多聚甲醛固定,石蜡包埋,切片后进行HE染色,剩余结肠组织冻存于-80 ℃冰箱备用。
1.3 数据统计
1.3.1 疾病活动度评分:每天记录每组小鼠体质量、大便性状及便血情况,计算疾病活动指数(disease activity index,DAI)评分[6]。
1.3.2 组织病理学评分:通过HE染色切片观察结肠黏膜形态。参照Murthy等[6]的组织学评分标准。
1.3.3 结肠炎性因子RT-PCR检测:检测小鼠结肠组织中炎性因子IL-1β、IL-6、IL-17、MyD88、NF-κB mRNA变化。应用Trizol试剂提取结肠样本中的总RNA量,按Takara的逆转录试剂盒说明书进行反转录,采用SYBR Green PCR扩增试剂,在ABI QuantStudio 6荧光定量 PCR仪进行PCR扩增和检测,以GAPDH为内参,引物序列见表1。

表1 RT-PCR引物序列Tab 1 RT-PCR primers
1.3.4 Western blotting分析:取出结肠组织,按照说明书步骤提取细胞蛋白并测定蛋白含量。样本加入上样缓冲液,沸水浴10 min后,将备好的蛋白样品和Maker加入上样孔,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAG)分离,并将蛋白转移至聚偏乙烯(PVDF)膜。含质量浓度为50 g/L脱脂奶粉的Tris-HCl缓冲液(TBST)浸泡PVDF膜,室温摇床封闭2 h。用封闭液稀释相应的一抗,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜。TBST充分洗涤PVDF膜5次,5 min/次。用TBST稀释相应的HRP标记二抗—1∶50 000稀释,使PVDF膜浸泡于二抗孵育液中,37 ℃摇床孵育2 h。TBST充分洗涤PVDF膜5次,5 min/次。以显色液显色后晾干胶片并扫描,用IPP分析胶片灰度值。
1.4 统计学方法采用SPSS 25.0软件进行统计学分析。采用GraphPad Prism 8软件绘制统计图。多组间单因素分析采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 DAI评分实验过程中,正常组小鼠体质量均无下降,大便性状未见明显改变,无潜血阳性;模型组小鼠体质量出现明显下降,并于实验第6天开始出现大便隐血阳性,且持续性加重;药物干预组小鼠体质量、血便情况较模型组轻(P<0.05)。实验过程中无小鼠死亡(见图1A)。
2.2 结肠长度改变空白组小鼠结肠颜色正常,未见明显充血肿胀,与空白组比较,模型组小鼠结肠长度明显缩短(P<0.05),且有明显充血肿胀;与模型组比较,药物干预组结肠情况有所改善,中、高剂量组明显变长(P<0.05)(见图1B),低剂量组与模型组相比,差异无统计学意义(P>0.05)。
2.3 小鼠结肠组织病理学评分与空白组相比,模型组小鼠结肠不完整区域较大,腺体黏膜缺失严重,排列紊乱,部分严重小鼠结肠腺体完全缺失,黏膜及黏膜下层出现大量炎症细胞浸润,低、中、高剂量药物干预组小鼠结肠黏膜及肠绒毛结构较模型组破坏轻,结肠黏膜结构大致完整。病理组织学评分显示:与空白组比较,模型组评分显著升高(P<0.01);与模型组比较,Epacadostat中、高剂量干预组评分均显著降低(P<0.05)(见图2)。
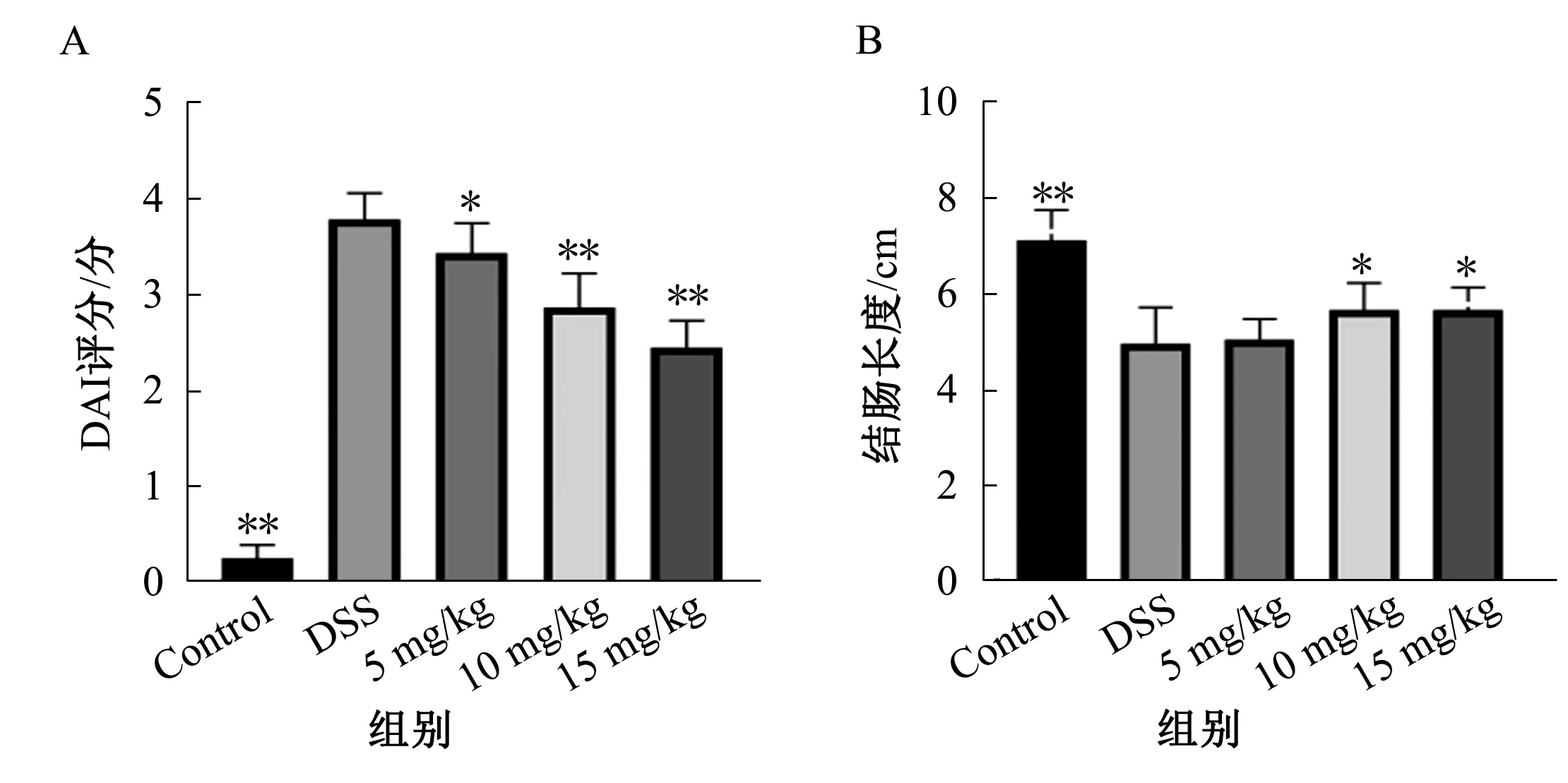
注:与DSS组比较,*P<0.05,**P<0.01。图1 各组DAI评分及结肠长度 A:DAI评分;B:结肠长度Fig 1 The DAI score and colon length in each group A: the DAI score; B: the colon length
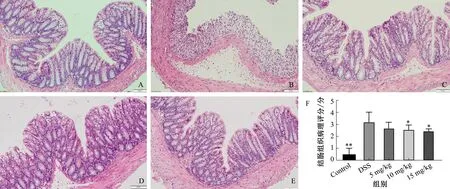
注:与DSS组比较,*P<0.05,**P<0.01。
图2 结肠组织病理切片(HE染色,放大200倍,比例尺=50 μm) A:空白组; B:模型组; C:低剂量干预组(5 mg/kg); D:中剂量干预组(10 mg/kg); E:高剂量干预组(15 mg/kg); F:结肠组织病理评分统计图
Fig 2 The pathological changes of colon in different groups A: control group; B: model group; C: low dose group (5 mg/kg);D: middle dose group (10 mg/kg); E: high dose group (15 mg/kg); F: the score chart of colon histopathology
2.4 小鼠结肠炎性因子IL-1β、IL-17、TNF-α、IL-6表达与空白组比较,模型组小鼠结肠组织炎性因子IL-1β、IL-6、IL-17、TNF-α表达均显著升高(P<0.01);与模型组比较,药物干预组小鼠结肠组织炎性因子IL-6、IL-17、TNF-α、IL-1β表达均下降,差异有统计学意义(P<0.05)(见图3)。
2.5 小鼠结肠组织MyD88信号通路的改变与空白组比较,模型组小鼠结肠组织中MyD88及NF-κB p65表达增加,差异有统计学意义(P<0.05);与模型组比较,药物干预组MyD88及NF-κB p65表达降低,差异有统计学意义(P<0.05)。Western blotting检测结肠组织中NF-κB p65、Foxp3、RORγt活性,与空白组比较,模型组小鼠结肠组织中NF-κB p65、RORγt活性增加,Foxp3活性降低,差异有统计学意义(P<0.05);与模型组比较,药物干预组NF-κB p65、RORγt活性降低,Foxp3活性升高,差异有统计学意义(P<0.05)(见图3~4)。
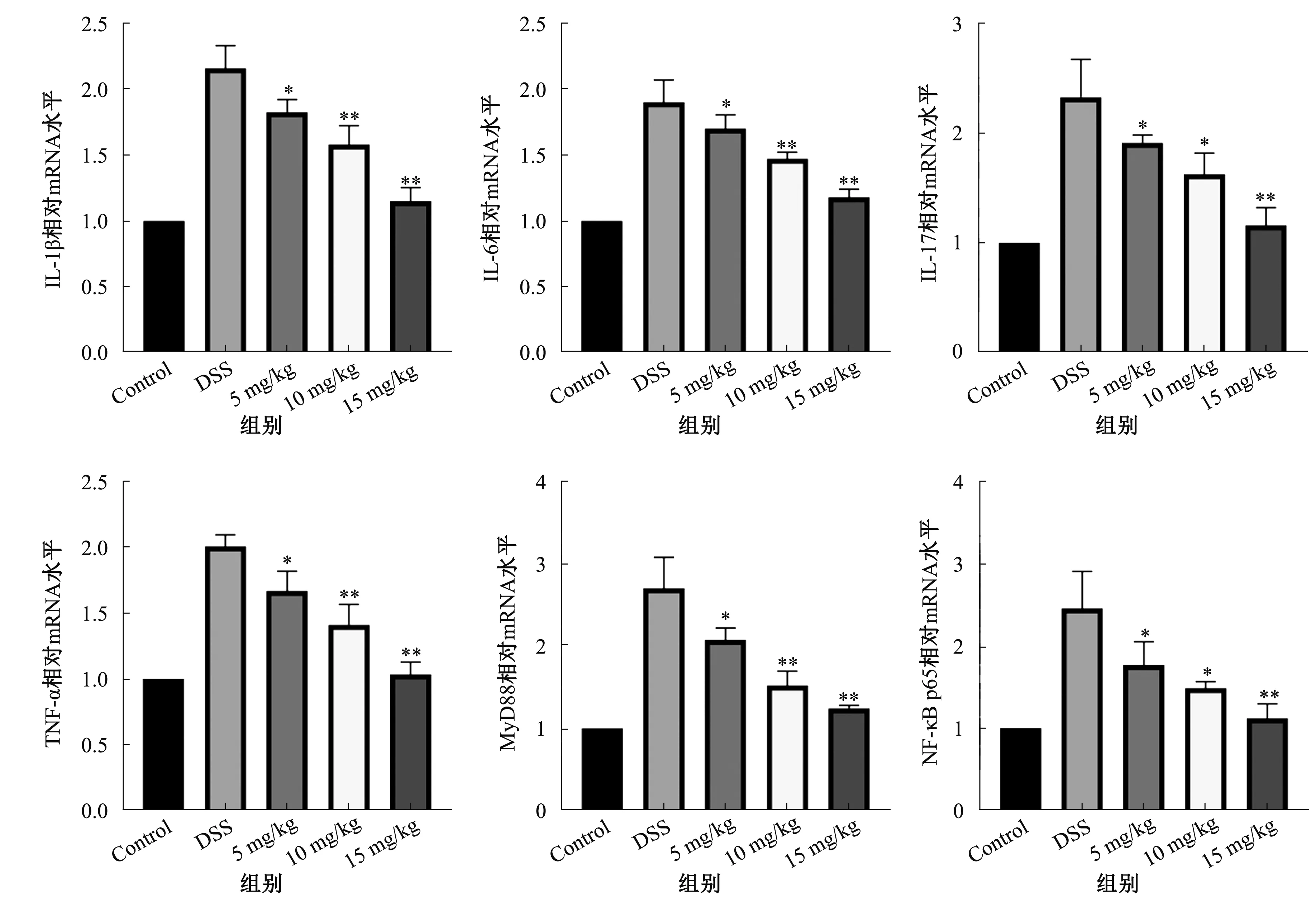
注:与DSS组比较,*P<0.05,**P<0.01。图3 结肠组织中促炎因子IL-1β、IL-6、IL-17、TNF-α、MyD88、NF-κB p65相对mRNA水平Fig 3 The expressions of IL-1β, IL-6, IL-17, TNF-α, MyD88, NF-κB p65 mRNAs in colon tissues

注:与DSS组比较,*P<0.05,**P<0.01。图4 小鼠结肠组织中NF-κB p65、Foxp3、RORγt蛋白表达水平Fig 4 The expressions of NF-κB p65, Foxp3, RORγt proteins in colon tissues of mice
3 讨论
目前IBD仍病因不明,治疗上主要采用氨基水杨酸类药物、糖皮质激素、免疫抑制剂等[7],需要长期口服药物,但存在药物毒副反应大、出现药物抵抗和不耐受的情况,并且在患有全结肠炎的严重疾病中,存在由于慢性炎症而随时间增加的结肠癌的累积风险。因此,新型安全有效的靶向药物成为目前研究的热点。
色氨酸代谢在人类生理学中起许多重要作用。它参与生长、情绪、睡眠-觉醒周期和免疫反应的调节。色氨酸不仅是必需氨基酸,而且还是重要的分子(如5-HT、褪黑素等)的前体,并且可转化为多种活性化合物。色氨酸代谢失衡与神经系统、消化系统、呼吸系统等密切相关。IDO1可以在多种组织中表达,特别是在黏膜表面,可由炎性细胞因子IFNγ(干扰素-γ)强烈诱导[8]。有研究显示,IDO1表达的增加促进了色氨酸代谢产物的产生,色氨酸代谢产物促进了T细胞的细胞周期停滞和凋亡,并诱导了T调节细胞(Tregs)的分化[9]。虽然IDO1在结肠组织中发现了最高水平的表达,但IDO1在该位置的特定功能尚未得到充分研究。Epacadostat(INCB024360)是一种口服可逆的竞争性有效IDO1抑制剂,其对于肿瘤的免疫治疗作用目前已进入临床研究阶段[10]。本研究中,DSS给药可增加小鼠DAI评分、组织学损伤和诱发炎症,包括体质量减轻和结肠长度减少。用Epacadostat治疗小鼠可显著改善DSS诱导的体质量减轻、结肠长度减少、DAI得分增加和结肠组织结构损伤,从而暗示Epacadostat可抑制结肠炎的症状。
越来越多的文献表明,炎症通路的激活在IBD中的严重性、永存性和并发症中起至关重要的作用。MyD88是在先天免疫起关键作用,其介导白介素1受体(IL-1R)和Toll样受体(TLR)信号通路,病原体感染后,激活的受体TLR和IL-1R将MyD88作为同型二聚体募集到其细胞内结构域,然后通过信号级联传递信号,最终导致NF-κB的核易位并激活转录几种促炎因子和细胞因子的转录[11]。由于MyD88在信号传导中起着核心作用,因此调节MyD88的活性对于控制炎症至关重要。在本实验中,相对于模型组来说,在药物干预组中观察到了MyD88及NF-κB的下调,提示Epacadostat减轻结肠炎症状很可能是通过抑制MyD88-NF-κB实现的。炎性细胞(尤其是嗜中性粒细胞和巨噬细胞)的浸润产生许多促炎性细胞因子、活性氧和氮代谢物,这些均与IBD的发病机制密切相关。在模型组结肠组织中观察到了明显的炎性细胞浸润及大量隐窝结构的破坏,而药物干预组相对模型组有不同程度的减轻,小鼠结肠组织炎性因子IL-6、IL-17、TNF-α、IL-1β表达较模型组均下降,从而导致结肠组织的炎性状况和组织损伤降低。
在本实验中还观察到相对于模型组来说,药物干预组中RORγt活性降低,Foxp3活性升高,提示Epacadostat减轻结肠炎症状可能与Th17细胞及Tregs细胞的转化平衡有关[12],但其在控制炎症中的作用仍需进一步的研究。
总之,我们的实验表明,口服Epacadostat在实验性结肠炎的小鼠模型中具有抗炎作用。其可减少炎性细胞的浸润,抑制促炎性细胞因子如TNF-α、IL-1β和IL-6的产生及表达,并减轻DSS诱导的小鼠结肠炎中DAI和组织学评分。此外,我们认为,Epacadostat的抗炎特性与上游通道(MyD88-NF-κB)的抑制有关。因此,我们的发现提示口服Epacadostat可能对IBD有一定治疗益处,但仍需进一步研究。

