MIF与JNK1在原发性肝细胞癌中的表达及相关性研究
魏 敏,曹莉婷,卢利霞,张久聪,李初谊,郑 英,王俊科,李 斌,刘 鑫,王 盼,肖 梅,于晓辉
1.中国人民解放军联勤保障部队第九四〇医院消化内科,甘肃 兰州 730050; 2.兰州大学第二临床医学院; 3.中国科学技术大学附属第一医院消化科
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的消化系统恶性肿瘤之一,其发病率和死亡率已分别跃居我国恶性肿瘤的第4位和第2位[1],严重威胁着国民健康。因此对于HCC发病机制的深入研究对于其早期预防、诊断及探索该病的治疗靶点具有重要意义。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种主要由活化的T淋巴细胞分泌的可抑制巨噬细胞/单核细胞移动的细胞因子,在机体免疫和炎症反应过程中起着重要的作用。而近些年越来越多的研究也证实了MIF在多种肿瘤组织中高表达,MIF与相应受体结合后,可通过激活一系列细胞内的信号通路,如PI3K/AKT、MAPK和G蛋白偶联受体相关信号传导等,促进肿瘤的增殖、侵袭和迁移。c-Jun氨基末端蛋白激酶(c-Jun N-terminal kinase,JNK)作为MAPK家族的主要成员之一,有JNK1、JNK2和JNK3三种亚型,众多研究表明,JNK1在HCC的发生和发展中起着更为关键的作用。但目前尚无MIF与JNK1相关性的报道。故本研究主要通过免疫组化、原位杂交、Western blotting等实验方法检测HCC癌组织、癌旁组织和肝癌细胞中MIF、JNK1、pJNK1、MIF mRNA和JNK1 mRNA的表达水平,并探讨二者相互关系,为揭示HCC可能的发病机制提供思路。
1 资料与方法
1.1 临床资料收集中国人民解放军联勤保障部队第九四〇医院2018年1月至2019年12月收治的52例HCC患者手术切除的癌组织及相应癌旁组织(距肿瘤组织2.0 cm以上),另收集20例肝血管瘤、肝破裂等手术患者的正常肝组织。全部病例临床资料完整,本研究经医院伦理委员会批准并征得患者及家属知情同意。所有标本经10%甲醛固定,石蜡包埋,制作成组织芯片石蜡块,切片厚约4 μm。
1.2 实验试剂重组人MIF购自PeproTech公司(目录号:300-69),兔抗人MIF单克隆抗体(ab7207)、兔抗人JNK1的单克隆抗体及羊抗兔二抗(ab110724)购自Abcam公司,磷酸化兔抗人JNK1单克隆抗体购自CST公司(4668),Total RNA提取(9108)、反转录试剂盒(RR047A)及PCR反应试剂盒(RR820A)均购自日本TaKaRa公司,L-O2正常肝细胞、HepG2肝癌细胞购自中国科学院昆明细胞库,胎牛血清购自Hyclone公司,1640培养基干粉和胰蛋白酶购自Gibco公司,四甲基偶氮唑蓝、二甲基亚枫购自Sigma公司。
1.3 免疫组织化学染色使用免疫组化试剂盒对切片进行免疫染色。载玻片在二甲苯中脱蜡,在浓度升高的乙醇中依次水化,然后在磷酸盐缓冲液(phosphate buffered saline,PBS)中冲洗,用山羊血清阻断10 min后。先用1∶80单克隆兔抗人MIF抗体工作液加在组织芯片上,室温下孵育50 min,PBS冲洗后山羊血清阻断10 min,加辣根酶标记的山羊抗兔IgG(稀释倍数1∶80),DAB显色,苏木素复染,肝细胞浆内MIF阳性呈黄色或棕黄色细颗粒。JNK1、pJNK1(稀释倍数均为1∶100)检测步骤与MIF相同。
1.4 原位杂交石蜡组织芯片用二甲苯常规脱蜡,梯度乙醇透明至PBS水洗,蛋白酶K消化(25 μg/ml),37 ℃,20 min。在37 ℃的2×标准柠檬酸盐(SSC)中洗涤后,将切片预杂交,然后在杂交缓冲液中分别与MIF寡核苷酸探针杂交,置湿盒内37 ℃,24 h,然后在37 ℃的2×SSC、0.5×SSC及0.2×SSC洗涤,用碱性磷酸酶结合生物素化鼠抗地高辛片段检测杂交探针,DAB显色,苏木素复染。JNK1 mRNA的检测步骤与MIF mRNA相同。
1.5 Real-time PCR用Trizol提取法提取总RNA,多功能酶标仪检测RNA纯度和浓度,并通过TaKaRa PrimeScriptTMRT Master MIX(Perfect Real Time)反转录试剂盒将RNA逆转录成cDNA,采用TaKaRa SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)PCR反应试剂盒进行相对荧光定量检测,上述实验重复3次,结果转换为2-ΔΔCT进行分析。JNK1和GAPDH的引物购自Takara公司,所使用引物序列如下:JNK1:Sense:5′-CCTGGCAAGCACTACCTGGA-3′;Antisense:5′-CAAGCCACCTTGGTCTTGGA-3′;GAPDH:Sense:5′-GCACCGTCAAGGCTGAGAAC-3′;Antisense:5′-TGGTGAAGACGCCAGTTGGA-3′。
1.6 Western blotting取不同浓度rMIF组的细胞并裂解,裂解产物在4 ℃离心取上清液,对总蛋白进行定量及变性,按30 μg/孔总蛋白进行10% SDS-PAGE电泳后并转移到聚偏二氟乙烯膜,5%脱脂乳室温封闭1 h,用JNK1(1∶1 000)兔抗人抗体4 ℃孵育过夜,TBST清洗后,用辣根过氧化物酶标记的羊抗兔二抗37 ℃温育1 h,加化学发光(ECL)显色,检测JNK1的表达。pJNK1的检测步骤同上。
1.7 免疫组织化学和原位杂交结果判断阳性细胞表现为细胞质或细胞核中出现棕黄色的颗粒,根据染色的广度和强度进行评分。在光学显微镜200倍下阅片,选择无边缘效应、无组织折叠等影响读片效果的典型部位,随机选取5个不重复视野,取每个视野内的平均阳性细胞数作为计数标准,由两名有经验的病理医师在双盲下参照Axiotis病理评分标准[2]对免疫组化和原位杂交结果进行阅片,根据细胞染色强度及阳性细胞占同类细胞总数的百分比综合判定。染色程度分为4个等级:无阳性着色为0分,黄色或浅粉色为1分,棕黄色或粉色为2分,黄褐色或红色为3分。阳性细胞占整张片比例评分标准:<10%为0分,10%~40%为1分,41%~70%为2分,>70%为3分。两种评分相加:0~1分为阴性;2分为弱阳性;3~4分为阳性;5~6分为强阳性。≤2分定为阴性,>2分定为阳性。
1.8 统计学方法采用SPSS 22.0统计学软件进行数据分析处理,计量资料采用单因素方差分析,计数资料采用Pearson Chi-square (χ2检验)。P<0.05为差异有统计学意义。
2 结果
2.1 MIF、JNK1和pJNK1蛋白在HCC中高表达通过免疫组织化学方法观察各组组织中MIF、JNK1、pJNK1蛋白的阳性染色信号。其中MIF、JNK1蛋白在HCC癌组织和癌旁组织中均呈弥漫性或灶性分布,且均以胞浆表达为主,阳性染色信号呈棕黄色。而在正常肝细胞中二者呈阴性表达(见图1)。MIF、JNK1在HCC癌组织和癌旁组织中的表达与正常肝组织比较,差异均有统计学意义(P均<0.05),HCC癌组织和癌旁组织间比较,差异无统计学意义(P>0.05)(见表1)。pJNK1阳性表达定位于细胞核中,阳性染色呈棕褐色(见图1)。统计学分析表明,pJNK1在HCC癌组织中的表达明显高于癌旁组织和正常肝组织(P均<0.05)。在HCC癌组织中pJNK1表达呈阳性,且阳性率为67.31%(35/52),在癌旁组织中表达呈可疑阳性,阳性率为44.23%(23/52),二者差异有统计学意义(P<0.05),而癌旁组织和正常肝组织比较,差异无统计学意义(P>0.05)(见表1)。
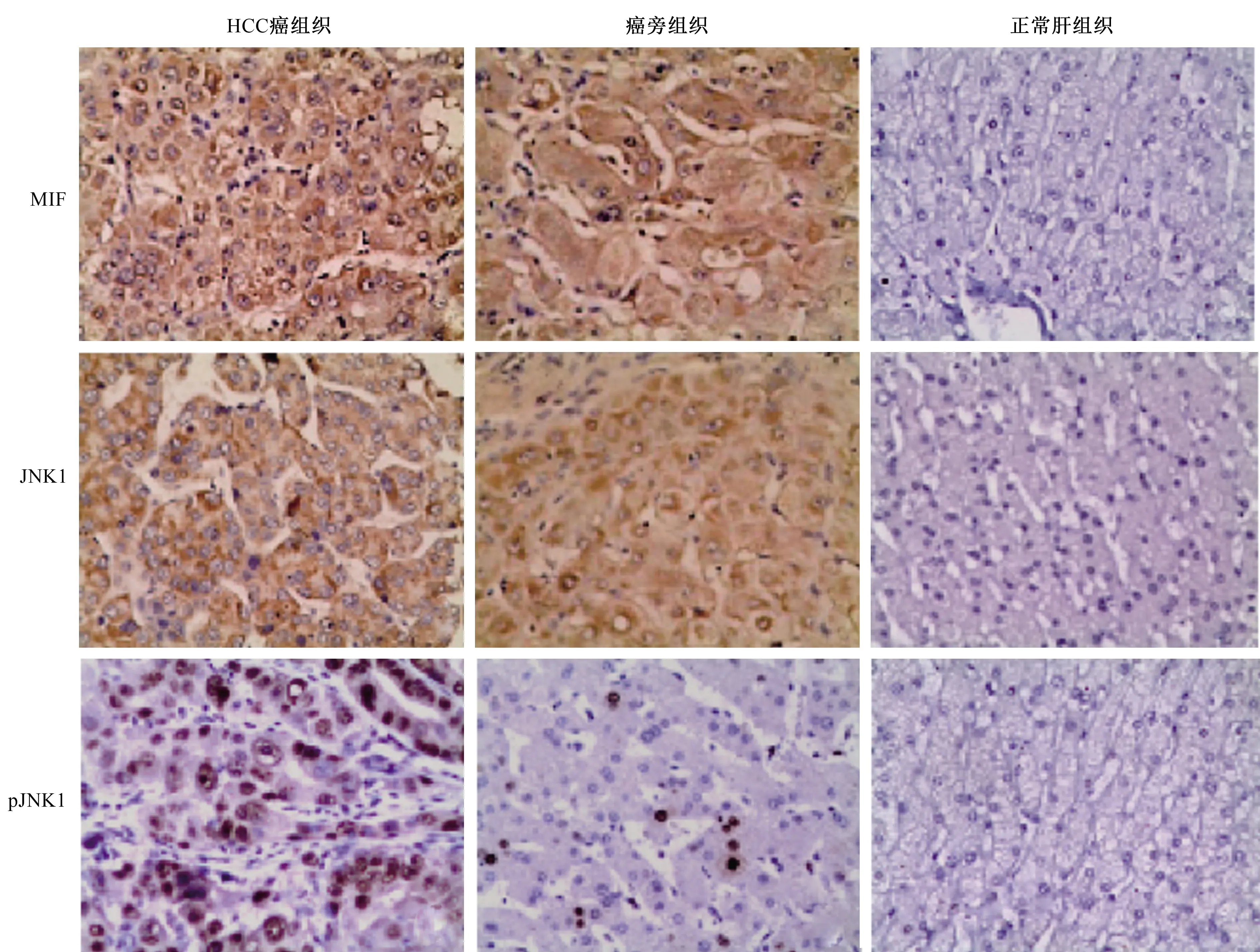
图1 免疫组织化学染色法检测MIF、JNK1、pJNK1蛋白在HCC癌组织、癌旁组织和正常肝组织中的表达(放大200倍) Fig 1 The expressions of MIF, JNK1 and pJNK1 proteins in HCC cancer tissues, adjacent tissues and normal liver tissues detected by immunohistochemistry
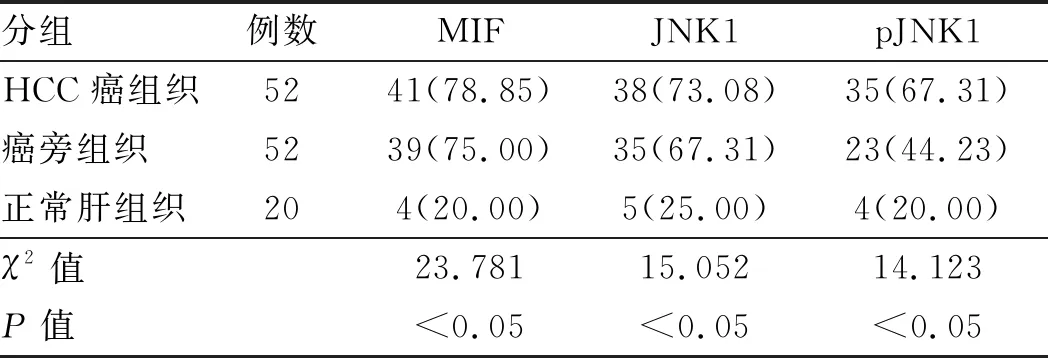
表1 MIF、JNK1和pJNK1蛋白在HCC癌组织、癌旁组织 和正常肝组织中的阳性表达率[n(%)]Tab 1 The positive expression rates of MIF, JNK1 and pJNK1 proteins in HCC cancer tissues, adjacent tissues and normal liver tissues [n(%)]
2.2 MIF mRNA和JNK1 mRNA在HCC中高表达通过原位杂交法检测MIF mRNA、JNK1 mRNA在各组肝组织中的表达。MIF mRNA和JNK1 mRNA在HCC癌组织和癌旁组织中均呈阳性表达,且主要在细胞浆内,阳性染色颗粒呈深棕色或棕黄色,在正常肝组织中呈阴性表达(见图2),两种核酸在HCC癌组织和癌旁组织中的表达均明显高于正常肝组织,差异有统计学意义(P均<0.05),而在HCC癌组织和癌旁组织中,二者表达的差异无统计学意义(P>0.05)(见表2)。
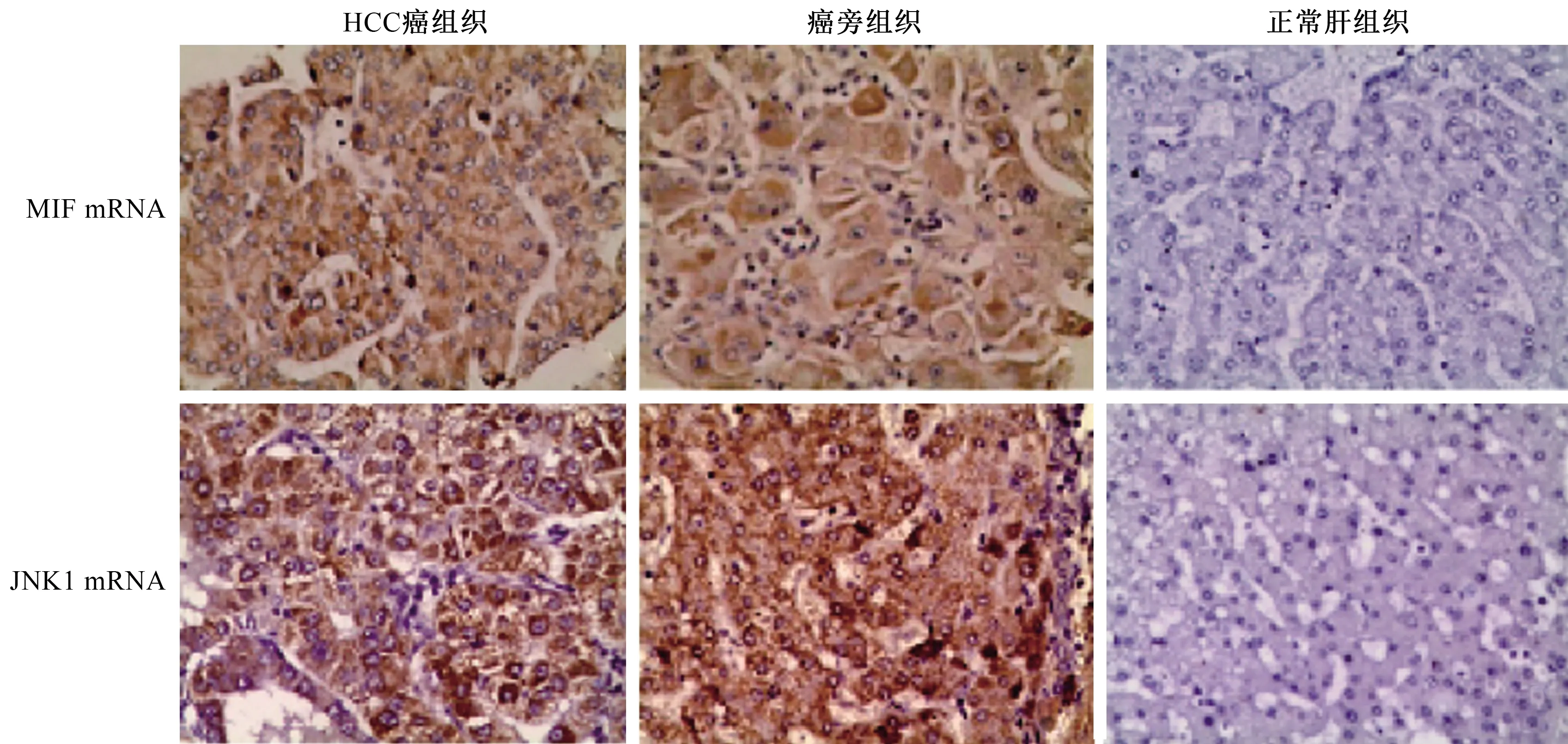
图2 原位杂交法检测MIF mRNA、JNK1 mRNA在HCC癌组织、癌旁组织和正常肝组织中的表达(放大200倍) Fig 2 The expressions of MIF mRNA, JNK1 mRNA in HCC cancer tissues, adjacent tissues and normal liver tissues detected by in situ hybridization
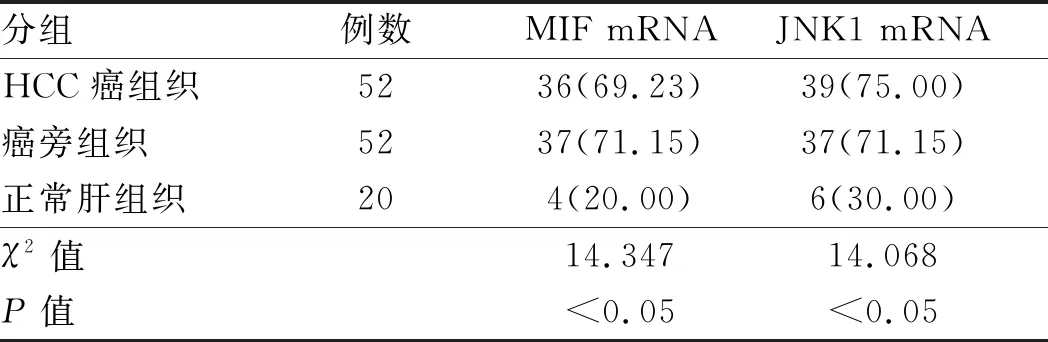
表2 MIF mRNA、JNK1 mRNA在HCC癌组织、癌旁组织和 正常肝组织中的阳性表达率[n(%)]Tab 2 The positive expression rates of MIF mRNA, JNK1 mRNA in HCC cancer tissues, adjacent tissues and normal liver tissues [n(%)]
2.3 rMIF可上调HepG2肝癌细胞中pJNK1的活性用不同浓度的rMIF(0 ng/ml、50 ng/ml、100 ng/ml和200 ng/ml)作用于L-O2细胞和HepG2细胞24 h,通过Western blotting法检测JNK1、pJNK1蛋白的表达情况。在HepG2细胞中,JNK1蛋白在rMIF不同浓度组的表达差异无统计学意义(P均>0.05)。而pJNK1蛋白呈浓度依赖性增加,尤以rMIF浓度为200 ng/ml时表达最明显。与正常对照组比较,差异有统计学意义(P<0.05)(见图3~5)。

图3 不同浓度rMIF对L-O2细胞中JNK1和pJNK1 表达量的影响
Fig 3 Effects of different concentrations of rMIF on the expression of JNK1 and pJNK1 in L-O2 cells

图4 不同浓度rMIF对HepG2细胞中JNK1和pJNK1 表达量的影响Fig 4 Effects of different concentrations of rMIF on the expression of JNK1 and pJNK1 in HepG2 cells
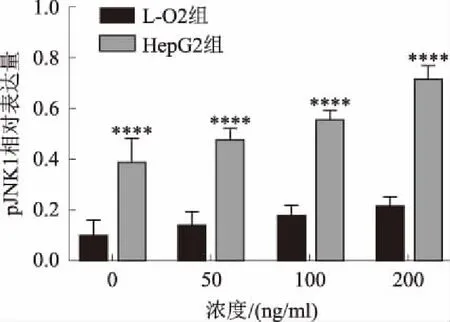
注:与L-O2组比较,*P<0.05,**P<0.01; ***P<0.001, ****P<0.0001。图5 不同浓度的rMIF作用下,pJNK1蛋白在L-O2、HepG2 细胞中的相对表达量
Fig 5 Changes in the relative expression of pJNK1 in L-O2 and HepG2 cells under the action of different concentrations of rMIF
2.4 rMIF可促进HepG2肝癌细胞中JNK1 mRNA的表达用不同浓度的rMIF(0 ng/ml、50 ng/ml、100 ng/ml和200 ng/ml)作用于L-O2细胞和HepG2细胞24 h,通过RT-PCR技术检测两组细胞中JNK1 mRNA的表达。JNK1 mRNA在HepG2肝癌细胞和L-O2正常肝细胞中均有表达,但在HepG2肝癌细胞中的表达明显高于L-O2正常肝细胞,两组比较,差异有统计学意义(P<0.05);JNK1 mRNA的表达随着rMIF浓度的递增而增加,尤以rMIF浓度为200 ng/ml时表达最明显,各浓度组之间比较,差异均有统计学意义(P<0.05)(见图6)。

注:与L-O2组比较,*P<0.05,**P<0.01; ***P<0.001, ****P<0.0001。图6 RT-PCR法检测不同浓度rMIF对L-O2细胞和 HepG2细胞中JNK1 mRNA表达的影响Fig 6 Effects of different concentrations of rMIF on the expression of JNK1 mRNA in L-O2 cells and HepG2 cells detected by RT-PCR
3 讨论
MIF作为一类具有促炎和致癌双重作用的多能细胞因子,在多种肿瘤细胞和组织中过表达且与疾病发病机制和病情进展相关[3-5]。研究提示MIF可通过结合其细胞表面受体CD74,启动胞内一系列信号级联,包括PI3K/AKT、MAPK、NF-κB、HIF-1α等,调控肿瘤细胞增殖和存活。此外,MIF还能直接或间接调节肿瘤抑制基因p53的功能,促进肿瘤细胞进展[6-8]。而最近的多项研究表明,JNK作为MAPK家族中的一员,在MIF介导的肿瘤进展中发挥着重要作用。如Liu等[9]在腺样囊性癌组织中检测MIF呈过度表达,且与pJNK的活化呈显著负相关,用MIF特异性抑制剂ISO-1对腺样囊性癌细胞系ACC-2进行处理后,肿瘤细胞生长、侵袭和迁移过程被显著抑制,同时JNK活性明显上调,从而提示MIF可能是通过下调JNK活性参与其恶性进展。这与Varinelli等[10]的研究结果具有一致性,其研究表明在甲状腺癌细胞中,应用选择性MIF抑制剂4-IPP可通过阻断MIF/CD74内化,激活JNK,呈剂量依赖性诱导肿瘤细胞凋亡和有丝分裂性细胞死亡,进而抑制其增殖。此外,MIF还可通过激活或阻断JNK信号传导过程参与结直肠癌[11]、非小细胞肺癌[12]和胶质瘤[13]的发生发展。而在HCC中,目前国内外尚无相关研究。
作者所在的研究团队既往研究结果提示,MIF作为衔接炎症与肿瘤的关键桥梁,参与了乙肝-肝硬化-HCC发生与发展的全过程,且与肝脏组织损伤程度密切相关[14],这也与近期国内外研究报道一致[15-16],但具体机制尚不明确。而JNK作为MAPK通路的一条亚通路,主要分为3种亚型。其中,研究表明JNK在肝癌组织中仅有两种亚型,即:JNK1和JNK2,而大量的研究证实,相比于JNK2,JNK1才是人肝癌细胞体外增殖和异种移植后肿瘤发生所必需的[17]。如JNK1而不是JNK2是应激诱导c-Jun磷酸化的主要激酶[18],JNK1缺乏则可保护小鼠免受DEN诱导的肝细胞死亡,从而降低肝癌的增殖和形成[19]。此外也有研究表明,JNK1的激活在人原发性肝癌中明显增加,而JNK2的激活则不明显[20]。综上所述,JNK1在HCC的发生和发展中起着更为关键的作用。
上述研究结果提示MIF、JNK1均与HCC密切相关,然而关于MIF与JNK1的相关性及在HCC中作用机制尚不清楚。因此,本研究收集乙肝肝硬化基础的HCC患者52例,取手术切除的癌组织及相应的癌旁组织为实验组,同期取20例肝血管瘤、肝破裂手术切除标本作正常对照,应用免疫组化、原位杂交、Western blotting等实验方法检测HCC癌组织、癌旁组织和肝癌细胞中MIF、JNK1、pJNK1、MIF mRNA和JNK1 mRNA的表达水平,结果提示MIF、JNK1、pJNK1和JNK1 mRNA在HCC癌组织和癌旁组织中的阳性表达率均明显高于正常肝组织,且经不同浓度的rMIF刺激后,HepG2肝癌细胞中pJNK1和JNK1 mRNA的相对表达量均呈浓度依赖性升高,从而提示MIF参与HCC进展,可能是通过激活JNK1信号通路来实现的。
综上,MIF、JNK1、pJNK1在HCC组织和HepG2肝癌细胞中呈高水平表达,MIF参与HCC发生与发展可能是通过激活JNK1信号通路来实现的,这一研究结果可为以MIF为靶点的抗HCC新药研发提供理论依据。

