TMEM106C通过抑制P53信号通路促进肝癌细胞的恶性增殖及转移
王炳淑,戢楠楠,梁荣珍
海南医学院第二附属医院病理科,海南 海口 570311
源自肝上皮或间质组织的肝癌是全球十大致命疾病之一[1]。在中国,每年新增的肝癌病例约有466 000例,占全球病例的一半以上,尤其在江苏东南沿海的发病率特别高[2]。流行病学研究表明,乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、饮酒和肝硬化可能是导致肝癌的致病因素[3-4]。跨膜蛋白106(TMEM106)家族的成员(TMEM106A、B和C)与多种肿瘤密切相关。在小鼠中,TMEM106A被证明通过有丝分裂激活蛋白激酶和核因子NF-κB信号通路从而激活巨噬细胞系[5]。此外,TMEM106A在人肝癌中常被甲基化,并可能通过诱导细胞凋亡从而抑制肝癌细胞的生长[6]。Vass等[7]确定了TMEM106B的某些基因型与肌萎缩性患者认知能力相关。Rutherford等[8]还报道了TMEM106B突变体参与了阿尔茨海默氏病的发病进程,发现在人强直性脊柱炎中TMEM106C的表达发生了改变[9]。猪TMEM106C同源物被预测为多发性先天性关节炎的功能性生物标志物[10]。研究显示,TMEM106C在肝癌中通过靶向FOXO1和FOXO3从而促进肝癌细胞生长、迁移和侵袭,在肝癌中发挥致癌基因功能[11]。与上述结论一致的是,我们的研究也发现TMEM106C在肝癌中为致癌基因,但也通过抑制P53信号通路从而促进肝癌细胞的恶性增殖及转移,本研究为TMEM106C可能成为临床上肝癌治疗的新靶标或预后标志物提供参考。
1 材料与方法
1.1 细胞培养人肝癌细胞HepG2购自美国ATCC细胞库,培养在含质量浓度为100 g/L胎牛血清的RPMI-1640(购自BI代理公司)培养基中,并加入100 μg/ml链霉素和100 IU/ml青霉素。细胞培养瓶置于含体积分数为5%的CO2和95%湿度的37 ℃培养箱中。
1.2 肝癌靶基因筛选及临床验证在临床数据库GEPIA(Gene Expression Profiling Interactive Analysis)[12]中,通过tumor/normal>2原则找到在肝癌中高表达的蛋白,并通过GEPIA数据库找到与肝癌临床预后密切相关的蛋白,将两部分蛋白进行重合性分析,从而筛选到目的蛋白。收集2018年6月至2019年6月我院肝胆外科行肝癌手术的32例肝癌患者肿瘤组织标本及其癌旁组织标本,采用qRT-PCR法检测组织中TMEM106C mRNA表达情况。
1.3 细胞转染以6孔板转染siRNA(购自广州瑞博公司)为例:将1 μl siRNA与250 μl Opti-MEM(thermo:11058021)混匀,1 μl lipo2000(invitrogen:11668027)与250 μl Opti-MEM混匀,室温放置5 min,然后将两部分合并,混匀,静置15 min,之后逐滴、均匀加入6孔板中的1个孔中。
1.4 实时荧光定量PCR实验(qRT-PCR)使用primer3(http://frodo.wi.mit.edu/primer3/)设计两条特异性qPCR引物;cDNA用灭菌纯水稀释适当的浓度,一般稀释20倍,按照qPCR mix 5 μl,primer 1 μl,cDNA 4 μl的配方加入到96孔PCR板中;贴膜,以2 500 r/min离心1 min,将样品放入qPCR仪器中进行实验,反应完成后,拷贝数据,进行分析。
1.5 细胞增殖实验消化长满的10 cm盘细胞,重悬于1 ml新鲜培养基中,用20 μl可铺1个96孔板的密度铺细胞,每个实验组需3个生物重复,铺好所需的实验孔数。在体积分数为5% CO2,37 ℃条件下孵育。细胞贴壁后即可转染siRNA,48 h后,开始测量吸光度。配制MTS(abcam:ab197010)反应液,按照MTS∶培养液=1∶20的比例配制反应液。每孔加入100 μl MTS反应溶液,37 ℃继续培养。每隔半小时检测一次吸光度。将培养皿置摇床上低速振荡10 s以充分溶解结晶物。在490 nm处测量各孔的吸光度值。将每日的吸光值转换成代表每日细胞生长的参数,并绘制细胞增殖曲线。
1.6 克隆形成实验以6孔板细胞为例:每孔铺2 000个细胞,细胞贴壁后即可转染siRNA。每个样品做3个生物重复,待6~14 d后出现肉眼可见的克隆,收集细胞,用常温的PBS洗涤2次,用甲醇、乙酸比为3∶1的固定液进行常温固定5 min,用含0.5%结晶紫的甲醇溶液常温固定15 min,水洗,直至背景紫色洗掉,室温晾干进行扫描,用10%醋酸溶液溶解结晶紫,并在490 nm处测吸光度值,绘制数据柱状图。
1.7 细胞周期实验消化细胞后,收集到1.5 ml离心管中,3 000 r/min离心3 min,用真空泵弃去上清液;将细胞重悬于1 ml PBS溶液中,尽量吹散,滴加等体积预冷的无水乙醇,边加边振荡混匀,在4 ℃中静置12~24 h;3 000 r/min离心3 min,真空弃上清,重复1次;加入500 μl PI/Triton X-100染液[0.1%(v/v)Triton X-100(Sigma:T9284-500M),0.2 mg/ml DNase-free RNase A(Sigma),0.02 mg/ml propidium iodide(Roche)],37 ℃孵育15 min,对DNA进行充分染色,纱布过滤成簇的细胞,并用锡箔纸包上避光保存直至上机实验;流式细胞仪分析。
1.8 基因功能分析在临床数据库cBioPortal[13-14]中找到与TMEM06C共表达的基因,将这些基因在metascape中进行信号通路分析,从而为解析目的蛋白在癌症进程中发挥的功能提供参考。
2 结果
2.1 筛选肝癌靶基因通过数据库找到在肝癌中相比临近正常组织高表达的基因,共1 482个,同时找到与肝癌具有显著临床预后相关性的基因(P<0.05),共100个,将这两部分基因进行重合性分析,发现有30个基因既在肝癌中高表达且具有显著临床预后相关性(见图1A),进一步通过高表达预后差原则我们筛选到目的靶基因TMEM106C(见图1B)。
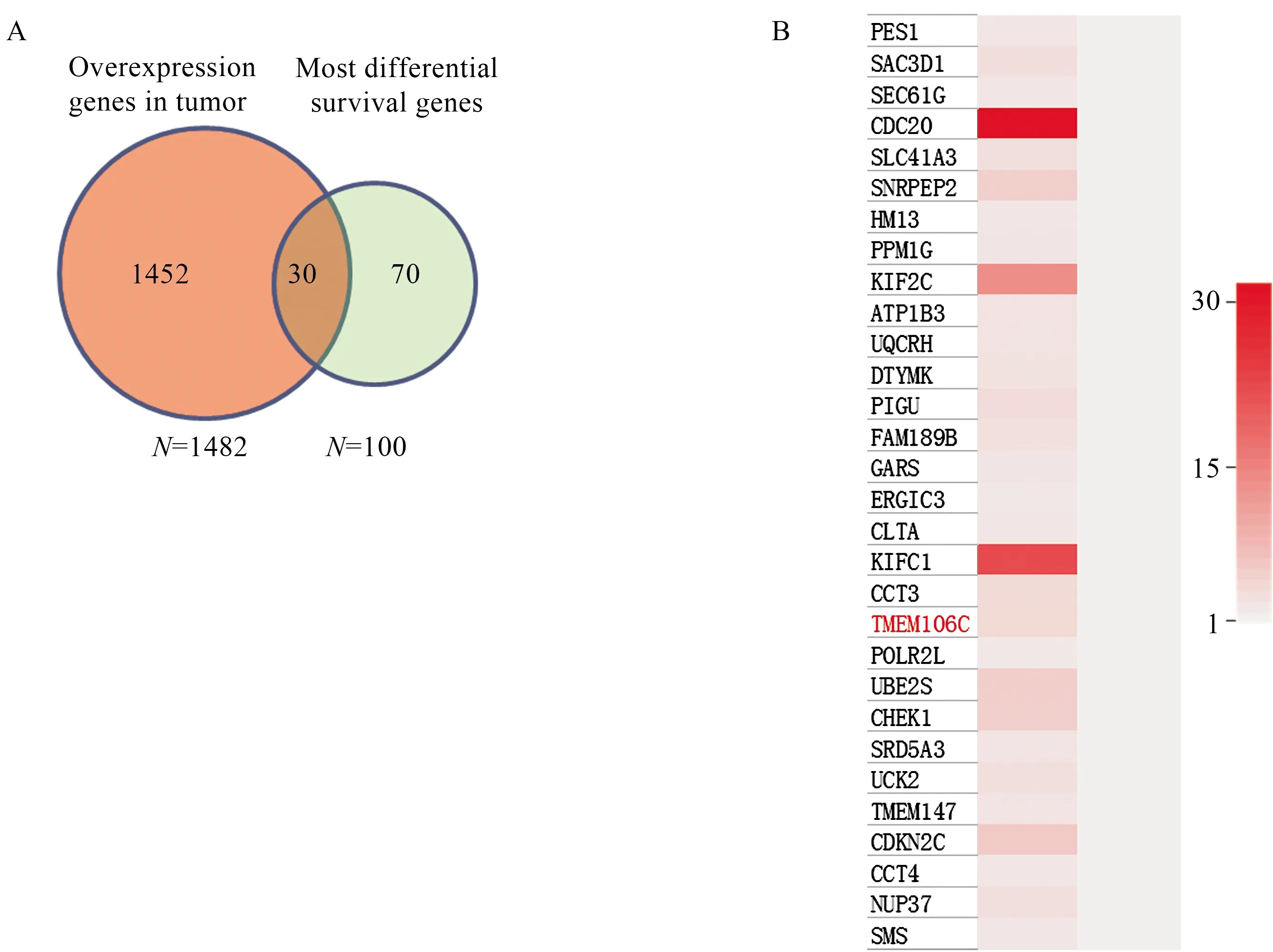
图1 筛选肝癌中具有临床意义的靶基因 A:重合性分析既在肝癌中过表达且具有显著临床意义的基因;B:热图分析各基因在 肝癌和临近组织中的表达情况
Fig 1 Screening of clinically target genes in liver cancer A: analysis of genes that were overexpressed in liver cancer and had signifi-cant clinical significance; B: heat map analysis of the expression of each gene in liver cancer and adjacent tissue
2.2 TMEM106C在肝癌中的表达特征与癌旁正常组织相比,TMEM106C在肝癌中显著高表达(P<0.001,见图2A),且高表达具有显著的预后差特征(P<0.01,见图2B),说明TMEM106C是一种致癌基因;经qRT-PCR检测32例肝癌组织及对应癌旁正常组织中TMEM106C mRNA表达,结果显示:癌组织中TMEM106C mRNA显著高表达,差异有统计学意义(P<0.001,见图2C)。
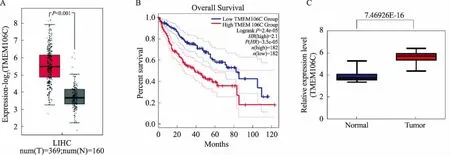
图2 TMEM106C在肝癌中的表达特征 A:GEPIA数据库显示TMEM106C在肝癌和临近正常组织中的表达情况;B:TMEM106C与肝癌临床预后相关性;C:TMEM106C在临床肝癌组织及癌旁正常组织中的表达情况
Fig 2 TMEM106C expression characteristics in liver cancer A: the expression of TMEM106C in liver cancer and adjacent normal tissues in GEPIA database; B: correlation between TMEM106C and clinical prognosis of liver cancer; C: expression of TMEM106C in clinical liver cancer tissues and adjacent normal tissue
2.3 TMEM106C在肝癌细胞中的生物学功能qRT-PCR实验显示,在肝癌细胞中利用两条siRNA靶向TMEM106C的表达被明显敲低(P<0.001,见图3A),细胞增殖实验发现,在敲低TMEM106C表达的肝癌细胞中,与对照组siCTL相比,细胞增殖速率显著减慢(P<0.001,见图3B);克隆形成实验同样发现,在敲低TMEM106C表达的肝癌细胞中,与对照组siCTL相比,克隆形成速率显著减慢(P<0.001,见图3C);同时细胞周期实验发现,相比于对照组siCTL,敲低TMEM106C表达的肝癌细胞周期被显著阻滞在G1期(P<0.001,见图3D);证明了TMEM106C在肝癌发生、发展中具有促进肝癌细胞生长的重要作用。
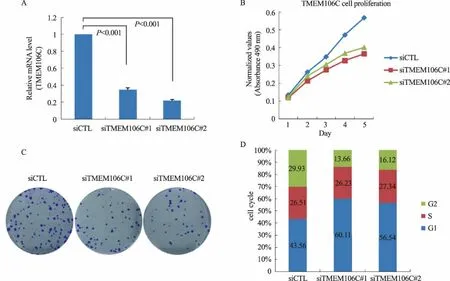
图3 TMEM106C促进肝癌细胞生长增殖,敲低其表达可将细胞周期显著阻滞在G1期 A:两条siRNA靶向TMEM106C在肝癌细胞中的敲低效率;B:敲低TMEM106C表达后的细胞增殖速率;C:敲低TMEM106C表达后的克隆形成速率;D:敲低TMEM106C表达后的细胞周期变化情况
Fig 3 TMEM106C promoted the growth of liver cancer cells, knocking down its expression could significantly block the G1 phase of the cancer cell cycle A: two siRNAs to mediate the knockdown efficiency of TMEM106C in liver cancer cells; B: cell proliferation rate after knocking down TMEM106C expression; C: cloney formation rate after knocking down TMEM106C expression; D: cell cycle after knocking down TMEM106C expression
2.4 TMEM106C可能通过参与P53信号通路促进肝癌细胞生长增殖将与TMEM106C共表达的基因进行了基因富集功能分析,KEGG信号通路和GO信号通路均显示,TMEM106C可能参与P53信号通路(见图4A~4B);而已有大量文献报道P53信号通路确实与细胞周期和DNA修复改变密切相关,为了验证TMEM106C参与P53信号通路,我们在敲低TMEM106C的肝癌细胞中检测了抑癌基因p53激活状态和关键靶基因p21的改变,发现在利用两条siRNA靶向敲低TMEM106C的肝癌细胞中,p53的磷酸化和p21均显著升高(见图4C~4D),说明敲低TMEM106C的表达,抑癌基因p53和p21被活化,因此抑制了肝癌细胞的生长增殖。
3 讨论
目前关于驱动肝癌发病机理的确切基因的知识有限。肝癌的病因和发展通常被认为与几个主要因素有关,从病毒到可能影响肿瘤微环境的代谢紊乱[15]。乙型和丙型肝炎病毒的感染通过基因组突变或慢性炎症导致肝癌。代谢性疾病(如2型糖尿病)和非酒精性脂肪性肝炎也增加了发生肝癌的风险。由这些因素中的任何一个触发的肿瘤启动子的激活或肿瘤抑制子的失活均可影响肿瘤微环境并导致肝癌的发展。
本研究中,我们通过将肝癌中高表达的基因与临床上具有显著预后相关性的基因进行重合性分析,发现TMEM106C可能作为肿瘤激活子影响肿瘤微坏境从而导致肝癌的发展,因此我们采用分子生物学实验进行了验证。发现在敲低TMEM106C表达的肝癌细胞,增殖速率和克隆形成速率均显著减慢,同时敲低TMEM106C表达的肝癌细胞周期显著阻滞在G1期,这与之后我们将与TMEM106C共表达的基因进行功能分析中参与细胞周期通路相吻合。同时我们也发现TMEM106C可能参与P53信号通路影响肝癌的发生发展,P53信号通路是抗肿瘤药物开发中最关键的途径之一。p53在所有人类肿瘤中一半以上都有错义突变[16-17]。最初的研究表明它是一种原癌基因,而于1989年野生型p53被最终证明是一种有效的抑癌剂[18],p21作为此通路中的关键靶基因也发挥着抑癌基因的作用。
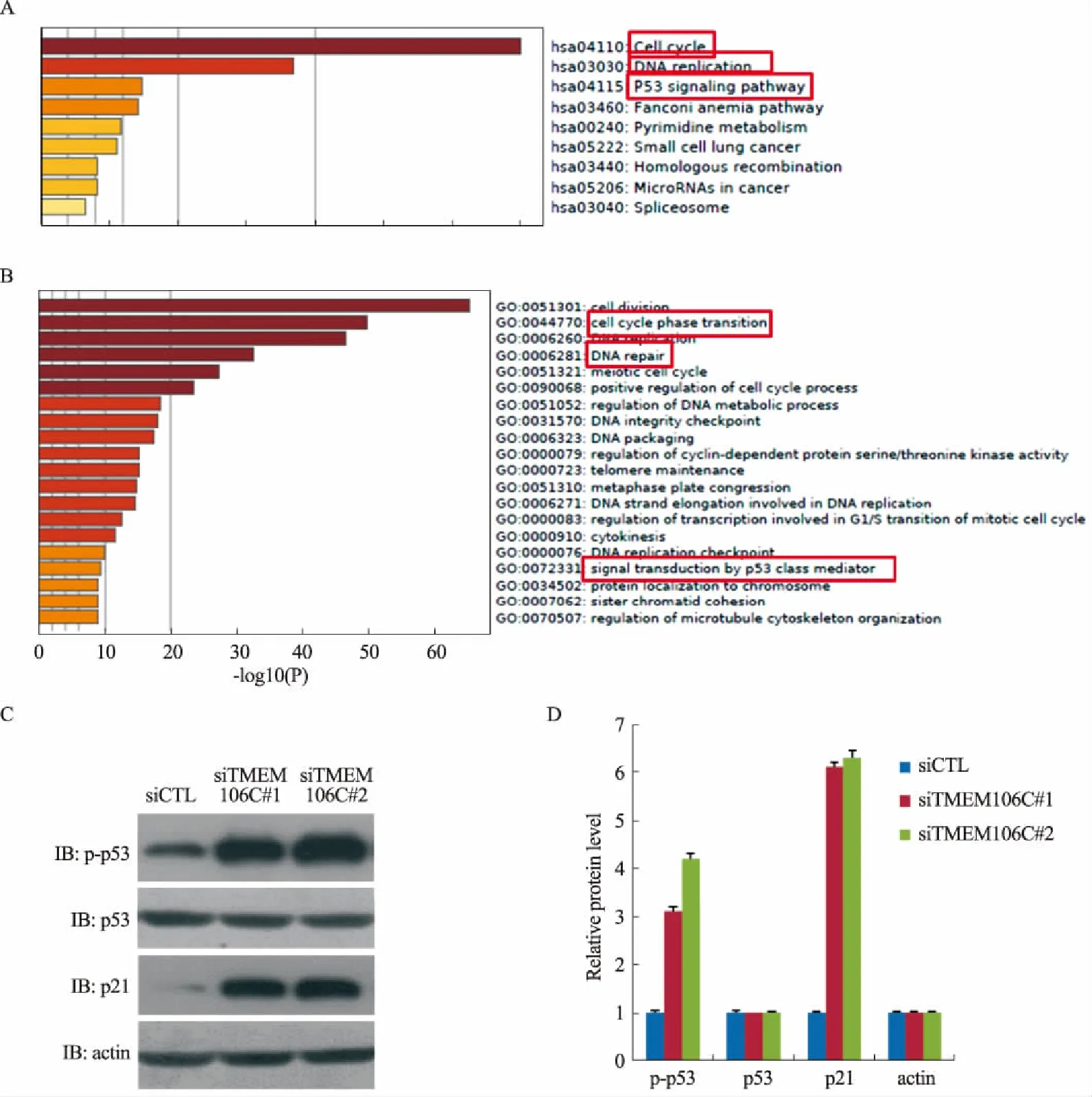
图4 TMEM106C可能通过参与P53信号通路促进肝癌细胞生长增殖 A:与TMEM106C共表达基因参与的KEGG信号通路;B: 与TMEM106C共表达基因参与的GO信号通路;C:细胞免疫印记实验显示敲低TMEM106C对P53信号通路的影响;D:对C图的 灰度统计
Fig 4 TMEM106C may promote the growth and proliferation of liver cancer cells by participating in the P53 signaling pathway A: KEGG signaling pathway with TMEM106C co-expression genes; B: GO signaling pathway with TMEM106C co-expression genes; C: cellular immunoblot experiment showed the effect of knocking down TMEM106C on P53 signaling pathway genes; D. grayscale statistics of C images
将与TMEM106C共表达的基因进行了基因富集功能分析,发现KEGG信号通路和GO信号通路均显示,TMEM106C可能参与P53信号通路,导致细胞周期和DNA修复的改变;而已有大量文献报道P53信号通路确实与细胞周期和DNA修复改变密切相关,为了验证TMEM106C参与P53信号通路,我们在敲低TMEM106C的肝癌细胞中检测了抑癌基因p53激活状态和关键靶基因p21的改变,发现在敲低TMEM106C的肝癌细胞中,p53的磷酸化和p21均显著升高,说明敲低TMEM106C的表达,抑癌基因p53和p21被活化,因此抑制了肝癌细胞的生长增殖。由此说明了TMEM106C可能参与P53信号通路从而促进肝癌细胞生长增殖。
本文从筛选肝癌中高表达且具有显著临床预后相关性的基因,功能验证及分子机制等方面对促进肝癌发生发展进行了研究,但这其中的研究还不是很全面,功能验证除了细胞增殖、克隆形成和细胞周期,还可利用细胞迁移、侵袭等表型实验进行进一步的验证,分子机制也只是初步的探讨,需要更多的全转录组结合高通量测序实验以及后续的qRT-PCR,相互作用蛋白及质谱的进一步验证,使研究更具有说服力。
综上所述,TMEM106C高表达降低抑癌基因p53的磷酸化和p21的表达,从而参与P53信号通路促进肝癌细胞生长增殖和克隆形成,敲低其表达可将细胞周期阻滞在G1期。

