肝细胞癌免疫相关基因与预后:基于TCGA生物信息学分析
慕之勇, 王文生, 朱建儒, 朱光曦, 王 涛, 王 斌, 文良志, 陈东风
陆军军医大学大坪医院消化科,重庆 400042
肝癌是全球范围内第六位常见的恶性肿瘤,其导致肿瘤相关死亡人数高居第四位[1],患者5年生存率通常不足20%[2]。肝细胞癌(hepatocellular carcinoma,HCC)是肝癌的主要组织学亚型,占原发性肝癌的75%~85%[1]。早期肝癌患者接受手术或射频消融术治疗后仍有约70%在5年内复发[3]。肿瘤分期和危险分层对HCC的治疗至关重要,通过加强对HCC监测能有效降低肿瘤相关死亡率[4-5]。然而用于HCC风险分层和监测的传统临床指标仍有很多不足,不能有效指导患者个体化靶向治疗。因此临床上亟需开发更加可靠的方法来评估HCC的预后以期指导临床个体化治疗。
免疫逃逸被认为是肿瘤的特征之一[6],抗肿瘤免疫激活是肿瘤免疫治疗的基本策略[7]。几十年来,PD-1、CTLA-4抑制剂等免疫调节靶向药物在肿瘤辅助治疗中已显示出良好的治疗效果[8-9]。近年来,免疫微环境在肿瘤生物学中的作用越来越受到重视。既往研究发现,免疫细胞广泛分布于肿瘤微环境中[10]。Shi等[11]发现,肿瘤内或循环中PD-1+CD8+T细胞的数量与HCC的进展和复发呈正相关。而肿瘤血管周围白细胞浸润亦证明是HCC预后的独立危险因素[12]。而今,肿瘤免疫相关基因组异常表达在肿瘤免疫逃逸过程中的作用日趋成为肿瘤研究的新方向。异常的免疫基因组表达对非小细胞性肺癌、卵巢癌、胃癌和肾癌患者的预后具有重要影响[13-16]。然而,异常免疫基因组表达对HCC预后是否有影响及有怎样的影响尚未见报道。
本研究旨在探讨异常免疫基因组表达对HCC预后的影响及潜在的预后预测价值。同时,通过生物信息学分析探讨其潜在的调控机制及对肿瘤微环境的影响,以期为未来HCC免疫靶向治疗提供参考。
1 材料和方法
1.1 RNA序列数据的收集从TCGA(https://portal.gdc.cancer.gov/)数据库下载截至2019年9月收录的有关HCC转录组RNA-seq数据(Workflow Type:HTSeq-FPKM)并同时获取相应患者的临床资料。该数据共收录374个HCC组织和50个癌旁组织的测序信息。从ImmPort数据库中导出已被证实的2 498个免疫相关基因[17]用来比对筛选癌组织中存在差异表达的免疫相关基因,并进一步构建风险评分(riskscore)模型。
1.2 统计分析方法利用R(version3.5.2)软件进行统计分析和绘图。Wilcoxon秩和检验(FDR<0.05,log2|fold change|>2)筛选HCC癌与癌旁组织中存在表达差异的基因,而后从中筛取免疫相关基因。在总生存期(overall survival,OS)>3个月的患者中通过单因素Cox回归分析获取与OS相关的免疫基因,纳入多因素Cox回归分析筛选能独立影响预后的免疫基因,构建风险评分模型,并绘制ROC曲线,用曲线下面积(AUC)评价riskscore模型预测能力。组间差异比较用t检验分析,Pearson相关性检验分析riskscore与肿瘤微环境中免疫细胞浸润的关系,P<0.05为差异有统计学意义。
1.3 hub基因的转录调控网络构建与OS相关的免疫基因定义为hub基因。转录因子(transcription factors,TFs)可通过结合DNA中的调控序列参与基因表达调控[18]。基于Cistrome Cancer数据库[19]筛选有差异表达的TFs。通过Pearson相关性检验检测hub基因与差异表达TFs之间的关系,利用Cytoscape软件(version 3.7.2)[20]绘制潜在的调控网络。
1.4 风险评分模型的构建基于hub基因表达量乘以多因素Cox回归系数计算每例患者的riskscore,参照风险评分中位数值将患者分为高危组和低危组,基于Log-rank检验对两个亚组进行Kaplan-Meier分析,分别绘制1年、3年和5年生存预测的ROC曲线,并计算AUC值。基于TIMER数据库,通过Pearson相关检验进一步探讨riskscore与肿瘤微环境免疫细胞浸润之间的关系[21]。
2 结果
2.1 差异表达hub基因的筛选通过R“limma”包,获得2 068个基因在HCC癌与癌旁组织间存在差异表达,其中在癌组织中有1 991个基因表达上调,77个基因表达下调(见图1A和1B)。通过将2 068个差异表达基因与来自ImmPort的2 498个免疫相关基因交互比对,共筛选出116个差异表达的免疫相关基因,其中96个表达上调,20个表达下调(见图1C和1D)。
2.2 hub基因的筛选为了减少采样偏倚将OS或随访时间>3个月的患者纳入分析。基于上述筛选方法,通过单因素Cox分析获得22个hub基因(见图2A),多因素Cox分析进一步筛选出10个与预后独立相关的hub基因(见图2B)(P<0.05,HR>1)。
2.3 转录调控网络绘制将从Cistrome Cancer数据库下载的318个TFs与差异表达的2 068个基因取交集,得到31个差异表达的TFs(见图3A),其中仅有一个表达下调(见图3B)。通过Pearson相关检验进一步分析hub基因与差异表达TFs之间的关系,筛选出相关系数>0.4,P<0.01的交集组,应用Cytoscape绘制潜在的调控网络(见图4)。hub基因与TFs间均呈正向调控。
2.4 风险评分模型的评价基于风险评分模型计算出入组患者风险评分,并将患者分成高危组和低危组(见图5)。Log-rank检验对两组进行Kaplan-Meier分析,两组之间的生存预后有显著差异(见图6A,P<0.05)。AUC值评估风险评分模型预测效能(见图6B)。该风险评分模型预测患者1年生存率的AUC值为0.825,说明该模型具有良好的短期预测能力。然而,5年生存率的AUC值仅为0.692,提示该模型不能很好地预测患者长期(5年以上)生存状态。
2.5 风险评分模型的临床应用为进一步验证该模型能否独立预测HCC的预后,我们结合患者临床各项参数进行Cox回归分析(见图7)。结果显示,患者riskscore和肿瘤TNM分期均为HCC预后的独立危险因素(P<0.05)。
此外,我们还探讨了风险评分模型中hub基因的临床意义(见表1)。结果显示,风险评分在不同肿瘤分化程度及TNM分期组间差异有统计学意义(P<0.05),而与患者年龄、性别无关(P>0.05)。
最后,我们分析了患者riskscore与肿瘤微环境中免疫细胞浸润之间的关系(见图8)。结果显示:B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞、树突状细胞的浸润程度与riskscore呈正相关(P<0.05),但相关程度较弱(r<0.6)。

注:热图A、火山图B代表癌与癌旁组织差异表达基因;热图C、火山图D代表差异表达免疫相关基因; 其中表达上调与下调基因分别用红点、绿点显示。图1 癌与癌旁组织差异表达基因Fig 1 Differentially expressed genes between HCC and adjacent tissues
3 讨论
准确的预后预测和风险分层直接影响肿瘤患者治疗方案的选择。目前,HCC患者的预后和治疗方式的选择主要基于两种评估方法:巴塞罗那(BCLC)和美国癌症联合委员会(AJCC)TNM分期。然而即使分期和治疗方式相似的患者间,其预后仍存在较大的差异[22]。
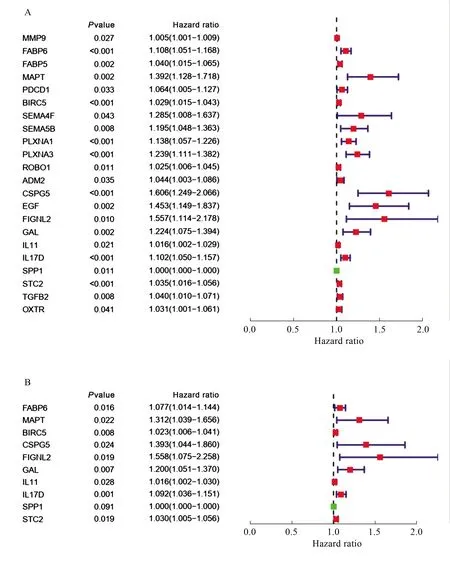
注:图A、B分别代表单因素与多因素Cox回归分析结果,其中单因素Cox回归得到22个hub基因, 多因素Cox回归筛选到10个hub基因。图2 hub基因森林图Fig 2 Forest plots of hub genes
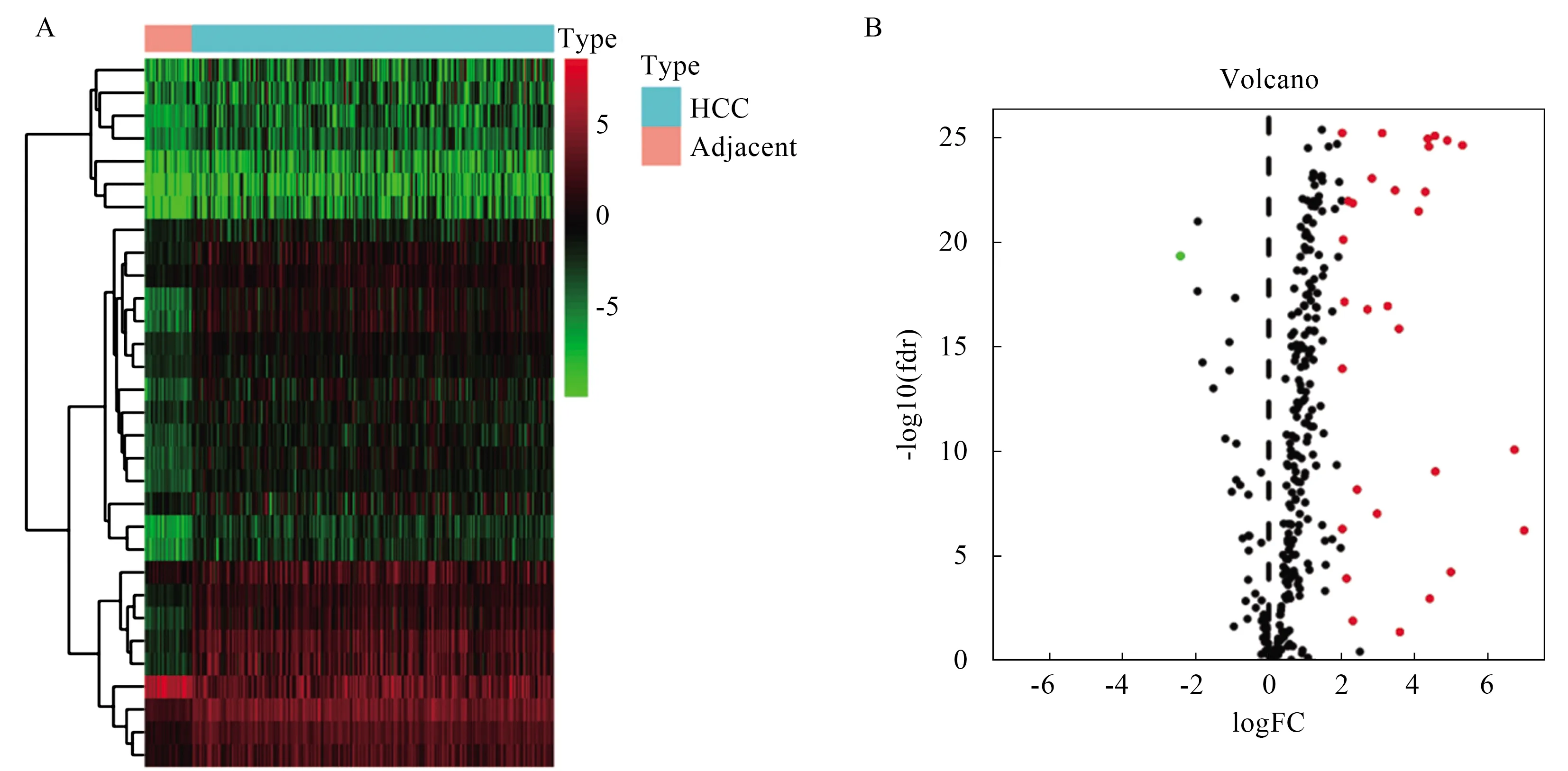
图3 差异表达的转录调控因子热图(A)、火山图(B),红点代表高表达,绿点代表低表达Fig 3 Differentially expressed TFs shown in heatmap (A), and volcano plot (B), red dots represented up-regulated TFs and the single green dot represented down-regulated
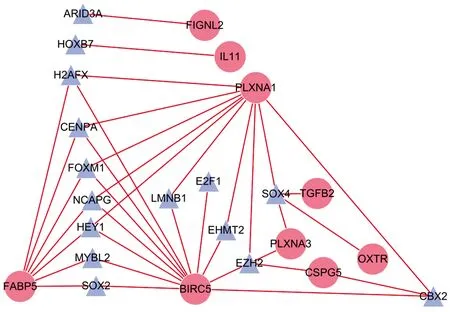
图4 TFs介导的转录调控网络,圆代表hub基因,三角代表TFs,红线表示正向调节Fig 4 TFs-mediated regulatory network. Circles represented hub genes while triangles represented TFs. The red line indicated a positive regulation
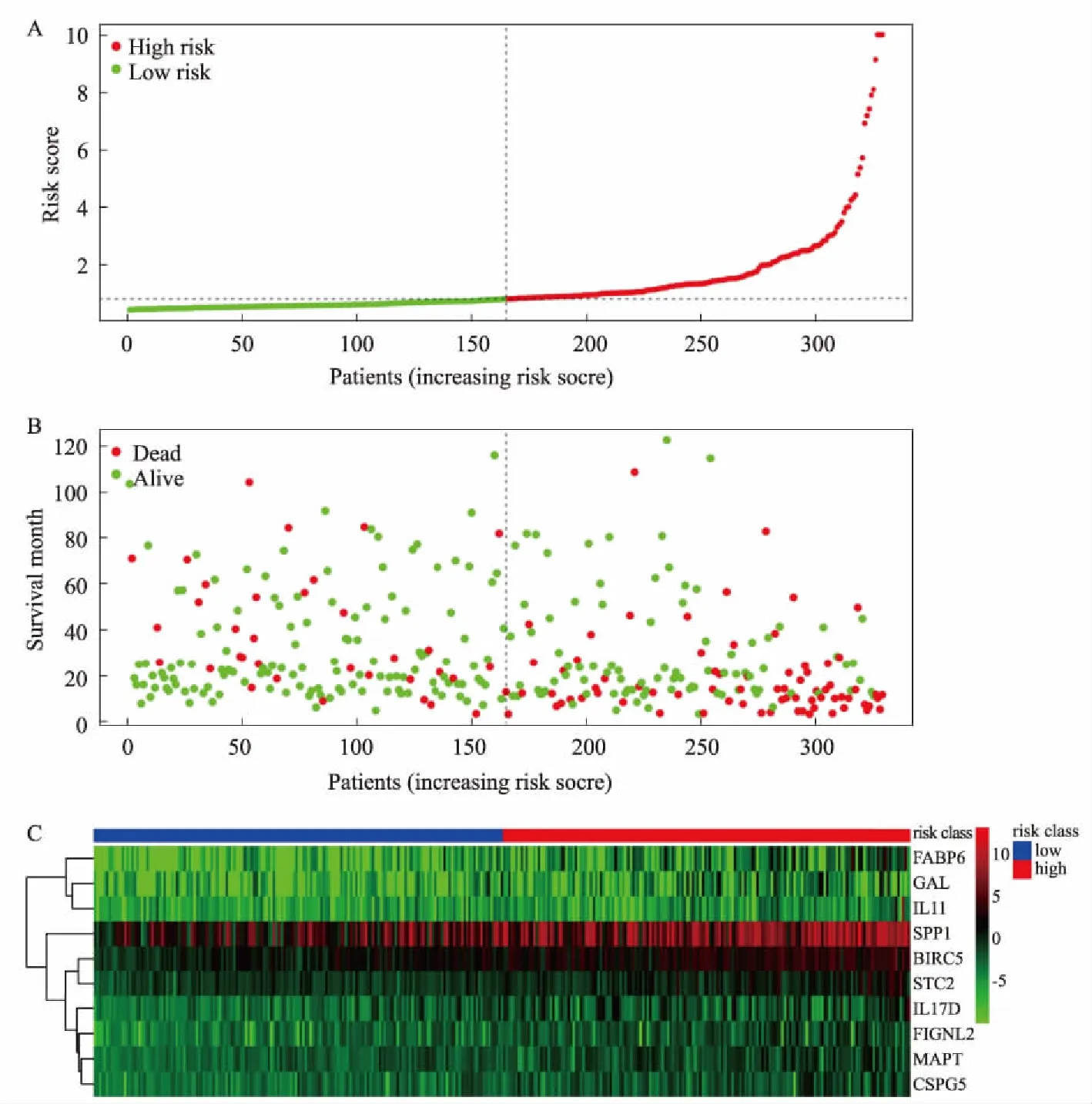
图5 风险评分模型 A:纳入患者风险评分;B:随访终点高、低风险组生存状态;C:hub基因表达与风险等级Fig 5 Development of the risk score model A: risk score of HCC patients; B: survival status of patients in two groups; C: heatmap of included 10 hub genes
越来越多的证据表明,炎症和免疫功能紊乱在HCC的发生发展中起着至关重要的作用[10]。在过去的几年里,免疫检查点抑制剂和过继细胞输注在肿瘤免疫治疗上取得了较好的疗效,有效地改善了HCC患者的预后[23]。本研究中,我们系统地探讨了HCC差异表达基因,共筛选出22个hub基因,进一步分析筛选出10个hub基因并建立了一个有效的风险评分模型作为预测预后的指标。在这些hub基因中,有些曾被证实参与HCC病情发展影响患者预后,也有些未曾见报道。FABP5、BIRC5和PLXNA1在所构建的调控网络中占主导位置,这可能预示着它们在HCC发生发展中具有更重要的作用。既往研究发现,八聚体结合转录因子4(OCT4)通过cyclin D1(CCND1)增强BIRC5的表达,而BIRC5的异常高表达与肿瘤的恶性生物学行为密切相关。BIRC5的高表达能够促进癌细胞增殖、抑制癌细胞凋亡、诱导肿瘤间质血管生成、降低癌细胞对放化疗的敏感性,最终影响HCC患者的预后。尽管BIRC5调控的具体分子机制尚不清楚,可能与p53蛋白有关,但鉴于BIRC5在HCC发生发展进程中的重要作用,BIRC5有望成为HCC治疗的靶点[24]。斯钙素-2(STC2)参与细胞分裂过程中G1期到S期过渡的调节,能够促进直肠癌和肝癌细胞的增殖和转移,与患者不良预后密切相关[25-27]。STC2在HCC组织中上调,与肿瘤大小和HCC的多样性相关,这可能与STC2参与调节MAPK信号通路有关。MAPT参与胃癌对紫杉醇的化疗抵抗,与乳腺癌和前列腺癌不良预后相关[28-30]。而本研究中发现MAPT的高表达与HCC患者OS的降低密切相关,这在以往的研究中尚未见报道,因此MAPT影响HCC不良预后的分子机制值得深入研究。此外,FIGNL2、CSPG5和GAL对HCC预后的影响亦未见报道,而本研究中显示,它们是HCC预后影响最大的三个免疫基因,同样这些免疫相关基因在HCC发生发展中的具体分子机制也值得深入研究。在本研究中,我们还着重探讨了风险评分与肿瘤微环境之间的关系,以揭示其潜在的临床意义。结果发现,风险评分可部分反映包括B细胞、CD4细胞、CD8细胞、中性粒细胞、巨噬细胞和树突状细胞在内的免疫细胞的浸润状态。即风险评分越高,免疫细胞的浸润丰度越高,提示免疫基因的异常表达越高,肿瘤免疫微环境越紊乱,进而参与HCC的发生发展及侵袭转移的进程。
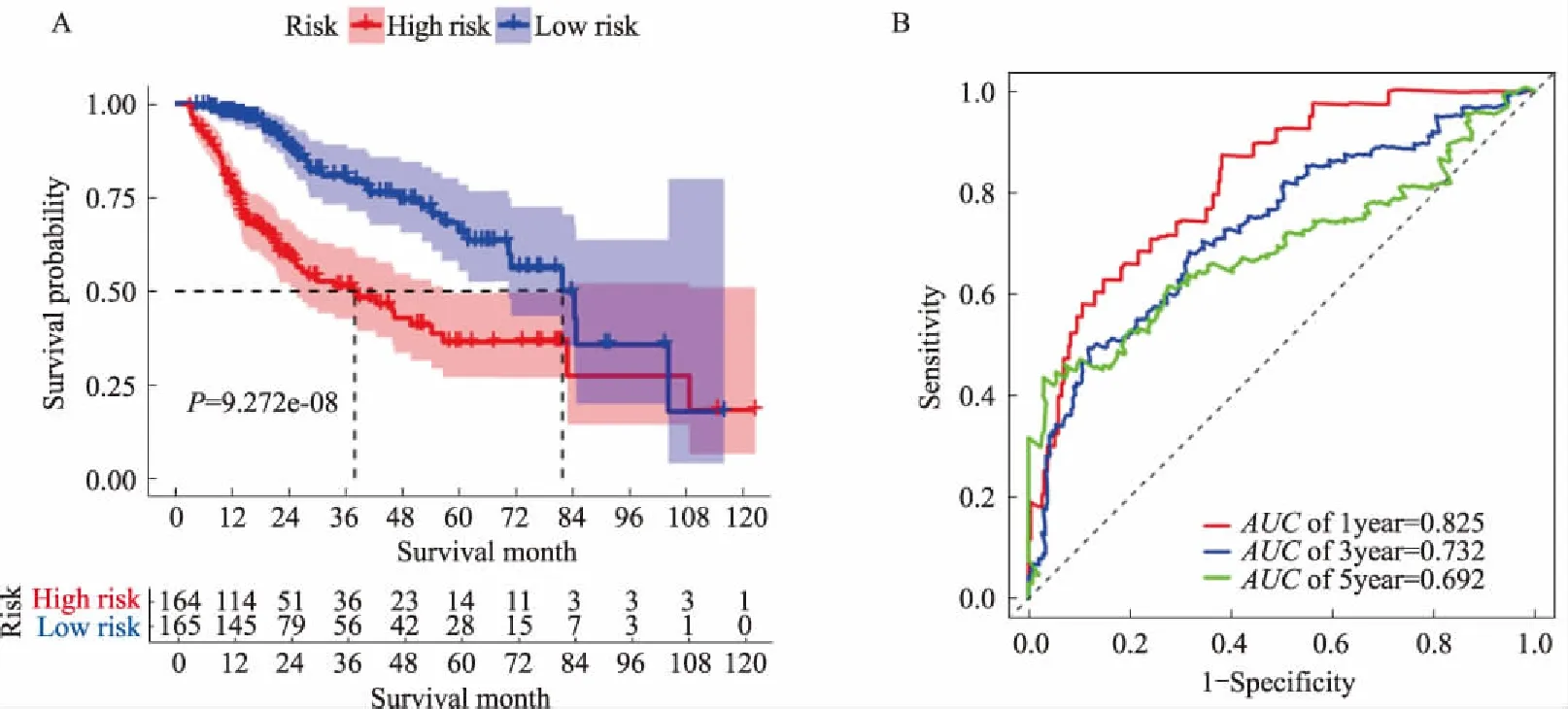
图6 风险评分模型预后预测价值 A:高、低风险组患者生存曲线;B:1/3/5年生存预测的ROC曲线Fig 6 Prognostic value of the riskscore model A: the survival curves of patients in two groups; B: survival-associated ROC
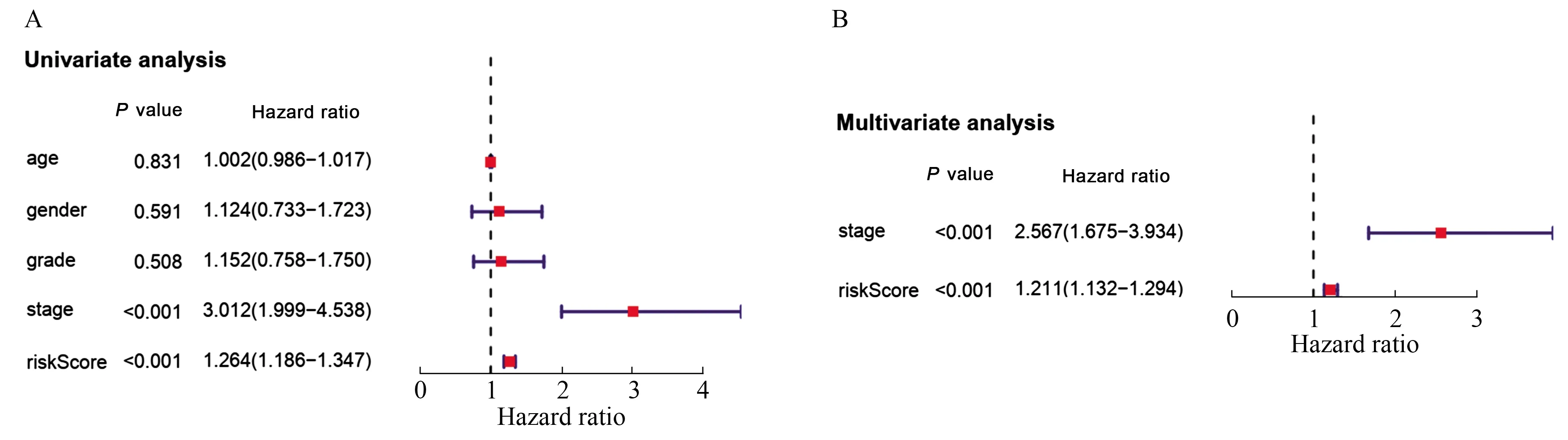
图7 患者临床参数Cox回归的森林图Fig 7 Forest plots for Cox regression analysis of clinical parameters

图8 风险评分与肿瘤微环境免疫细胞浸润Fig 8 Correlation between the risk score and infiltration abundances of immune cell
表1 hub基因及风险评分与患者临床参数间的关系
Tab 1 Relationship between the model included hub genes and the clinical parameters
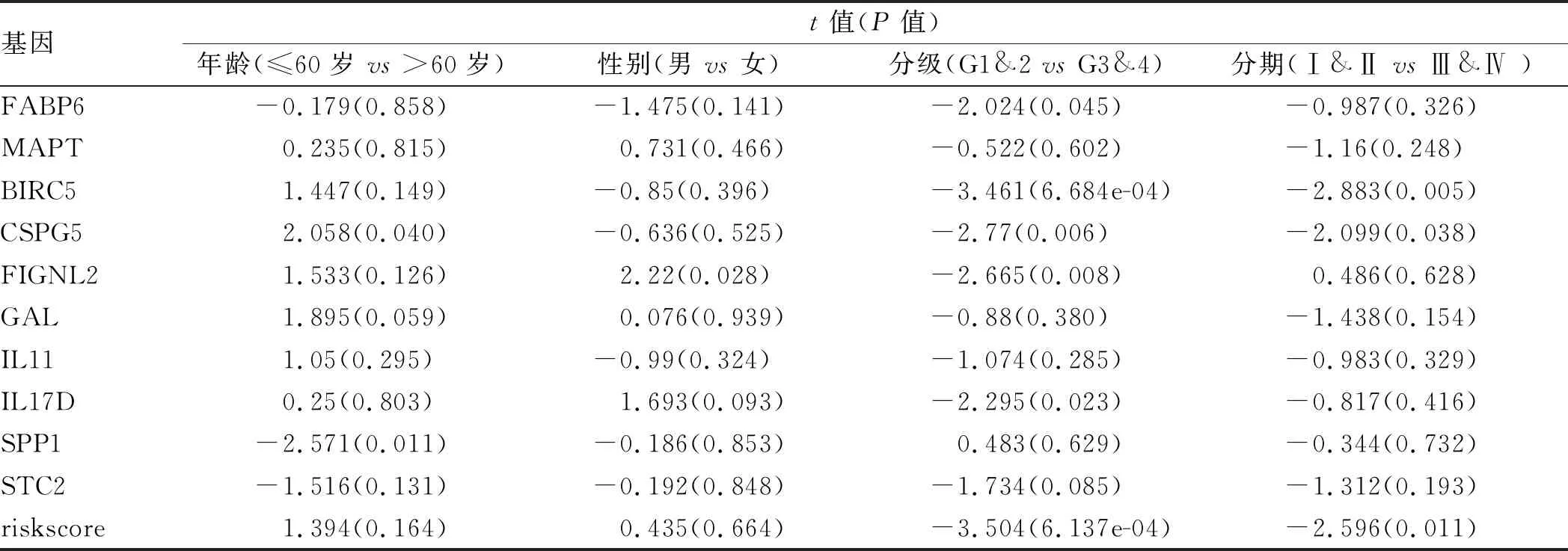
基因t值(P值)年龄(≤60岁 vs >60岁)性别(男 vs 女)分级(G1&2 vs G3&4)分期(Ⅰ&Ⅱ vs Ⅲ&Ⅳ )FABP6-0.179(0.858)-1.475(0.141)-2.024(0.045)-0.987(0.326)MAPT0.235(0.815)0.731(0.466)-0.522(0.602)-1.16(0.248)BIRC51.447(0.149)-0.85(0.396)-3.461(6.684e-04)-2.883(0.005)CSPG52.058(0.040)-0.636(0.525)-2.77(0.006)-2.099(0.038)FIGNL21.533(0.126)2.22(0.028)-2.665(0.008)0.486(0.628)GAL1.895(0.059)0.076(0.939)-0.88(0.380)-1.438(0.154)IL111.05(0.295)-0.99(0.324)-1.074(0.285)-0.983(0.329)IL17D0.25(0.803)1.693(0.093)-2.295(0.023)-0.817(0.416)SPP1-2.571(0.011)-0.186(0.853)0.483(0.629)-0.344(0.732)STC2-1.516(0.131)-0.192(0.848)-1.734(0.085)-1.312(0.193)riskscore1.394(0.164)0.435(0.664)-3.504(6.137e-04)-2.596(0.011)
综上,基于TCGA数据库,我们分析了HCC患者的免疫特征,随后建立了一个预后预测模型。异常表达的免疫相关基因可能通过招募免疫细胞浸润来改变肿瘤微环境,从而影响患者的临床预后。风险评分模型中的hub基因可能为我们探索HCC免疫治疗的靶点提供新的思路。然而hub基因作用的分子机制和相关信号传导通路及免疫细胞在HCC中的作用尚不清楚,这需要进一步研究探索。

