青杄转录因子PwHAP5及其同源蛋白AtHAP5下游靶基因的鉴定1)
苗雅慧 游韩莉 郜银涛 张凌云
(森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
HAP(histone or heme-associated protein)也叫做NF-Y(nuclear factor-Y),是由3个亚基聚合而成的一类转录因子,包括NF-YA(HAP2)、NF-YB(HAP3)、NF-YC(HAP5)。这3个亚基可以形成异源三聚体,与CCAAT特异结合,共同参与下游靶基因启动子DNA的结合与调控[1]。研究发现,HAP家族参与了叶绿体的生物发生、脂肪酸生物合成、花期、胚胎形成以及非生物胁迫过程等过程[2-7],这其中大多基于HAP家族单个亚基进行功能探索。例如,大豆(Glycinemax)NF-YC2基因和小麦(TriticumaestivumL.)NF-YC3/5/8/9的表达受光调控,且GmNF-YC2在开花调节中起重要作用[8-9];在拟南芥中过表达NF-YB2可以加速细胞分裂,促进主根的伸长[10];杨树(Populusdeltoides)PdNF-YB7能被渗透胁迫与ABA诱导,参与了植物对干旱的响应[11]。HAP家族调控的下游靶基因也陆续鉴定出来,例如拟南芥(Arabidopsisthaliana)AtHAP5A可以通过与AtXTH21启动子上CCAAT顺式作用元件结合,调控植株对冷胁迫的响应[12]。
青杄(Piceawilsonii)是松科(Pinaceae)云杉属常绿针叶树种,又名华北云杉,为中国特有树种,且被多个地区列为水源涵养林及用材林的主要造林和更新树种[13-14]。本课题组前期在Ca2+诱导的青杄花粉cDNA文库中筛选得到基因PwHAP5,发现其与PwFKBP12互作参与花粉管的导向调节[15]。另外PwHAP5能够响应干旱、盐渍等非生物逆境胁迫[16],但其调控机制尚不清楚。
我们对青杄PwHAP5基因和拟南芥AtHAP5基因编码的氨基酸序列进行同源性比较分析,发现PwHAP5氨基酸序列与AtHAP5氨基酸序列的关键结构域保守[15]。对AtHAP5的候选靶基因进行预测,A37、HSFA2很可能是AtHAP5的靶基因。A37又被称为PDX1.2,编码一个具有磷酸吡哆醛合成酶活性的蛋白质,参与了植物对高温胁迫的响应过程[17-18]。在热胁迫下,HSFA2属于最强烈诱导的蛋白,在热激胁迫调控网络中发挥了关键的作用[19]。本研究在课题组前期研究基础上,通过酵母单杂交、EMSA、双荧光素酶等实验探究PwHAP5和AtHAP5对A37、HSFA2的调控作用,旨在丰富并进一步阐明HAP5转录因子的调控网络。
1 材料与方法
以实验室保存的哥伦比亚野生型拟南芥,athap5(At1g56170)突变体,AtHAP5同源过表达和PwHAP5(ACS31831.1)异源过表达种子为实验材料,将各株系拟南芥种子用5%次氯酸钠处理后播种于MS培养基中,黑暗4 ℃春化3 d后置于22 ℃、16 h光周期的光照培养箱中培养。
pEASY-T1载体、Trans1-T1大肠杆菌(Escherichiacoli)感受态、BL21(DE3)感受态在北京全式金科技公司购买。酵母(Saccharomycescerevisiae)、农杆菌(Agrobacteriumtumefaciens)GV3101感受态购自上海唯地生物科技有限公司。EMSA所用到的生物素标记探针、DNA链或者突变探针均在上海英潍捷基公司合成。pGBKT7、pGADT7、pGADT7-p53、pHis2、pHis2-p53、pAbAi、pAbAi-p53、pCAM1205、pGBKT7-ANAC092以及单荧光素酶实验载体1300-LUC由本实验室保存。pGreenII 0800-LUC、pGreenII 62-SK、pSoup-p19载体由清华大学谢道昕教授惠赠。
转录激活活性分析的步骤参照文献[20],简要如下:将PwHAP5全长、AtHAP5全长以及PwHAP5的N端(1-101)和C端(102-201)分别构建到pGBKT7载体上,引物见表1。将构建好的载体转化入酵母中,通过在含有10 mmol·L-13-AT的SD/-Trp-His-Ade缺陷型酵母培养基上的生长情况判定转录激活活性,以pGBKT7-ANAC092为阳性对照[21]。
pHIS2体系酵母单杂交的试验方法参照上海唯地生物科技有限公司说明书。将浓度相同的pHIS2质粒和pGADT7质粒分别取10 μL和5 μL共转入Y187酵母感受态细胞,在SD/-Trp-Leu酵母缺陷培养基中生长。长出菌落后,在超净工作台中将长出的菌落用无菌蒸馏水重悬,并将OD600值调整为0.2,吸取5 μL滴在含有筛选出的3-AT浓度的SD/-Trp-Leu-His的三缺培养基中倒置培养观察生长情况。
将HSFA2和A37的启动子全长以及只含有CCAAT box的启动子片段构建到pAbAi载体上。用限制性内切酶BstBI酶切线性化pAbAi-HSFA2/A37载体。回收酶切产物,将其转入Y1HGold,用SD/-Ura培养基进行筛选。将阳性菌落制备成酵母感受态,将各pGADT7质粒分别转入所制备的含有线性化pAbAi-HSFA2/A37载体的Y1HGold感受态中,并于SD/-Ura-Leu二缺酵母培养板上生长。将长出的菌落进行菌落PCR,将阳性菌落稀释,滴在SD/-Ura-Leu+AbA的酵母培养基中生长并进行观察记录。
蛋白的诱导纯化参照文献[22]。将AtHAP5构建到pET-32a载体上,在BL21菌株中表达。通过筛选不同IPTG浓度、诱导温度、诱导时间,发现最佳诱导条件为IPTG浓度为1 mM,诱导温度25 ℃,最佳诱导时间为7 h。筛选出最佳诱导条件后,进行大量诱导和转化。利用上海碧云天生化科技有限公司的His标签蛋白纯化试剂盒进行蛋白诱导与纯化,与His标签蛋白融合表达,进行Western blot验证。EMSA实验参考上海碧云天生化科技有限公司的EMSA试剂盒说明书。
单荧光素酶试验方法参考文献[22]。将pCM1205-AtHAP5和1300-LUC-HSFA2/A37质粒分别转入农杆菌菌株GV3101。将等体积的pCM1205-AtHAP5的1300-LUC-HSFA2/A37农杆菌混合后注射到一个月大的烟草叶片中,培养48 h后在荧光成像系统(Andor iXon)中进行观察和拍照。
双荧光素酶实验方法参照文献[23]、[24]。将pGreenII0800-LUC-HSFA2/A37(p0800-HSFA2/A37)和pGreenII 62-SK-AtHAP5 (p62-AtHAP55)的各组合分别共转入含有pSoup-p19质粒的农杆菌中,并进行烟草叶片注射。利用Promega化学发光检测仪,进行LUC和RLUC的检测。实验设置3次重复。
利用北京艾德莱生物技术有限公司的RNA提取试剂盒提取植株的总RNA,并通过oligo(dT)法将总RNA反转录为cDNA[25]。利用所设计的RT引物(表1)进行RT-qPCR,以拟南芥ACTIN2/8基因作为内参基因。试验分别设置2次生物学重复,3次技术重复。

表1 所用引物序列
2 结果与分析
2.1 转录激活活性分析
图1显示,转化空载体pBD、pBD-PwHAP5以及pBD-AtHAP5的酵母不能在SD/-Trp-His-Ade+10 mmol·L-13-AT缺陷型培养基中正常生长,而转化阳性对照pBD-ANAC092的酵母可以在SD/-Trp-His-Ade+10 mmol·L-13-AT缺陷型培养基中正常生长,且可以使X-α-gal变蓝,表明PwHAP5以及AtHAP5全长没有转录激活活性。此外将PwHAP5分为N端和C端两段,发现PwHAP5的N端和C端均无转录激活活性。
空载体pBD和pBD-ANAC092分别作为阴性和阳性对照,图中蛋白后面的数字指示片段的位置。
图1转录激活活性分析
2.2 酵母单杂交试验
2.2.1 pHis2体系酵母单杂交
在前期试验中,我们发现当3-AT浓度高达300 mmol·L-1时,才能消除组氨酸的背景表达。因此,后续实验使用的3-AT浓度为300 mmol·L-1。在含有300 mmol·L-13-AT的SD/-Trp-Leu-His三缺培养基中,除了转入的阳性对照质粒pHIS2-p53+pAD-p53的酵母菌株可以生长,而其他实验组都没有长出菌落(图2)。由此说明,在酵母pHIS2体系中,AtHAP5与PwHAP5均不能与HSFA2、A37启动子结合。
2.2.2 pAbAi体系酵母单杂交
为了进一步确认pHIS2体系酵母单杂交的结果,又通过pAbAi体系进行了酵母单杂交。首先对pAbAi体系中pAbAi-HSFA2/A37的金担子素(AbA)的背景表达进行了测试,如图3A。当AbA浓度为500 ng·mL-1时,已经能抑制阳性对照pAbAi-P53pro的生长,然而即使加大AbA的浓度到1 000 ng·mL-1时仍然抑制不住pAbAi-A37pro、pAbAi-HSFA2pro的AbA背景表达。由此可见,A37、HSFA2的启动子极有可能被Y1HGold酵母内源转录因子识别,或其启动子本身存在激活活性,因此启动子的全长不能用于酵母单杂交的筛选试验。
图2转化酵母在含有300mmol·L-13-AT的SD/-Trp-Leu-His三缺培养基中生长情况
由于在pAbAi体系中,A37与HSFA2的启动子全长不能直接用于酵母单杂交实验,因此将A37与HSFA2的启动子上含有CCAAT box作用元件的序列片段克隆出来,重新构建到pAbAi载体上,进行实验。金担子素背景检测结果表明,当金担子素浓度为300 ng·mL-1时,对照组和实验组的背景表达均被消除了,因此确定金担子素的实验浓度为300 ng·mL-1。酵母单杂交结果发现,只有阳性对照能在含有300 ng·mL-1的二缺培养基上生长,阴性对照和实验组没有明显菌落出现(图3B)。由此可见,AtHAP5和PwHAP5不能与所克隆的HSFA2、A37启动子上含有CCAAT box的顺式作用元件区域结合。
2.3 原核蛋白诱导纯化与EMSA试验
采用碧云天生物科技有限公司的His标签蛋白纯化试剂盒进行蛋白的诱导与纯化,得到目的蛋白(图4A、B)。在EMSA试验中,设置了5个组,分别为阴性对照(加入探针为CCAAT box突变探针)、样品反应组(加入探针为生物素标记探针)、探针冷竞争(既有标记探针,又有未标记探针)、突变探针冷竞争(既有标记探针,又有未标记的突变探针)、Super-shift反应(加入His标签蛋白抗体)。结果发现,各反应组中全为自由探针,均未发现滞后条带。(图4C、D)。
通过EMSA、酵母单杂交实验可知,AtHAP5和PwHAP5不能与所克隆的HSFA2、A37启动子上含有CCAAT box顺式作用元件区域直接结合。
2.4 荧光素酶试验
单荧光素酶试验中,对照组空1205+A37、空1205+空1300、1205-AtHAP5+空1300及实验组1205-AtHAP5+A37的荧光强度没有明显差别。然而,在实验组1205-AtHAP5+HSFA2中荧光强度明显减弱(图5)。此外,利用靶基因启动子后连接的荧光素酶基因(LUC)与双荧光素酶系统中稳定表达的海肾荧光素酶基因(RLUC)荧光信号强度的比值,进行定量分析,如表2所示。在实验组p62SK-AtHAP5+HSFA2中,LUC/RLUC的比值显著低于对照组(空p62+HSFA2),而在实验组p62SK-AtHAP5+A37中,LUC/RLUC的比值与对照组(空p62+A37)没有显著差别。因此,AtHAP5对A37表达无影响,但对HSFA2的表达具有负调控作用。

表2 双荧光素酶LUC/RLUC荧光强度比值
注:对照组为空pGreenII 62-SK+pGreenII 0800-X-LUC,X为靶基因启动子;同列数据后*表示差异显著(p<0.05)。
2.5 基因水平验证调控作用
2.5.1 AtHAP5各株系中AtHAP5、HSFA2、A37的表达
为进一步验证荧光素酶试验的结果,通过RT-qPCR试验对不同AtHAP5株系中HSFA2、A37的表达量进行了研究。研究结果发现,当AtHAP5过量表达时,HSFA2的表达量受到显著的抑制作用。在athap5突变体中,AtHAP5和HSFA2的表达量与野生型(CW)植株相比轻微下降,而A37的表达并无显著变化(表3)。
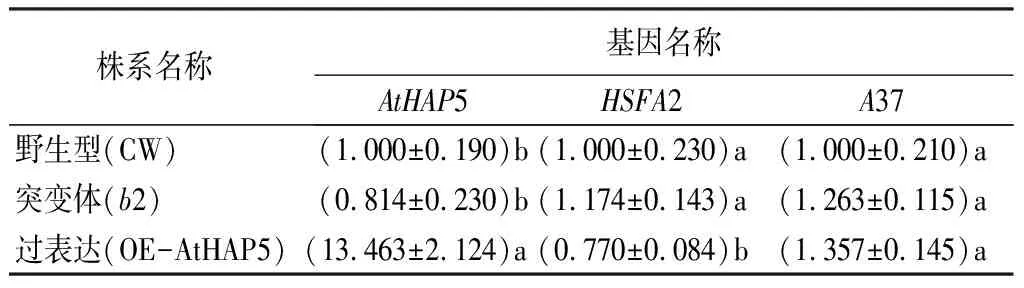
表3 AtHAP5各株系AtHAP5、HSFA2、A37的相对表达量
注:表中数据为平均值±标准差;同列不同字母表示差异显著(p<0.05)。
2.5.2PwHAP5各株系中PwHAP5、HSFA2、A37的表达
通过RT-qPCR试验分别分析在野生型与PwHAP5异源过表达株系中PwHAP5、HSFA2、A37的表达量。研究结果表明,在过表达PwHAP5株系中HSFA2、A37的表达量没有显著变化(表4)。
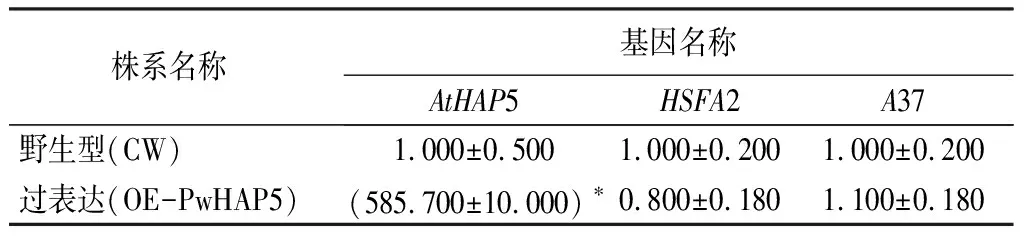
表4 PwHAP5过表达株系PwHAP5、HSFA2、A37的相对表达量
注:表中数据为平均值±标准差;*表示差异显著(p<0.05);CW代表野生型。
3 讨论
根据转录因子的调控方式的不同可以将其分为转录抑制子和转录激活子[26]。在本研究中,通过转录激活活性分析发现,PwHPA5和AtHAP5全长没有转录激活活性,且PwHAP5的N端和C端均无转录激活活性(图1)。Hao et al.[27]在研究NAC转录因子的激活活性时发现,大豆NAC转录因子GmNAC20的C端具备转录激活活性,而全长不具备转录激活活性,因为其蛋白N端存在一个NARD抑制结构域,该结构域抑制了C端的转录激活活性。因此,我们推测PwHPA5和AtHAP5可能作为转录抑制子发挥作用,或需与NF-Y家族的其他亚基结合,发挥激活功能[28-31]。
植物HAP复合体已经被广泛地证明在酵母与植物中能与CCAAT box结合。例如,Shi et al.[12]在探究AtHAP5A下游靶基因及其功能时发现,AtHAP5A作为转录因子能够直接通过与CCAAT结合调控AtXTH21的表达,并参与了冷胁迫抗性调控过程。我们的研究结果显示AtHAP5对HSFA2的表达具有抑制作用,显示HSFA2可以作为AtHAP5的下游靶基因,受AtHAP5负调控发挥作用。然而,EMSA和酵母单杂交试验发现AtHAP5不能直接作用于HSFA2的启动子,说明AtHAP5作为HSFA2的上游调控因子,并不是直接与HSFA2的启动子结合,其调控过程需要其他亚基或蛋白的参与。之前多数的研究表明,NF-Y亚基发挥转录调控作用并不是独立的。NF-YB和NF-YC首先在细胞质中形成二聚体,然后一起转移到细胞核中与NF-YA形成三聚体发挥调控作用[28-31]。此外,NF-YC亚基也可以通过与其他非NF-Y家族转录因子如AB15发生相互作用发挥调控作用[32]。HIKARU et al.[31]发现,DPB3-1(NF-YC10)能够与NF-YA以及NF-YB亚基形成三聚体,这个三聚体又可以与DREB2A相互作用,增强DREB2A对下游靶基因HSFA3的表达调控作用,进而调控下游热胁迫响应基因的表达。拟南芥bZIP28可以与NF-YB3/NF-YC2/NF-YA4形成复合体调节内质网应激响应[30],NF-YC2/LEC1/BbZIP67参与种子萌发,可以激活ABA响应元件[33],CONSTANS(CO/B-BOX PROTEIN1 BBX1)蛋白能够与NF-YB2/NF-YC3形成复合体,与FLOWERINGLOCUST启动子上CORE元件结合,调控花期[34]。因此我们推测,AtHAP5对于HSFA2的调控作用可能是需要NF-Y家族其他亚基或其他转录因子协同完成。
Park et al.[35]研究发现,拟南芥中的NF-YA亚基可以与酵母中的NF-YB、NF-YC亚基形成三聚体,与CCAAT顺式作用元件结合,说明不同物种NF-Y家族转录因子结构具有相似的生化特性,也暗示其在生物体中的功能保守。利用同源基因之间的相似性,有利于基因调控机制的探索与比较,Yu et al.[15]通过多序列对比发现,PwHAP5氨基酸序列与AtHAP5氨基酸序列的关键结构域保守,相似性达52.09%,因此推测它们在功能上也具有保守性。Liu et al.[36]发现盐芥(Eutremasalsugineum)EsNAC1异源株系显示出与拟南芥同源基因RD26过表达株系不同的表型,且异源株系通过调控不同靶基因的表达来增强植株的非生物胁迫性。在本研究中AtHAP5对HSFA2的在体内表达具有抑制作用,而PwHAP5对HSFA2的表达没有显著影响。由此推测PwHAP5在进化上与AtHAP5功能及作用存在差异。
4 结论
青杄PwHAP5与其同源基因拟南芥AtHAP5全长以及PwHAP5的N端与C端均没有转录激活活性,PwHAP5与AtHAP5不能直接作用于HSFA2和A37的启动子。AtHAP5对HSFA2的在体内表达具有抑制作用,可能负调控AtHSFA2表达。PwHAP5对HSFA2的表达没有显著影响,
显示其在进化上与AtHAP5功能及作用存在差异。

