吉西他滨化疗方案的疗效以及不良反应分析
徐小龙,周 越,潘守杰,倪善红*
(1.南京中医药大学连云港附属医院,连云港市中医院,江苏 连云港 222000;2.南京医科大学康达学院,江苏 连云港 222000)
吉西他滨(gemcitabine)为二氟核苷类抗癌药,已广泛应用于多种实体瘤包括胰腺癌、非小细胞肺癌、乳腺癌和卵巢癌等的治疗。作为前体药物,吉西他滨进入细胞后在酶的作用下转化成药效活性成分,通过抑制DNA合成起到杀伤肿瘤细胞作用[1]。吉西他滨通过核苷酸转运体被细胞摄取后,于胞浆内被脱氧胞苷激酶(deoxycytidine kinase,DCK)[2]磷酸化为双氟脱氧胞苷一磷酸,继续活化为双氟脱氧胞苷二磷酸及双氟脱氧胞普三磷酸。本文分析2014—2017年度在我院肿瘤科化疗病人中使用以吉西他滨为主的化疗方案的疗效以及药品不良反应。
1 资料来源与研究方法
从HIS系统筛选出2014年01月—2017年12月期间于连云港市中医院肿瘤科住院化疗病人中使用以吉西他滨为主的89例次的疗效以及药品不良反应,对数据进行汇总、并分析其发生规律。
2 结 果
2.1 接受吉西他滨化疗的病种及疗效的概况
30例接受吉西他滨化疗的患者,其中有效的有10人,稳定的3人,无效的4人,还有13人因为化疗1次或者2次后未继续化疗而无法评价。见表1。
2.2 患者发生不良反应次数
30名患者共接受吉西他滨化疗的有89例次,其中未发生不良反应的次数统计,以接受一次或者两次吉西他滨化疗的患者人数最多,而接受8次吉西他滨化疗的2名患者均有未发生不良反应的情况。见表2。
2.3 吉西他滨引起ADRs损害的器官/系统及临床表现
回顾76例ADRs的各器官/系统及临床表现,进行归类分析。如表3所示,以浑身乏力在ADRs中最 常见,以骨髓抑制最为严重。

表1 接受吉西他滨化疗的病种及疗效
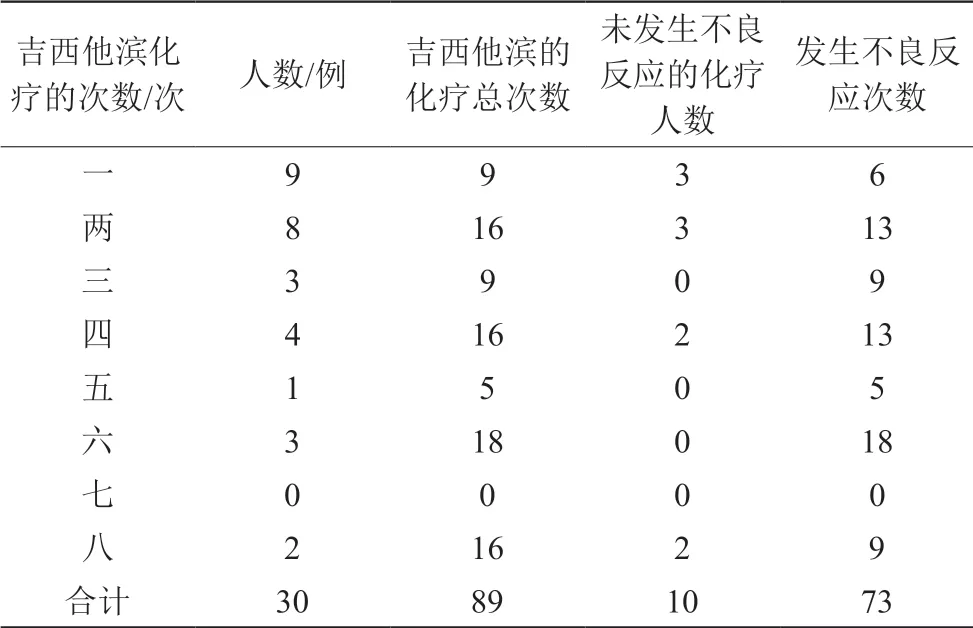
表2 未发生ADRs患者的化疗次数分布
3 讨 论
3.1 吉西他滨化疗的病种及疗效
通过HIS信息系统,查阅2014—2017年度的全部病例,共收集到30名患者选用的吉西他滨包括正大天晴和豪森制药公司的产品,说明书中盐酸吉西他滨适用于治疗错过手术期的晚期或转移性胰腺癌及治疗局部进展性或转移性非小细胞肺癌,治疗中、晚期非小细胞肺癌、胰腺癌、膀胱癌、乳腺癌及其他实体肿瘤。30例患者中胰腺癌8例,乳腺癌及手术后辅助化疗6例,肺癌及手术后辅助化疗7例,食管癌2例,胃癌1例,实体肿瘤6例,均无超说明书用药。在30例患者中有效率为33.3%,有效率偏低,可能由于我院是中医院,在肿瘤初期治疗时,病人选择西医综合医院,由于其他原因选择我院,错过最佳治疗时间,使得有效率偏低。
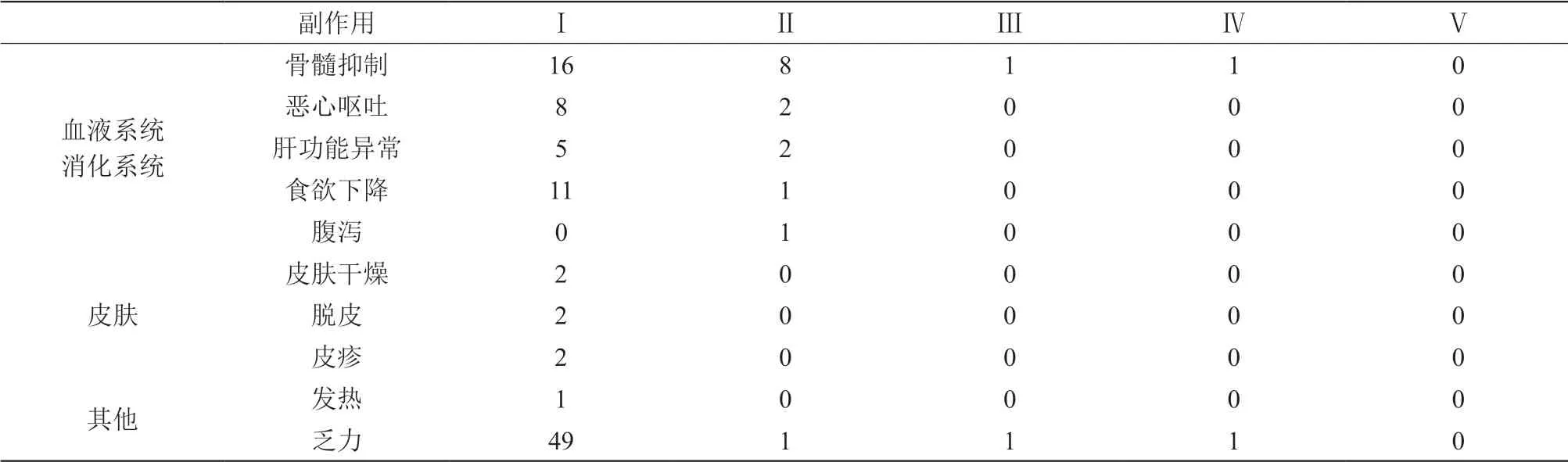
表389例吉西他滨化疗方案的毒副作用
3.2 患者发生不良反应次数
抗肿瘤药物一般是剂量限制性毒性药品,对正常细胞也有伤害,要保证化疗的正常进行,既要保证最大治疗效果又要尽可能减少不良反应,使得患者耐受。病人进行多周期化疗后,往往身体免疫力降低,不良反应发生率增加[3]。30例患者中,有9例患者仅接受吉西他滨化疗为1次,9例中有3例未发生不良反应。有2例患者化疗次数多达8次,两名患者均有未发生不良反应的情况,可能研究的病例数太少。
3.3 ADRs损害的器官/系统及临床表现
回顾76例ADRs的各器官/系统及临床表现,进行归类分析。如表3所示,以浑身乏力在ADRs中最常见,以骨髓抑制最为严重。76例吉西他滨所致的不良反应报告中,以周身乏力最为常见,发生率为65.8%;另外吉西他滨骨髓抑制共26例,占34.2%,这一结果与已知吉西他滨的不良反应的发生率相一致,也与多数研究者提出骨髓抑制是吉西他滨剂量相关毒性的说法相一致[4]。
吉西他滨引起的骨髓抑制主要表现为白细胞降低、血小板减少及贫血。一般在用药后8~10 d开始下降,第14 d降至最低点[5]。应依据骨髓毒性的程度相应调整吉西他滨的剂量,一般可减少吉西他滨的剂量。当出现有严重骨髓抑制时,我院采取考虑使用人粒细胞集落刺激因子(rhG-CSF),而30名患者中有1例Ⅲ和1例Ⅳ度骨髓移植的患者,经过干预,得到很好的疗效及耐受。
吉西他滨作为低致吐风险的药物,而且在化疗前均接受止吐的治疗,而在76例不良反应中也存在10例次的发生率,可能存在患者不耐受或者因为化疗次数多而存在往往身体免疫力降低,使得副作用增加。
通过回顾了4年吉西他滨的临床应用,尽管连云港中医院肿瘤科具有丰富的肿癌治疗经验以及毒副作用处理经验,但是在实践中发现在我院住院治疗的患者中存在相同病理分型及临床分期的患者对依据体表面积计算给药剂量的化疗方案的敏感性差异很大,其疗效及不良反应均显示了明显个体差异。随着基因组学研究的发展,也为研究吉西他滨代谢酶的基因多态性与化疗敏感性提供了条件,文献[6-9]报道药物代谢酶基因的单核苷酸多态性(single nucleotide polymorphism,SNPs)是影响患者对化疗药物敏感性不同的重要因素。
综上所述,查阅3年的病例,发现年吉西他滨的疗效以及不良反应不仅跟患者自身状况、接受化疗次数以及性别和年龄有关,更受不同代谢酶基因型对吉西他滨不良反应的影响,了解吉西他滨敏感性基因有助于节省医疗资源,降低医疗成本,具有较强的临床价值和社会意义。

