以电针对照观察针刀干预对膝骨关节炎兔股直肌的修复作用*
陈烯琳,孙学燕,马诗凝,张 伟,付昕怡,谢汶姗,郭长青△
(1.北京中医药大学,北京 100029; 2.中国中医科学院中药研究所,北京 100700)
膝骨关节炎(Knee osteoarthritis,KOA)是膝关节的一种退行性病变[1],高发于中老年人。KOA的发病机制尚未完全清楚,Felson[2]指出膝周组织不平衡所致的生物力学改变是发病的重要因素。而膝周组织不仅包括半月板、韧带,还包括强壮的伸屈肌。Qiestad BE等[3]进一步提出KOA与膝关节伸肌萎缩密切相关,健康的肌力对膝关节稳定至关重要[4]。针对这种存在股直肌萎缩的KOA,本团队前期研究证实了针刀干预可以抑制股直肌凋亡,并促进股直肌修复[5]。其深入的修复机制是什么?Akt/mTOR通路具有调控多种细胞的代谢、增殖和生长作用[6],并且可有效调控萎缩的骨骼肌[7]。故本研究通过Westernblot观察Akt(又叫PKB,protein kinase B,蛋白激酶)/mTOR(mammalian target of rapamycin,哺乳动物雷帕霉素靶蛋白)通路及其下游p70s6k(p70 Ribosomal protein S6 kinase,p70核糖体蛋白S6激酶)的蛋白表达变化,进一步探究针刀对退行性KOA的修复机制。
1 材料与方法
1.1 动物
36只6月龄雄兔,体质量(3.20±0.2)kg,购买自北京科宇动物养殖中心(动物批号:SYXK京2016-0013,SPF级新西兰大白兔,质量合格证号:DH201601958),本实验于中国中医科学院中药研究所完成,恒温20~22℃,相对湿度40%~60%。
1.2 主要仪器与试剂
1.2.1 仪器 微型旋涡混合仪(VORTEX GENIN,美国SCIENTIFIC INDUSTRIES公司);手掌型离心机(LX-100,中国Haimen Kylin-Bell实验仪器公司);蛋白质电泳系统及转膜系统(美国 BIO-RAD公司);摇床(TS-1,北京TAYASAF公司);IEC低温高速离心机(美国尼通公司);FMIOO制冰机(美国格兰特公司);-20℃/4℃冰箱(日本三洋公司);-80℃冰箱(中国美菱公司);液氮罐(上海博谷公司);电热恒温鼓风干燥箱(DH-101,北京利康有限公司);奥豪斯电子天平(AR2130,上海恭航称重设备有限公司);超纯水机(ZYFX-108-UP,北京盛盛科技发展有限公司);胶片夹(北京PPLYGEN有限公司);全波长多功能酶标仪(infinite M100,帝肯有限公司);Chem Doc XRS+成像系统(Bio-Rad公司);X线暗盒、D72显影粉、D72定影粉(北京PPLYGEN有限公司);X光胶片(北京CWBIO有限公司);水平摇床(北京市六一仪器厂)。
1.2.2 试剂 RIPA裂解液(P0013B)、PMSF(ST506)、BCA蛋白质定量试剂盒(P0010-1)(Beyotime);蛋白彩色Marker(26616)、ECL发光液(34096)(Thermo公司);5×蛋白上样缓冲液(B1012)、1.5M Tris·HCl缓冲液(B1001)、1.0M Tris·HCl缓冲液(B1002)、30%丙烯酰胺(B1000)、AP(A1004)、四甲基乙二胺 TEMED(A1006)、10×SDS-PAGE 电泳缓冲液(B1005)、10×蛋白电转缓冲液 10×封闭(B1006)、洗涤缓冲液(B1009)、Tween 20(A1007)(PPLYGEN有限公司);山羊抗兔IgG(二抗)(A6154,Sigma公司);PVDF膜(IPVH00010,Immobilon-P公司);mTOR(2983,美国CST);p70s6k(SC8418,美国圣克鲁斯生物技术公司);AKT(9272,美国CST)。
1.3 分组及造模方法
1.3.1 分组 饲养1周后,采用随机数字法将36只兔随机分为正常组(N)、模型组(M)、针刀组(A)和电针组(EA),每组9只,其中1只用于检验造模效果,其余用于指标检测。
1.3.2 造模 根据改良Videman[8]左后膝伸直位固定制动法制备KOA模型。两名研究者共同操作,将家兔仰卧固定,保持左后肢膝关节完全伸直,踝部充分背伸。先用脱脂棉包裹膝关节减缓压迫,再用树脂绷带缠绕整个家兔左后肢定型。于外层用高分子材料加固,并缠上防啃咬绷带。全程保持模具松紧适度并且外露足趾以观察肿胀瘀血情况。若模具下滑、破损予以加固,若后肢末端肿胀予以松解。6周造模结束后,用随机数法从每组选1只家兔处死,观测关节软骨的病理改变是否符合要求,造模成功则拆除固定。
1.4 干预方法
1.4.1 N组 不处理,常规饲养。
1.4.2 M组 造模成功后操作同N组。
1.4.3 A组 造模成功1周后,予以针刀干预治疗。具体干预方法:将KOA兔固定后,用标记笔点出股内、外侧肌腱以及股二头肌、股直肌周围的条索结节点,每次治疗选择2~3点。备皮消毒后,左手加压分离,右手持针刀垂直皮肤刺入,保持刀柄方向与肌腱走势相同,着重松解条索结节以及肌腱和骨面连接处,每点松解2~3刀,操作完成后拔出针刀并按压止血。治疗频次2次/周, 共4周累计8次。
1.4.4 EA组 造模成功1周后开始进行电针治疗,根据《实验针灸学》[9]选取梁丘-血海与内膝眼-外膝眼两组穴位,用毫针刺入5 mm,并用韩式穴位神经刺激仪以疏密波分别连接,进行电针治疗(电流参数:F=2/100 Hz,I=3 mA)。治疗频次10 min/次,3次/周,共4周累计12次。
1.5 检测方法及指标
1.5.1 大腿围度测量 将兔左后肢大腿备皮,一人将兔固定于操作台上,另一人持皮尺测量腹股沟下缘、髌骨上缘以及两者连线中点位置的大腿围度,记录数据。
1.5.2 取材方法 治疗结束1周后,各组家兔采用戊巴比妥进行全身麻醉,左后肢备皮干净后,于左后肢股骨近髌骨的前侧开口,仔细剥离浅层筋膜,于髌上2 cm处取肌肉,规格为0.5 cm×0.5 cm×0.5 cm,迅速装瓶并液氮保存。
1.5.3 股直肌组织中Akt、mTOR、p70s6k蛋白表达检测 采用Western Blot进行检测,取冻存的兔左后肢的股直肌组织,研磨后,于冰上用RIPA裂解液进行裂解,离心取上层清液,BCA法测定蛋白浓度。电泳后进行电转、封闭,并用PBS稀释液稀释一抗mTOR(1/2 000)、p70s6k(1/1 000)、AKT(1/1 000),4℃孵育过夜。 0.5% Tween 20洗膜 5 次,每次5 min,然后将山羊抗兔IgG(二抗)稀释至1∶20 000。孵育后再用0.5% Tween 20洗膜5次,每次5 min。最后使 A 液与 B 液等量混合均匀,进行化学发光反应,显影后用Image Lab进行蛋白条带的数据分析。
1.6 统计学方法
所得数据采用SPSS22.0(20150408-LSBJ,北京中医药大学,中国)统计软件进行统计,检验各组数据分布的正态性与各组间方差齐性,若正态分布且方差齐则用方差分析进行统计,否则用非参数检验进行统计。以P≤0.05为差异具有统计学意义。
2 实验结果
2.1 各组大腿围度测量结果
腹股沟下缘M组、A组及EA组的大腿围度均显著小于N组(P<0.05或P<0.01),A组大于M组(P<0.05),与EA组相比,A组、M组差异均无统计学意义(P>0.05);髌上缘各组之间大腿围度差异无统计学意义(P>0.05);中点位置M组、A组和EA组之间的大腿围度差异无统计学意义(P>0.05),但都显著小于N组(P<0.05)。见表1。
表1 各组大腿围度测量结果
注:与正常组相比,*P<0.05,**P<0.01;与模型组相比,△P<0.05。
2.2 各组股直肌Akt、mTOR、p70s6k蛋白表达
Western Blot法检测各组实验性KOA兔股直肌Akt、mTOR、p70s6k蛋白表达结果:M组较N组股直肌中mTOR和p70s6k、Akt蛋白的表达水平显著降低(P<0.01或P<0.05);干预后Akt蛋白表达:A组与EA组相比模型组显著升高(P<0.01);干预后mTOR蛋白表达:相比M组,A组与EA组升高(P<0.01或P<0.05);干预后p70s6k蛋白表达:A组较M组显著升高(P<0.05),而EA组与M组差异无统计学意义(P>0.05)。见表2、图1~2。
表2 各组股直肌Akt、mTOR、p70s6k蛋白相对表达水平
注:与正常组相比,*P<0.05,**P<0.01;与模型组相比,△P<0.05,△△P<0.01。
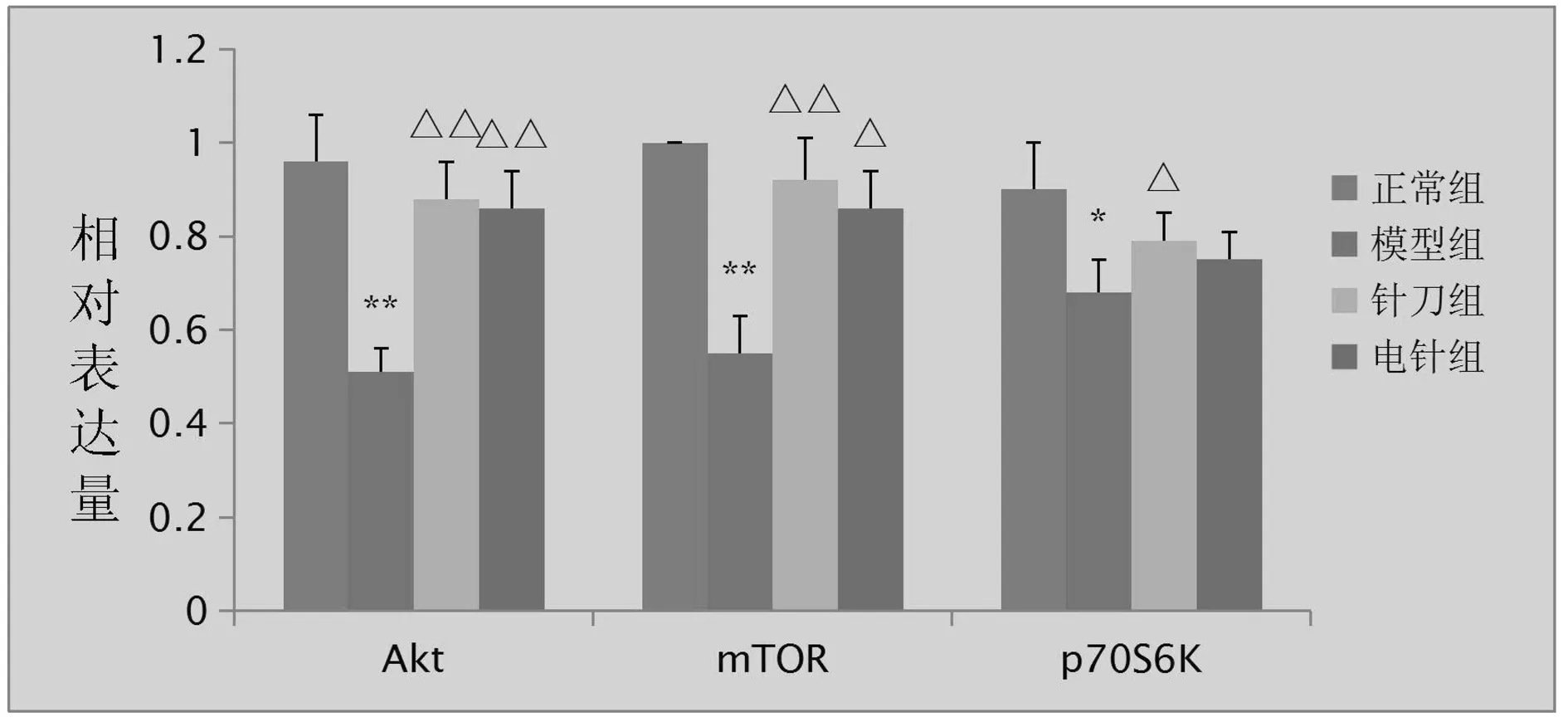
注:与正常组相比,*P<0.05,**P<0.01;与模型组相比,△P<0.05,△△P<0.01。图1 各组股直肌Akt、mTOR、p70s6k蛋白相对表达量

图2 各组股直肌Akt、mTOR、p70s6k Western blot条带图
3 讨论
KOA的动物模型制备方法有很多种,目前较为常用的是关节内注射法、手术法和制动法。关节内注射木瓜蛋白酶主要通过分解软骨基质的蛋白多糖,造成软骨退变的KOA模型[10],但与临床上因膝周力学改变引起的病变在机制上差异较大。研究指出各种原因引起的膝关节周围肌肉无力、应力不平衡是引起KOA的重要原因[11]。从这个切入点,手术法[12]与关节制动法[8]更能复刻出力学失衡的发病过程。但是手术法打开了关节囊,属于有创性造模,影响关节的初始结构。而关节制动法可使那些制动时长度比静止状态长度短的肌肉(本研究中为股直肌)出现明显的萎缩[13],更加适合本研究的探索。故本实验沿用改良videman法进行造模。
与此同时,最新的研究也指出,股四头肌无力会增加膝骨关节炎发病的可能[14]。针对退行性KOA中肌肉无力的特点,国外的研究者从股四头肌无力入手治疗KOA,发现锻炼激活股四头肌可以有效地改善中、重度KOA患者的临床症状[15],这与中医的治疗思路有异曲同工之秒。从中医的角度而言,郝军[16]提出“筋为骨用”的治疗思路,并且在经筋理论的指导下,众多中医方法干预KOA均取得良好的效果[17]。针刀疗法将传统针灸机械牵拉的特点与手术刀松解的特点相结合[18],松解软组织,具有调整力学失衡、改善股直肌力学特性[19]、抑制股直肌中Bax、Caspase-3凋亡相关蛋白表达[5]从而促进股直肌的修复的作用,减缓KOA的进程。
相关研究表明Akt-mTOR可感知环境和细胞内的变化,整合各种外界信号刺激后调节细胞的生长、分化、自噬及凋亡等[6]。在肌腱损伤的动物模型中,该通路会被下调,使自噬-溶酶体系统增强,加重肌肉蛋白质的水解进而导致肌肉萎缩[20]。因此,抑制自噬-溶酶体途径可以有效地减缓肌肉萎缩,促进恢复。与此同时,近年来有研究指出,该通路可介导自噬、凋亡等多种途径调控骨骼肌蛋白质合成,预防肌肉萎缩,与骨骼肌修复密切相关[21]。在本实验中,造模之后,Akt、mTOR蛋白表达显著降低,提示造模给肌肉细胞造成应激后,激活其自噬-溶酶体系统,对局部受损细胞进行清除以维持能量代谢来对抗外界的变化,肌肉出现了萎缩。并且造模后腹股沟下缘、髌上缘大腿围度均显著小于正常组,进一步证实肌肉出现了萎缩。而针刀、电针均上调了该通路,提示股直肌的萎缩被抑制,可见两种干预均打破了KOA膝周 “力学失衡-股直肌萎缩”的恶性循环,有效地阻遏了病程进展。
p70s6k作为Akt/mTOR下游主要的效应因子,通过上游的级联激活后,可以有效地促进细胞增殖[22]。该因子的高表达不仅介导细胞中蛋白质的合成,还介导血管生成[23]。研究表明p70s6k的激活可以对骨骼肌起到保护作用,减少肌肉被破坏以及抑制细胞凋亡,对萎缩的骨骼肌有积极的作用[24]。本实验结果显示,针刀干预后股直肌p70s6k蛋白表达相比模型组显著升高,逆转了股直肌萎缩的状态,蛋白质合成升高,血管生成,呈现出修复状态,该过程由Akt/mTOR通路介导并协同完成,进一步印证针刀对股直肌的修复作用,与行为学结果相符合。而电针干预后,p70s6k蛋白表达与模型组比较差异无统计学意义,与行为学结果相印证,但与通路结果不一致,故其由akt/mTOR通路介导修复股直肌的途径尚不清楚,这可能是针刀与电针两种干预方法的差异所在,需进一步探索。
综上,针刀通过上调akt/mTOR及p70s6k的蛋白表达,修复萎缩的股直肌,改善膝周软组织的生物力学,促进膝关节的恢复。

