以多浆膜腔积液及肝功能损害为主要表现的别嘌醇所致药物超敏综合征一例
宋首楷,汤绍辉
暨南大学附属第一医院消化内科,广东 广州 510630
别嘌醇(Allopurinol)本品及其代谢产物作为一种能抑制尿酸合成的药物,具有抑制黄嘌呤氧化酶的作用,有助于减少尿酸合成,进而降低尿酸中的浓度,并减少关节、肾脏、骨沉着尿酸。但同时,其也具有很多不良反应,如最常见的过敏反应,甚至还会累及胃肠道、神经系统、血液系统等。临床上突出表现为多浆膜腔积液(胸腔、腹腔、心包腔)及肝功能损害,伴有其他内脏损害如胃肠道(腹痛、恶心、呕吐)、凝血功能异常(凝血酶原时间延长)等症状。本病例所具有的症状为大量腹水、胸水、心包积液及肝功能损害,笔者通过检索国内外相关文献,尚未发现药物超敏综合征(drug-induced hypersensitivity syndrome,DIHS)同时具有大量腹水、胸水、心包积液及肝功能损害等症状,因此,该病例分析具有一定临床研究价值。
药物超敏综合征(DIHS)又被称为“药物引起的迟发性多器官超敏综合征”(drug-induced delayedmultiorgan hypersensitivity syndrome,D-IDMOHS),属于急性严重性药物不良反应。该病症致死率可达10%,临床表现多样,易误诊。现报道我科收治的一例既往服用别嘌醇的DIHS的病例,希望对医务人员有所启迪,丰富疾病知识。
1 病例简介
患者是一名幼儿教师,女性,年龄44 岁。因“发热、腹痛6 d,加重伴腹胀、呕吐、尿黄、咳嗽、胸闷1 d”于2019 年5月18日入院。患者6 d前无明显诱因出现发热,体温(T)38.0℃~39.0℃,伴畏寒,右上腹呈持续性隐痛。于广州某医院就诊,腹部彩超显示胆囊结石伴胆囊炎,予“头孢替安、甲硝唑”等治疗后发热、腹痛等稍好转。1 d前上述症状加重,伴腹胀、恶心、呕吐、尿黄、咳嗽、胸闷、心悸不适。于是到本院就诊,以“发热、腹痛”收入院。患者发病以来,无呕血、便血等。既往否认高血压病、冠心病、糖尿病病史,否认遗传病、传染病及疫水接触史。个人史、月经婚育史及家族史无特殊。
体格检查:T 38.1℃,心率(P) 90 次/min,呼吸(R)18次/min,血压(Bp)118/78 mmHg(1 mmHg=0.133 kPa);神志清楚,急性病容;皮肤、巩膜轻度黄染,未出现皮下出血点及瘀斑,呼吸音弱,轻微湿啰音,双侧中下肺叩诊呈浊音;全身未见浅表淋巴结肿大;律齐、心率90 次/min;未见各瓣膜听诊区病理性杂音;腹部膨隆,腹肌稍紧张,中上腹压痛,无反跳痛,肝脾肋下未触及,移动性浊音(+),肠鸣音5~6 次/min。入院诊断:(1)发热、腹痛、咳嗽、胸闷查因;(2)腹腔积液查因。给予抑制胃酸、抗感染、对症等治疗。

图1 胸片显示胸水及肺不张
入院后完善相关检查:血常规红细胞计数5.13×1012/L,血红蛋白153.00 g/L,白细胞计数22.22×109/L,嗜中性粒细胞73.7%,嗜酸性粒细胞2.7%;尿常规胆红素34 μmol/L,余项正常;大便常规正常;血生化中谷丙转氨酶(ALT) 1 089 U/L,谷草转氨酶(AST) 586 U/L,总胆红素55.3 μmol/L,结合胆红素42.3 μmol/L,白蛋白26.0 g/L,肾功能、心肌酶、血脂等均基本正常;C反应蛋白(CRP) 78.07 mg/L,降钙素原(PCT) 5.183 ng/mL;血氨125 μg/dL;胸部X 片及胸部增强CT 显示双侧胸腔积液及肺不张(图1、图2),上腹增强CT 显示胆囊结石及腹腔大量积液(图3),心脏彩超显示心包少量积液,肾脏彩超未见明显异常。根据患者病史、临床表现及相关检查(多系统受损),考虑如下诊断及鉴别诊断:(1)感染性疾病,如流感、脓毒症、结核病、登革热、流行性出血热、钩端螺旋体病等;(2)病毒性肝炎;(3)自身免疫性疾病;(4)中毒或药物(服用过别嘌醇)超敏反应。给予保肝抗炎、补充白蛋白、对症、支持等治疗。

图2 增强CT显示胸水及肺不张
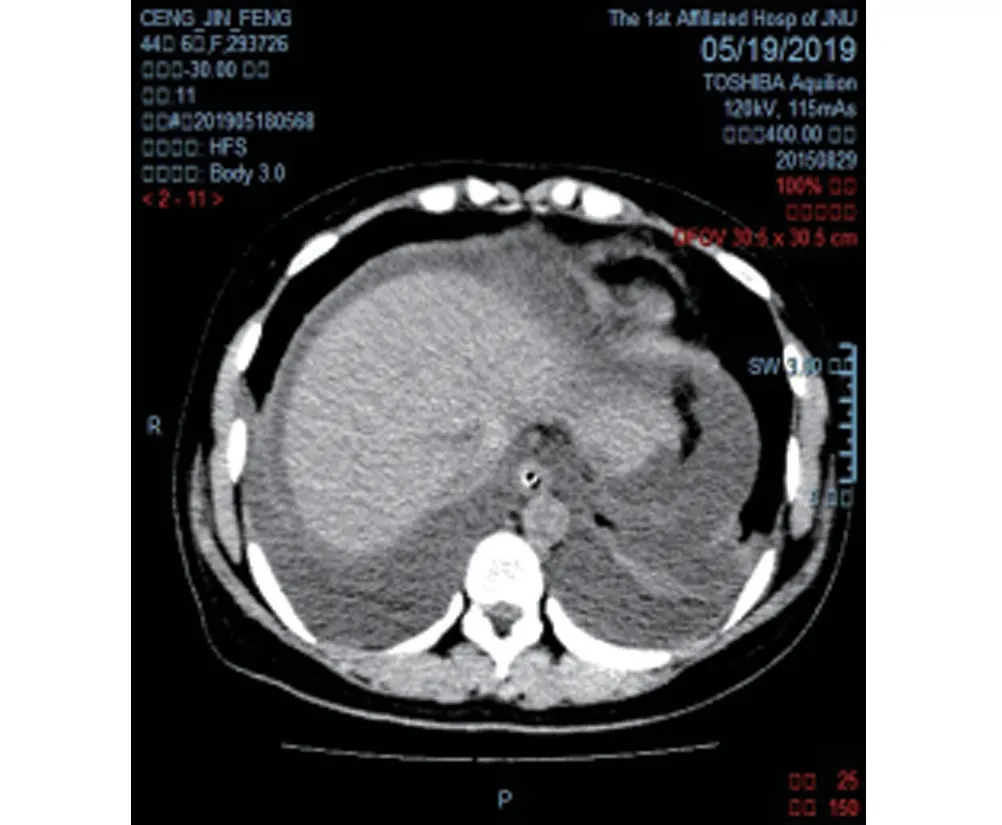
图3 大量腹腔积液
入院后第4 天,患者T 38.8℃,咳嗽加重,痰多不易咳出,呼吸急促,腹胀、上腹痛加重。给予胸腹腔穿刺放胸腹水,并进行胸腹水检测,显示渗出液。追问病史,既往有痛风病史5年,发病前3周痛风发作自服别嘌醇,100 mg,3 次/d,共服用10 d;否认可疑毒物及重金属接触史。另外,根据目前考虑诊断及鉴别诊断,进一步行相关检查显示:(1)T细胞斑点试验(-),血结核抗体(-),痰找抗酸杆菌及真菌检查均为(-),血培养(-),甲乙丙型流感病毒检测(-),登革病病毒抗体、流行性出血热病毒抗体、钩端螺旋体病抗体均为(-),肥达及外斐氏反应(-),传染性单核细胞增多症筛查检测均为(-),肺炎衣原体、肺炎支原体、军团菌相关检测均为(-),EB 病毒DNA(-),HIV 抗体(-),肝吸虫抗体(-),巨细胞病毒IgM 抗体(-),梅毒螺旋体抗体(-);(2)甲乙丙丁戊型肝炎病毒标志物(-);(3)风湿免疫自身抗体全套(-),血免疫球蛋白、补体正常;(3)血铜蓝蛋白、血铜正常;(4)血肿瘤标记物[癌胚抗原(CEA)、甲胎蛋白(AFP)、糖类抗原(CA)72-4、CA19-9、CA153、CA125](-);(5)凝血酶原时间延长(20.1 s)。根据上述相关检查结果,基本可排除下列疾病:(1)结核病、流感、脓毒症、登革热、流行性出血热、钩端螺旋体病、人体免疫缺损病毒(HIV)、伤寒、肺部非典型病原体感染、恙虫病等感染性疾病;(2)甲乙丙丁戊型病毒性肝炎及自身免疫性肝炎;(3)常见风湿免疫性疾病;(4)肝豆状核变性等。
入院后第7天,患者上腹部、后背相继出现麻疹红斑样皮疹伴瘙痒,成片(图4),伴瘙痒,提示皮肤过敏。考虑患者发病前服用过别嘌醇10 d,于是完善HLA-B*5801等位基因检查,结果阳性。另外,患者入院后所用药物没有改变,表明皮肤过敏不是由入院后的药物所致,而是由别嘌醇所导致的药物超敏综合征。于是,给予地塞米松10 mg 静脉滴注,1 次/d,共5 d,后改口服强的松;免疫球蛋白10 g,静脉滴注,1 次/d,共3 d。经过上述治疗后患者临床表现明显好转,胸腹水5 d 后完全消退,上腹部、后背皮疹1 周后完全消退,实验室检查如血常规、肝功能、CRP、PCT 等指标两周后恢复正常。根据患者病史、临床表现、辅助检查及治疗效果,最后诊断:别嘌醇所致药物超敏综合征。

图4 背部皮疹
2 讨论
别嘌醇是黄嘌呤氧化酶抑制剂,通过抑制尿酸生成途径的关键酶而发挥降低血尿酸作用,临床上在治疗痛风、高尿酸血症中普遍运用此类药物。但是采用此法进行治疗,很容易引起诸如严重皮肤不良反应(SCAR)等,已经引起临床医师高度关注。SCAR 包括:(1)DIHS;(2)中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN);(3)史蒂文斯-约翰逊综合征(Stevens-Johnson,SJS);(4)剥脱性皮炎(exfoliative dermatitis,ED),病死率极高[1-2]。
研究表明,药物相关的严重不良反应与人类HLA基因多态性密切相关。HLA-B 基因定位于第6号染色体短臂,在机体免疫调节中起关键作用。研究显示,HLA-B5801等位基因在中国汉族人群中的阳性率为14%~20%,该等位基因阳性者服用别嘌醇后发生SCAR 的风险明显高于阴性者[2-3],中国汉族人群HLA-B*5801等位基因阳性与服用别嘌醇后引起皮肤不良反应密切相关[1]。
别嘌醇应用后所致的DIHS 通常潜伏期较长,多在服药后2~6周发生[4],临床上通常具有发热、皮疹及内脏损害三联征表现。患者皮损类型多,以麻疹猩红热样型多见,其他还可表现为剥脱性皮炎、重症多形红斑、中毒性表皮坏死松解型等严重类型;内脏损害主要累及肝、肾、胃肠、造血系统等[5]。DIHS 的诊断标准如下:(1)用某特定药物后迟发性发病,急速扩大红斑,大多是进展成红皮病。(2)停用致病药物后,过敏症状持续两周以上。(3)体温大于38℃。(4)伴有器官损害。(5)有以下1 项血液改变,即a,血常规白细胞大于1l×109/L;b,异型淋巴细胞数大于5%以上;c,嗜酸性粒细胞升高大于1.5×109/L。(6)淋巴结增大。(7)疱疹病毒-6 型感染再激活。典型DIHS 具备以上全项,非典型具备1~5 项[6]。DIHS 治疗主要包括停用致敏药物、糖皮质激素及人免疫球蛋白的应用等。
本病例有如下特点:(1)患者发病前3 周因痛风发作自服别嘌醇10 d;(2)临床上突出表现为多浆膜腔积液(胸腔、腹腔、心包腔)及肝功能损害,伴有其他内脏损害如胃肠道(腹痛、恶心、呕吐)、凝血功能异常(凝血酶原时间延长)等,检索国内外相关文献,尚未见DIHS同时表现为大量腹水、胸水、心包积液及肝功能损害者;(3)发热(大于38℃);(4)延迟性皮疹,即发病后接近两周才出现皮疹;(5)HLA-B5801等位基因阳性。该患者病史、临床表现及相关检查符合DIHS 诊断标准的1~5 项,并且HLA-B5801 等位基因阳性,应用糖皮质激素及人免疫球蛋白等治疗后患者完全恢复,表明DIHS诊断完全成立。该患者急性起病,表现为发热、全身多系统功能严重受损,当未出现皮疹时,容易误诊为全身感染性疾病、自身免疫性疾病等。故临床上对类似表现的患者应详细询问病史,包括既往服用药物史,以避免误诊漏诊;同时,建议痛风患者服用别嘌醇前应完善HLA-B5801等位基因检测,尽量避免该药物所致的不良反应。

