乌饭果花色苷复合酶法提取工艺优化及其抗氧化活性
康彬彬,刘龙燕,王 祥,丁力杰,林河通,陈团伟,*
(1.福建生物工程职业技术学院,福建福州 350007;2.福建农林大学食品科学学院,福建福州 350002)
花色苷(anthocyanin)是花青素与糖基通过糖苷键结合而成的具有2-苯基苯并吡喃阳离子结构的多酚类化合物,广泛存在于植物细胞内,具有抗氧化、清除自由基、抗炎、抑菌等多种生理功能[1-4],已成为功能性食品、化妆品以及药品等开发利用中的一类重要功能因子。乌饭果为越橘属(Vaccinium)野生植物乌饭树(VacciniumbracteatumThunb.)的紫黑色球状浆果,10~11月成熟,富含氨基酸、矿物质、花色苷、黄酮等营养功能成分[5],在民间,特别是我国畲族地区对乌饭果的利用较早,除直接食用外,主要利用乌饭果和乌饭叶的汁液对大米进行染色和烹调制作“乌米饭”[6],而对乌饭果花色苷功能成分的提取和生理活性研究较为缺乏。
当前,溶剂法以其简单、易操作、成本低等特点被广泛应用于花色苷的提取,但由于花色苷存在于纤维素、果胶构成的细胞壁内,导致提取时间长、花色苷得率低[7]。为了提高花色苷的得率,国内外学者多采用超声波[8]、微波[9]、超高压[10]、酶[11]等辅助提取花色苷,能有效缩短提取时间,提高提取效率,其中,酶法辅助提取以其高效、环保、高得率等优点已成为植物花色苷提取的有效手段,李颖畅等[11-15]先后开展了纤维素酶或果胶酶提取蓝莓果、紫薯、紫山药、紫皮豇豆、黑米中花色苷的工艺研究,结果表明酶辅助提取能显著提高花色苷得率,但有关复合酶法提取乌饭果花色苷方面的研究目前暂未见报道。因此,本文以乙醇为提取溶剂,通过响应曲面法优化乌饭果花色苷的复合酶法提取工艺,并分析评价乌饭果花色苷的体外抗氧化活性,旨在为乌饭果花色苷活性成分的高效提取及其进一步开发利用提供科学依据和实践指导。
1 材料与方法
1.1 材料与仪器
野生乌饭果 采自福建省福鼎市贯岭乡,采收当天运至福州实验室,经清洗、真空干燥(60 ℃、0.1 Mpa)至含水率<10%后粉碎过40目筛,粉体置于棕色瓶中密封备用;纤维素酶 15000 U·g-1,国药集团化学试剂有限公司;果胶酶 1000 U·g-1,瑞士Fluka公司;大豆卵磷脂(98%) 上海研谨生物科技有限公司;抗坏血酸 阿拉丁试剂(上海)有限公司;过氧化氢、乙醇、盐酸、邻苯三酚等 分析纯,国药集团化学试剂有限公司。
DS-1型高速组织捣碎机 上海精密仪器仪表有限公司;D2F-6050型真空干燥设备、PB-10 pH计、DK-S26型数显电热恒温水浴锅 上海精宏试验设备有限公司;BS-124S电子分析天平 北京赛多利斯仪器系统有限公司;UV-2000紫外可见分光光度仪 尤尼柯(上海)仪器有限公司;SK-1快速混匀器 常州国华电器有限公司;H2050R冷冻离心机 长沙湘仪离心机设备有限公司;FDU-1200 冷冻干燥机 日本东京 EYELA公司。
1.2 实验方法
1.2.1 单因素实验 准确称取乌饭果粉末1.000 g加入锥形瓶中,以50%乙醇为提取溶剂,选取加酶量、复配比、酶解温度、酶解时间、初始pH、料液比等进行复合酶法提取单因素实验,酶解液经90 ℃灭酶10 min,1000 r/min离心10 min,收集上清液,定容至15 mL,535 nm下紫外-可见分光光度测定其吸光值,考察不同提取条件对乌饭果花色苷含量的影响。
1.2.1.1 加酶量对乌饭果花色苷含量的影响 在酶解温度50 ℃,酶解时间120 min,料液比1∶10 g·mL-1,初始pH4.5,纤维素酶:果胶酶1∶1下,研究加酶量(30、50、100、150、200、250、300 U·g-1原料)对乌饭果花色苷含量的影响。
1.2.1.2 酶配比对乌饭果花色苷含量的影响 在酶解温度50 ℃,酶解时间120 min,料液比1∶10 g·mL-1,初始pH4.5,加酶量100 U·g-1原料下,研究纤维素酶:果胶酶酶配比(5∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4)对乌饭果花色苷含量的影响。
1.2.1.3 酶解温度对乌饭果花色苷含量的影响 在纤维素酶∶果胶酶2∶1,加酶量100 U·g-1原料,酶解时间120 min,料液比1∶10 g·mL-1,初始pH4.5下,研究酶解温度(35、40、45、50、55、60 ℃)对乌饭果花色苷含量的影响。
1.2.1.4 酶解时间对乌饭果花色苷含量的影响 在纤维素酶∶果胶酶2∶1,加酶量100 U·g-1原料,酶解温度50 ℃,料液比1∶10 g·mL-1,初始pH4.5下,研究酶解时间(60、90、120、150、180、210、240、270 min)对乌饭果花色苷含量的影响。
1.2.1.5 酶解pH对乌饭果花色苷含量的影响 在纤维素酶∶果胶酶2∶1,加酶量100 U·g-1原料,酶解温度50 ℃,酶解时间120 min,料液比1∶10 g·mL-1下,加入磷酸盐缓冲液调节pH,研究不同pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0)对乌饭果花色苷含量的影响。
1.2.1.6 料液比对乌饭果花色苷含量的影响 在纤维素酶∶果胶酶2∶1,加酶量100 U·g-1原料,酶解温度50 ℃,酶解时间120 min,初始pH4.5下,研究不同料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶40 g·mL-1)对乌饭果花色苷含量的影响。
1.2.2 响应面优化试验 在单因素实验基础上,选取纤维素酶∶果胶酶配比2∶1,pH4.0,料液比1∶30 g·mL-1条件下,以加酶量(X1)、酶解温度(X2)、酶解时间(X3)为响应变量,花色苷含量(mg·100 g-1)为响应值,通过响应曲面法优化乌饭果花色苷的复合酶法提取工艺条件。因素编码及各响应变量水平见表1。

表1 二次回归正交旋转组合设计因素水平表Table 1 Factors and levels of quadricregression orthogonal rotary tests
1.2.3 花色苷含量的测定 基于花色苷在波长535 nm处有最大吸收峰[15-17],参照Wu等[17]的Fuleki法测定乌饭果花色苷提取液在535 nm处的吸光值A535,并按照式(1)计算乌饭果花色苷含量。
式(1)
式中,C-乌饭果花色苷含量,mg·100 g-1;A535-535 nm处吸光值;V-定容后体积,mL;N-稀释倍数;98.2-1%花色苷在535 nm处的平均消光系数;m-乌饭果粉末质量,g。
1.2.4 乌饭果花色苷体外抗氧化活性的测定
1.2.4.1 乌饭果花色苷的制备 将上述最佳工艺条件下制备的乌饭果花色苷酶解液,经1000 r/min离心15 min,收集上清液于40 ℃下减压蒸发去除乙醇后冷冻干燥,制得冻干粉。准确称取一定量乌饭果花色苷冻干粉,用1.5 mol/L盐酸-95%乙醇(v/v,15/85)配制成不同质量浓度的乌饭果花色苷样品溶液。
1.2.4.2 羟自由基(·OH)清除能力的测定 参考李颖畅等[18]的水杨酸-Fe2+氧化法测定花色苷提取液在510 nm处的吸光值,并按照式(2)计算·OH清除率。同时以同质量浓度抗坏血酸(10、20、40、60、80、100、120、140、160 μg·mL-1)为阳性对照。
·OH清除率/%=[A0-(A1-A2)]/A0×100
式(2)
式中,A0-1.0 mL蒸馏水代替样品溶液的吸光值;A1-1.0 mL样品溶液的吸光值;A2-1.0 mL蒸馏水代替H2O2溶液的吸光值。

式(3)
式中,A0-蒸馏水代替样品溶液的吸光值;A1-样品溶液的吸光值。
1.2.4.4 抗脂质过氧化能力的测定 根据李颖畅等[18]的方法,并略作修改。分别于试管中依次加入1.0 mL大豆卵磷脂溶液,1.0 mL 0.4 mmol/L FeSO4和1.0 mL不同浓度的样品溶液(100、200、400、600、800、1000 μg·mL-1),混匀,于37 ℃水浴下避光保存60 min,再加入2.0 mL TCA-TBA-HCl混合液,90~100 ℃水浴15 min后迅速冷却,3000 r/min离心10 min,取上清液在535 nm处测定吸光值As。空白管以蒸馏水代替样品,测定其吸光值Ac。参比管以1.0 mL蒸馏水代替1.0 mL卵磷脂,并按照式(4)计算脂质过氧化抑制率。同时以同质量浓度抗坏血酸为阳性对照。
脂质过氧化抑制率(%)=(Ac-As)/Ac×100
式(4)
式中,Ac-空白液的吸光值;As-样品溶液的吸光值。
1.3 数据处理
以上指标均重复取样测定3次,采用DPS V12.01软件对实验数据进行统计分析,P<0.05和P<0.01分别表示差异显著和极显著。采用Excel 2007和Origin 8.5软件进行数据处理分析及图形制作。
2 结果与分析
2.1 单因素实验
2.1.1 加酶量对乌饭果花色苷含量的影响 从图1A可以看出,乌饭果花色苷含量随加酶量的增加呈现先升高后下降的趋势(P<0.05),这可能是由于加酶量较低时酶解破壁不完全,细胞内花色苷未能完全释放,导致花色苷含量较低,而加酶量过大,酶可能发生相互附着,从而降低酶与底物的传质效率,影响酶解速率,导致花色苷含量下降[13]。因此,确定复合酶的最佳加酶量为100 U·g-1。
2.1.2 不同配比对乌饭果花色苷含量的影响 由图1B可知,纤维素酶∶果胶酶为2∶1时,乌饭果花色苷的提取量达到最大,含量为126.56 mg·100 g-1,而在纤维素酶或果胶酶含量过大时,花色苷含量有所下降。因此,确定纤维素酶和果胶酶的配比为2∶1。
2.1.3 酶解温度对乌饭果花色苷含量的影响 由图1C可知,酶解温度对乌饭果花色苷含量影响显著(P<0.05),随着酶解温度的升高,由于底物分子适度展开且动能增加,加快了酶解反应速度,花色苷含量增加,但当温度超过50 ℃后,酶可能因为部分失活变性导致酶解反应受到抑制,花色苷含量反而下降[11]。因此,选取40 ℃为较佳酶解温度,此时花色苷含量为127.08 mg·100 g-1。
2.1.4 酶解时间对乌饭果花色苷含量的影响 在60~120 min酶解时间内,随着酶解时间的延长,酶解反应较充分(P<0.05),有利于细胞内花色苷的溶出,但酶解时间过长可能引起酶活力降低,同时花色苷由于长时间酶解发生部分降解,导致花色苷含量下降(图1D)。因此,确定该复合酶体系的最适酶解时间为120 min。
2.1.5 pH对乌饭果花色苷含量的影响 酶活力高低及花色苷稳定性与酶解体系的pH密切相关,由图1E可以看出,乌饭果花色苷含量随pH上升呈先上升后下降的趋势(P<0.05),这可能与纤维素酶和果胶酶活性发挥的最适pH有关[20],且相关研究表明花色苷在酸性条件下较为稳定[14]。因此,选择pH4.0作为本试验复合酶解的最适pH,此pH下乌饭果花色苷含量最高,达130.33 mg·100 g-1。
2.1.6 料液比对乌饭果花色苷含量的影响 由图1F可以看出,乌饭果花色苷含量随料液比的增大而增加(P<0.05),而后趋于平稳。当料液比为1∶30 g·mL-1时,花色苷含量为133.76 mg·100 g-1,而继续增加到1∶40 g·mL-1时,花色苷含量仅提高1.14%与1∶30 g·mL-1时相比,差异不显著(P>0.05)。这可能是因为在一定的加酶量下,提取溶剂的增加有利于乌饭果细胞内花色苷的扩散和释放[12]。因此,从效率和经济因素考虑,料液比以1∶30 g·mL-1为宜。
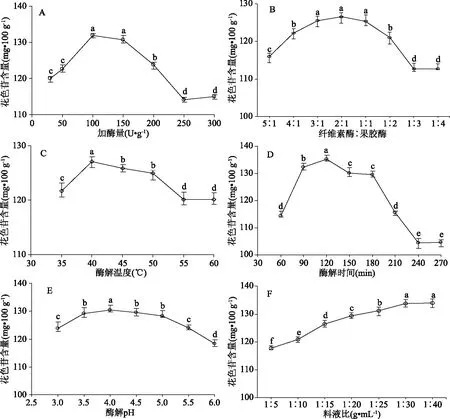
图1 各单因素对乌饭果花色苷含量的影响Fig.1 Effects of different extraction parameters on the contents of anthocyanin from Vaccinium bracteatum Thunb. fruits注:不同小写字母表示差异显著(P<0.05)。
2.2 乌饭果花色苷复合酶法提取工艺的优化
2.2.1 响应曲面试验结果 在单因素试验的基础上,以花色苷含量为指标,采用二次回归正交旋转组合设计对乌饭果花色苷复合酶解工艺进行优化,试验结果见表2。
为了更明确各因素加酶量X1、酶解温度X2和酶解时间X3对花色苷含量的影响,采用DPS V12.01数据处理软件对表2中数据进行多元回归分析和拟合,得到如下回归数学模型:
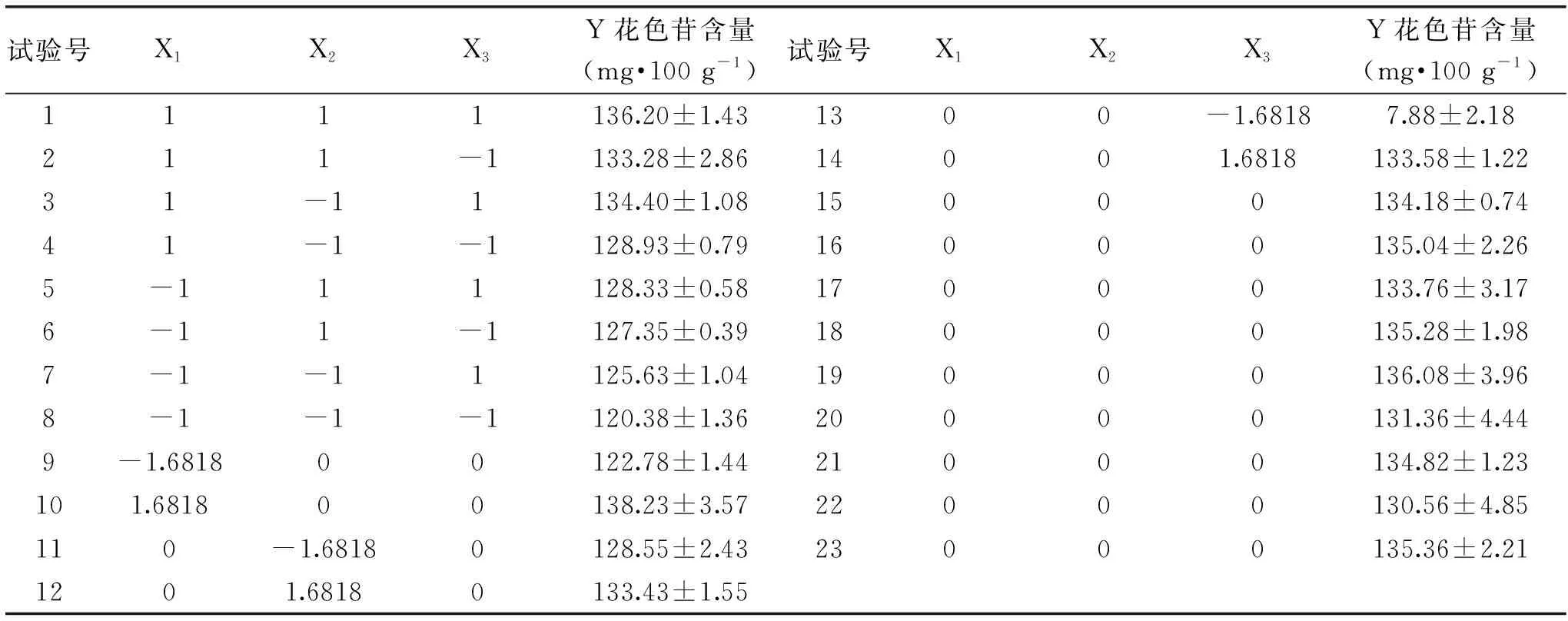
表2 二次回归正交旋转组合设计试验及结果Table 2 Results of quadric regression orthogonal rotary tests
方差分析结果表明(表3),加酶量、酶解温度和酶解时间对乌饭果花色苷含量的影响达极显著水平(P<0.01),各因素的主次顺序为:加酶量>酶解时间>酶解温度。此外,加酶量、酶解温度和酶解时间等因素的二次项对花色苷含量的影响也达极显著(P<0.01)。

表3 方差分析 Table 3 Variance analysis
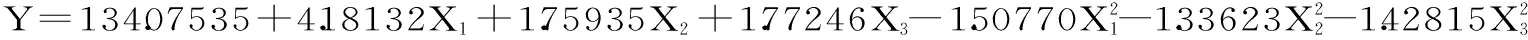
2.2.2 响应面分析与工艺优化 加酶量(X1)、酶解温度(X2)、酶解时间(X3)对花色苷含量(Y)的响应面分析结果如图2所示。由图2A可知,响应曲面较为陡峭,表明花色苷含量对酶解温度和加酶量的改变较为敏感。当加酶量一定时,花色苷含量随酶解温度的增加,先增大后快速下降,保持酶解温度一定时,花色苷含量随加酶量增加也呈先增大后减小,且酶解温度较加酶量对花色苷含量的影响显著,等高线成椭圆形,表明酶解温度与加酶量具有较强的交互作用;从图2B可以看出,响应曲面较为平缓,表明花色苷含量受酶解时间和加酶量的交互作用。当加酶量一定时,花色苷含量随酶解时间的延长,先增大后下降,保持酶解时间一定时,花色苷含量随加酶量的增大也呈先增大后减小的趋势,等高线呈扁圆形,表明酶解时间和加酶量具有一定的交互作用,但不显著;由图2C可知,响应曲面陡峭,表明花色苷含量对酶解温度和酶解时间的改变较为敏感。当酶解温度一定时,花色苷含量随酶解时间的延长,先增大后下降,保持酶解时间一定时,花色苷含量随酶解温度增大呈先增大后减小,说明酶解温度过高和酶解时间过长均不利于花色苷的提取,等高线呈椭圆形,表明酶解时间和酶解温度具有较强的交互作用。因此,综合表3及图2,通过DPS12.01数据处理软件分析,确定出乌饭果花色苷的复合酶法提取最佳工艺条件为:加酶量234 U·g-1,纤维素酶∶果胶酶2∶1,pH4.0,料液比1∶30 g·mL-1,酶解温度50 ℃,酶解时间180 min,该条件下乌饭果花色苷含量为137.61 mg·100 g-1。进一步的验证试验得花色苷含量(136.08±4.49) mg·100 g-1,与预测值接近(RSD为1.12%),这一结果表明响应面法优化乌饭果花色苷的复合酶法提取工艺是可靠的。

图2 双因素效应分析图Fig.2 Analysis of double factor effect
2.3 乌饭果花色苷的体外抗氧化活性
2.3.1 乌饭果花色苷对·OH的清除能力 羟自由基(·OH)是引起生物体内蛋白质、核酸、脂质等生命大分子物质发生氧化和损伤的一类重要活性氧自由基[21]。由图3可知,乌饭果花色苷具有较强的·OH清除能力,且随质量浓度增加而增大,但清除率显著低于抗坏血酸组(P<0.01)。通过计算半抑制浓度IC50(清除率或抑制率达到50%时所需样品的质量浓度)发现,乌饭果花色苷与抗坏血酸的IC50分别为92.23和73.98 μg·mL-1,表明乌饭果花色苷清除·OH的能力弱于抗坏血酸。

图3 乌饭果花色苷与抗坏血酸对·OH清除能力的比较Fig.3 Comparision of scavenging effect ofhydroxyl radicals between anthocyanin fromVaccinium bracteatum Thunb. fruits and ascorbic acid注:*和**分别表示同浓度下乌饭果花色苷与抗坏血酸抗氧化活性差异显著(P<0.05)和差异极显著(P<0.01);图4~图5同。

图4 乌饭果花色苷与抗坏血酸对清除能力的比较Fig.4 Comparision of scavenging effectsuperoxidefree radicals between anthocyanin fromVaccinium bracteatum Thunb. fruits and ascorbic acid
2.3.3 乌饭果花色苷对脂质过氧化的抑制能力 细胞膜磷脂是活性自由基进攻的主要靶物质,其被氧化造成细胞膜系统破坏,从而引起细胞损伤和坏死,危害人机体组织[18]。乌饭果花色苷对大豆卵磷脂过氧化抑制能力的影响如图5所示。由图可见,乌饭果花色苷对由Fe2+引发的卵磷脂脂质体具有明显的抑制作用,其抑制率随样品浓度的增加而增大,当浓度为400 μg·mL-1时,其对脂质体过氧化的抑制率为61.15%,而抗坏血酸为52.83%。乌饭果花色苷抑制脂质体过氧化的IC50为303.1 μg·mL-1,抗坏血酸为366.2 μg·mL-1,说明乌饭果花色苷对脂质体过氧化的抑制能力强于抗坏血酸(P<0.05)。

图5 乌饭果花色苷与抗坏血酸对脂质体过氧化抑制能力的比较Fig.5 Comparision of inhibition effect of lipidper-oxidation between anthocyanin fromVaccinium bracteatum Thunb. fruits and ascorbic acid
3 结论


