核桃饼粕蛋白提取、多肽制备条件优化及其酶解液的抗氧化性研究
马雅鸽,张 希,杨婧娟,舒云鹏,赵声兰
(云南中医药大学中药学院,云南昆明 650500)
核桃仁系胡桃科(Juglandaceae)植物胡桃(JuglansregiaL.)的干燥成熟种子,收载于《中国药典》2015版第279页[1],用于肾阳不足、腰膝酸软、阳痿遗精、虚寒喘嗽、肠燥便秘等症,广泛用于治疗神经衰弱、高血压、冠心病、降血脂等症,有“木本油料之王”的美称[2]。鉴于核桃优异的生态效益、丰富的营养保健功能及我国粮油安全战略需求,我国核桃产业近年出现了强劲的发展势头,已成为许多地方的支柱产业,目前我国核桃种植面积和产量均居世界之首,云南又居全国第一,截至2017年底,云南省核桃种植面积达288×104hm2,总产量102×104t,综合产值305亿元,核桃主产区农民人均核桃收入超过1500元[3]。加强核桃和核桃副产物的深度开发研究对核桃产业的健康可持续发展具有重要的社会意义和经济意义。
但是目前国内对核桃资源的利用仍然处于初级阶段,主要是榨取核桃油,而榨油后的核桃饼粕被当做废弃物处理,常用作饲料、肥料,或直接丢弃,不仅造成资源的严重浪费,还污染环境[4-8],同时有研究表明核桃饼粕中蛋白质含量高达40%以上[9-10],因此,对核桃饼粕蛋白进行精深加工,提高核桃资源综合利用效率,成为核桃资源利用的焦点。目前对核桃粕蛋白的研究思路主要集中在以核桃粕为原料提取蛋白,再以此为原料进行水解,获得核桃粕蛋白源活性肽,进而研究其生物活性,有研究发现核桃源蛋白肽具有改善记忆力、抑制ACE、降尿酸、抗氧化、抗癌、降血糖、抗疲劳等生物活性[11-15]。然而,目前制备核桃蛋白肽的方法主要是使用单一的不同蛋白酶进行酶解,不符合蛋白质在动物体内的生物转化过程,也缺乏不同酶解体系制备的酶解液活性的对比研究。因此,本研究采用逐层递进的更接近动物体内消化过程的3种酶解体系,对核桃粕蛋白进行酶解,以期获得生物活性更强、更安全的核桃粕源的生物活性肽。
由于蛋白质在动物体内的消化过程需要先经过胃蛋白酶酶解,再经过胰蛋白酶酶解,因此,本研究采用的第一种酶解体系是先胃蛋白酶再胰蛋白酶酶解的双酶解体系;同时蛋白质在动物体内消化还受不同离子体系、pH、氧及膜通透性的影响,因此,本研究采用的第二种酶解体系是体外模拟胃肠道消化体系;进一步考虑肠道微生物对体内蛋白质消化的影响,本研究采用的第三种酶解体系是体外模拟胃肠道消化+混合乳酸菌体系。
本研究以去除多酚的核桃粕为原料,利用均匀试验设计优化核桃粕碱溶性蛋白提取条件;利用二次通用组合旋转设计优化双酶法(先胃蛋白酶后胰蛋白酶分段酶解)制备核桃粕碱溶性蛋白肽工艺;对比三种不同酶解体系制备的酶解液的抗氧化性活性,期望找到生物活性更强、更安全的核桃粕多肽,为核桃饼粕综合开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
核桃饼粕 迪庆香格里拉舒达有机食品有限公司,除多酚,晒干,打粉备用;10种混合乳酸菌 课题组张希老师赠送;胃蛋白酶(酶活力单位≥1200.0 U/g) 生化试剂BR,国药集团化学试剂有限公司;胰蛋白酶(酶活力单位≥2500 U/mg) 生化试剂BR,中国医药集团上海化学试剂公司;考马斯亮蓝G-250试剂 分析纯,BioFoxx公司;铁氰化钾、三氯化铁 分析纯,天津市风船化学试剂科技有限公司;三氯乙酸 分析纯,天津市光复精细化工研究所;DPPH 优级纯,源叶生物科技有限公司;TPTZ、ABTS 分析纯,Solarbio公司;其他试剂 市售国产分析纯。
L5S紫外分光光度计 上海仪电分析仪器有限公司;CP214电子天平 奥豪斯仪器(上海)有限公司;ST3100 pH计 奥豪斯仪器(常州)有限公司;SC-3614低速离心机 安徽中科中佳科学仪器有限公司;INFINITEM200 PRO酶标仪 瑞士TECAN;BSD-WX3350卧式智能精密型恒温式摇床培养箱 上海博迅医疗生物仪器股份有限公司。
1.2 实验方法
1.2.1 不同溶解性核桃粕蛋白提取 参照赵见军等[7,16-17]的方法,并做适当修改,操作流程如下:核桃饼粕→加入不同溶剂→调pH→超声波清洗机超声处理5次→恒温水浴提取→离心→收集上清液。
称取10 g核桃粕,加不同溶剂定容至250 mL,用超声波清洗机超声处理5次(每次超声1 min后停1 min再超声,如此超声处理5次),在40 ℃恒温水浴锅中提取60 min后 3500 r/min离心20 min,收集上清液。核桃粕水溶性蛋白提取加双蒸水,核桃粕盐溶性蛋白提取加入0.6 mol/L的氯化钠溶液,核桃粕醇溶蛋白提取加75%的乙醇溶液,核桃粕酸溶蛋白提取加入1 mol/L的盐酸溶液,调节pH至3,核桃粕碱溶蛋白提取加入1 mol/L的氢氧化钠溶液,调pH至8.5。
1.2.2 均匀试验优化核桃粕碱溶性蛋白提取条件 试验以蛋白质含量为指标,采用DPS软件中均匀实验设计方法,对核桃饼粕中蛋白质的提取条件进行优化,确定最佳的提取溶液pH、温度、时间、料液比及提取次数。各因素的考察水平如下:溶液的pH选择6.5、7、7.5、8、8.5、9、9.5、10、10.5、11,10个水平;温度(℃)选择20、25、30、35、40、45、50、55、60、65,10个水平;时间(min)选择30、40、50、60、70、80、90、100、110、120 10个水平;料液比(g/mL)选择1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40、1∶45、1∶50、1∶55,10个水平;提取次数选择1、2两个水平。
1.2.3 双酶法制备核桃粕碱溶性蛋白肽工艺优化
1.2.3.1 二次通用旋转组合设计优化胃蛋白酶酶解条件 试验选取选底物质量浓度(g/100 mL)、加酶量(U/g)、温度(℃)、pH、时间(min)5个因素,利用二次通用旋转组合设计对胃蛋白酶酶解核桃粕蛋白条件进行优化,胃蛋白酶酶解核桃粕碱溶性蛋白的因素水平编码见表1。
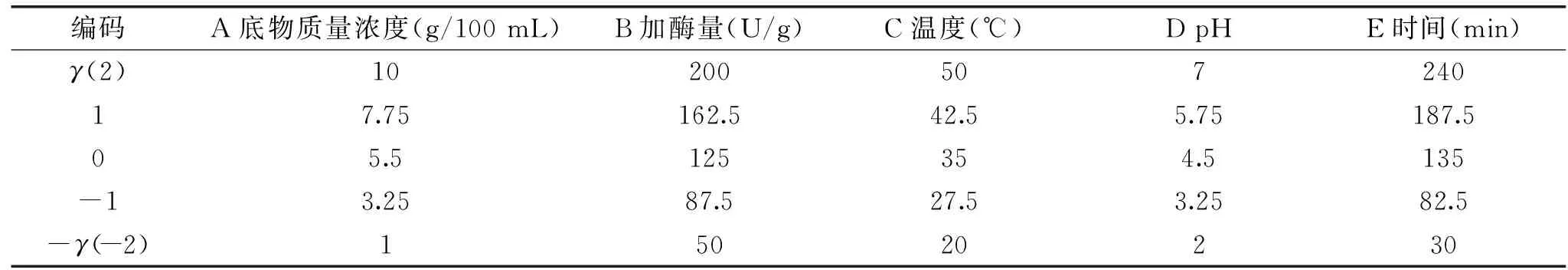
表1 胃蛋白酶酶解核桃粕蛋白因素水平编码表Table 1 Factor level coding table of enzymatic hydrolysis of walnut meal protein by pepsin
1.2.3.2 二次通用旋转组合设计优化胰蛋白酶酶解条件 试验选取加酶量(U/g)、温度(℃)、pH、时间(min)4个因素,利用二次通用旋转组合设计,对胰蛋白酶酶解经胃蛋白酶酶解的核桃粕多肽条件进行优化,胰蛋白酶解核桃粕多肽的因素水平编码见表2。

表2 胰蛋白酶解核桃粕多肽因素水平编码表Table 2 Factor level coding table of enzymatichydrolysis of walnut meal peptide by trypsin
1.2.3.3 双酶体系制备核桃粕碱溶蛋白酶解液 按照1.2.2优化结果提取核桃粕碱溶性蛋白,按照上述1.2.3.1及1.2.3.2优化的酶解条件,采用双酶体系制备核桃粕碱溶蛋白酶解液,测定其抗氧化性能。

表3 牛血清白蛋白标准曲线各试剂添加量表Table 3 Reagent addition scale in standard curve of bovine serum albumin
1.2.4 体外模拟胃肠道消化体系制备核桃粕碱溶蛋白酶解液
1.2.4.1 模拟胃消化 取提前配制好的胃液17 mL和3.0091 g核桃粕碱溶性蛋白粉装于透析袋中,置于盛有75 mL胃电解质溶液的100/150 mL烧杯中,用锡箔纸密封好存放溶液的烧杯,放在37 ℃的恒温式摇床振荡培养箱中消化4 h后,向消化液加入0.168 mol/L Na2CO33.0 mL终止胃消化。
1.2.4.2 模拟肠消化 取配制好的肠液28 mL、已终止胃反应阶段的核桃粕蛋白胃消化产物2 mL装于透析袋中,置于盛有125 mL肠电解质溶液的250 mL烧杯中,用锡箔纸将存放溶液的烧杯密封包好以达到避光的目的,然后在37 ℃的恒温式摇床振荡培养箱中消化6 h。将消化液置于90 ℃水浴10 min,冷却后3500 r/min离心10 min,收集上清液4 ℃保存备用。用上清液测定其抗氧化性能。
1.2.5 体外模拟胃肠道消化+混合乳酸菌体系制备核桃粕碱溶蛋白酶解液 取10 mL经过体外模拟胃肠道消化后的核桃粕碱溶蛋白水解液,加入1 mL含有10种混合乳酸菌溶液后置于37 ℃的培养箱培养24 h,然后置于90 ℃水浴10 min,冷却后3500 r/min离心10 min,收集上清液4 ℃保存备用,并测定其抗氧化活性。
1.2.6 核桃粕蛋白含量测定 以考马斯亮蓝法(参照柳荫等[18]的方法,并做适当修改)测定各提取液中蛋白质含量,按下式计算提取液中的蛋白含量:

式中:X为在标准曲线上查得的蛋白质含量,mg/mL;V为提取液总体积,mL;n样品测定时的系数倍数;m提取时称的核桃粕总质量,g。
以牛血清白蛋白标准液中的蛋白质含量为横坐标,吸光度值为纵坐标绘制标准曲线,得标准曲线方程为:y=0.0055x+0.0839,决定系数R2=0.9996,此标准曲线的线性相关性良好,此标准曲线可以用来测定蛋白质含量在20~200 μg的提取液。
1.2.7 核桃粕蛋白水解度测定 参照颜小捷等[19-21]的茚三酮比色法,略做修改。
1.2.7.1 制备完全水解核桃蛋白液的方法 称量0.1731 g(蛋白含量约为50 mg)核桃粕蛋白粉,加入50 mL 6 mol/L的盐酸,置沸水浴中冷凝回流水解4 h,冷却后过滤,将滤液用旋转蒸发仪浓缩至1~5 mL左右,加蒸馏水9 mL,滴加1滴酚酞指示剂,用3 mol/L氢氧化钠溶液调至微红,用去离子水定容至50 mL,摇匀后离心,收集上清液备用。
1.2.7.2 标准曲线的绘制 分别取完全水解液0.1~1.0 mL(每隔0.1 mL取一个样)于25 mL比色管中,用蒸馏水补足至4.0 mL,然后加入1.0 mL pH约为6.0的磷酸缓冲溶液和1.0 mL 2%的茚三酮溶液,充分混匀后沸水浴加热15 min,待冷却后用蒸馏水稀释至25.00 mL,同时以水做空白调零,用紫外分光光度计在570 nm波长下测定各管的吸光度,然后以蛋白质的浓度为横坐标,对应的吸光度值为纵坐标绘制标准曲线,得水解度的标准曲线方程为:y=0.0629x-0.2273,决定系数R2=0.9933,这说明此标准曲线的线性相关性较好,该标准曲线可用于核桃蛋白含量在4~40 μg/mL的样品测定。
1.2.7.3 酶解液水解度的测定 取经水解灭酶的水解液1.0 mL,用蒸馏水稀释至50或25 mL(使测定值在工作曲线的线性部分),取稀释后的水解液4.0 mL,加入1.0 mL pH约为6.0的磷酸缓冲溶液,1.0 mL 2%的茚三酮溶液,沸水浴加热15 min,冷却,蒸馏水稀释至25.0 mL,同时以水做空白实验,用紫外分光光度计在570 nm波长下测定吸光度,并通过标准曲线计算待测样品中蛋白质含量。再按下式计算水解度:
式中:A-查表得蛋白质的质量,mg;B-水解液稀释倍数;m-水解样品中蛋白质质量,μg;V1-水解液的总体积 mL;V2-显色时所用稀释液的体积 mL。
1.2.8 核桃粕多肽体外抗氧化活性测定 参照罗燕等[4-5,11,22]的测定方法略作修改测定核桃粕多肽液的抗氧化性。
1.2.8.1 DPPH自由基清除率的测定 取样品液0.3 mL加入6.0 mL 6.25×10-5mol/L的DPPH溶液中,避光反应20 min,以空气调零,在波长517 nm处测定吸光度值记为Ai;同上操作测定0.3 mL甲醇加入6.0 mL DPPH溶液反应的吸光度记为AC,测定0.3 mL样液与6.0 mL甲醇反应的吸光度记为Aj。按公式计算清除率,以不同浓度的VC同法做标准曲线,依据此标准曲线可计算样品每毫升提取液的抗氧化能力相当于多少mg VC。DPPH自由基清除法测定核桃蛋白多肽抗氧化的标准曲线方程为:y=9.2503x+0.0308,决定系数为R2=0.9976,说明此标准曲线的线性相关性较好,根据该标准曲线测定清除率在3.74%~94%的样品。
1.2.8.2 铁离子还原力的测定 取样液1 mL,加入0.2 mol/L磷酸缓冲液(pH6.6)2.5 mL和1%铁氰化钾溶液2.5 mL,50 ℃水浴20 min后迅速冷却,加入10%三氯乙酸溶液2.5 mL,3000 r/min离心10 min,取2.5 mL上清液于试管,再加入2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,充分混匀,静置反应10 min,在波长700 nm处测定吸光度,以试剂空白(蒸馏水做对照)。以不同浓度的VC同法制作标准曲线,方程为:y=6.0715x+0.0736,决定系数为R2=0.9944,说明此标准曲线的线性相关性较好,根据该标准曲线计算每毫升提取液的抗氧化能力相当于多少mg VC。
1.2.8.3 FRAP法测定样品抗氧化性能 取0.1 mL样品溶液于10 mL离心管中,加入1.9 mL FRAP试剂,37 ℃水浴10 min,以蒸馏水做空白调零,在波长593 nm处测吸光度值。以不同浓度的VC同法制作的标准曲线,标准曲线方程为:y=12.476x+0.0084,决定系数R2=0.9993,说明该标准曲线的线性相关性良好,根据标准曲线计算样品每毫升提取液的抗氧化能力相当于多少mg VC。
1.2.8.4 ABTS法测定样品抗氧化性能 取0.025 mL的样品溶液于试管中,加入2 mL ABTS+工作溶液,充分混合,6 min后在波长734 nm处测定吸光度(Ai)。测定2 mL ABTS+溶液与0.025 mL甲醇混合后在波长734 nm处的吸光度(A0);在波长734 nm处测定2 mL甲醇溶液与0.025 mL样品溶液的吸光度(Aj)。按下式计算自由基清除率:

以不同浓度的VC同法制作的标准曲线,标准曲线方程为:y=3.4804x-0.0162,决定系数R2=0.9948,说明该标准曲线的线性相关性良好,根据标准曲线计算样品每毫升提取液的抗氧化能力相当于多少mg VC。
1.3 数据处理
本实验采用DPS 9.50软件多所有数据进行回归分析,拟合出变量之间的方程,用于最优条件的选择。
2 结果与分析
2.1 不同溶解性核桃粕蛋白提取结果
不同溶解性核桃粕蛋白提取液的蛋白质含量如图1所示。由图1可知,根据蛋白质含量从高到低依次为核桃粕碱溶性蛋白、核桃粕盐溶蛋白、核桃粕水溶蛋白、核桃粕酸溶蛋白、核桃粕醇溶蛋白。基本符合Li等[23]的结果:谷蛋白70.1%,醇蛋白5.5%,球蛋白17.6%,清蛋白6.8%,且其研究表明,水溶性和碱性蛋白具有更强的免疫调节作用,因此,本研究以含量高、活性强的核桃粕碱溶性蛋白为原料进行下一步酶解实验。
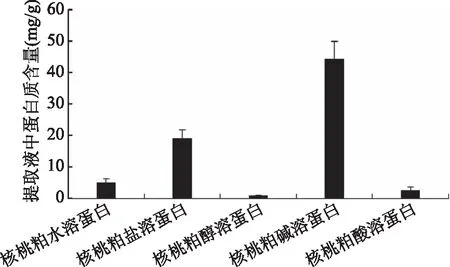
图1 不同溶解性核桃粕蛋白总提取液蛋白质含量测定结果Fig.1 Determination of protein content in total extract ofdifferent soluble walnut meal protein
2.2 碱溶性核桃粕蛋白提取工艺优化

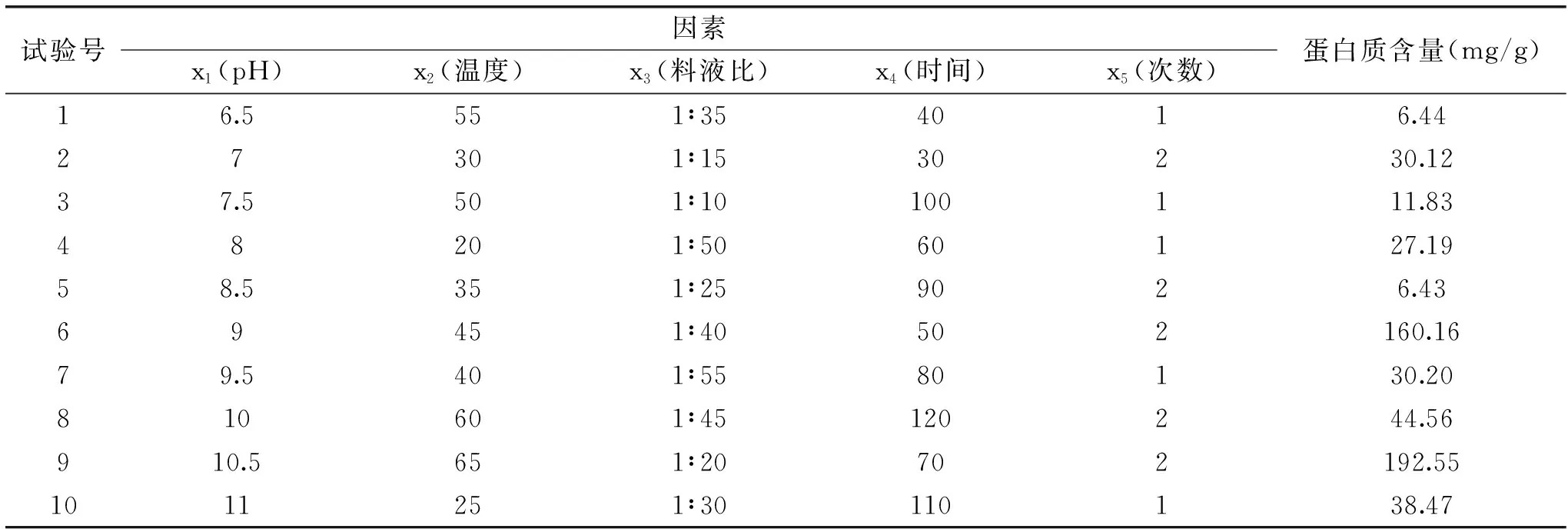
表4 核桃饼粕中蛋白质提取均匀试验设计方案与结果Table 4 Design scheme and results of protein extraction uniformity test in walnut meal
回归方程相关系数为r=0.9999,F值=470.3223(P=0.0356<0.05),说明此回归方程显著,能代表变量之间的关系。对该回归方程的各因素进行通径分析,得到决定系数为0.99973、剩余回归系数为0.01630,说明此试验误差较小,失拟不显著,由以上分析可知此回归分析有效。
通过回归方程模拟分析得,碱法提取核桃粕蛋白的最佳提取条件为:X1=11、X2=64.96、X3=20.81、X4=69.14、X5=2,在此工艺条件下,用方程预测核桃粕碱溶性蛋白提取量219.59 mg/g。
为验证最佳理论条件的有效性,结合实际情况,将条件设定为提取溶液pH11,提取温度65 ℃,提取时间70 min,料液比为1∶21 (g/mL),提取次数2次,在此条件下,提取核桃粕中的蛋白,重复3次试验,三次实验的平均值为221.6233 mg/g,略高于回归方程预测结果,这说明本法获得的最佳提取条件可以应用于碱法提取核桃粕中的蛋白质。但是与崔莉等[24]的核桃粕蛋白提取量相比,此法提取的蛋白质量偏低,其原因主要是测定蛋白质含量的方法不同,崔莉等的测定方法是凯氏半微量定氮法,此法测定时将样品中的所有含氮物质都计为蛋白质,会使得蛋白质含量比实际偏高,而本实验的测定方法-考马斯亮蓝法是染料与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合,在595 nm下测定的吸光度值,其吸光度值与蛋白质浓度成正比,不同于凯氏半微量定氮法以氮含量计算蛋白质含量,考马斯亮蓝法与凯氏半微量定氮法相比,测定出来的蛋白质含量更接近于实际。
2.3 双酶法制备核桃粕多肽的工艺优化

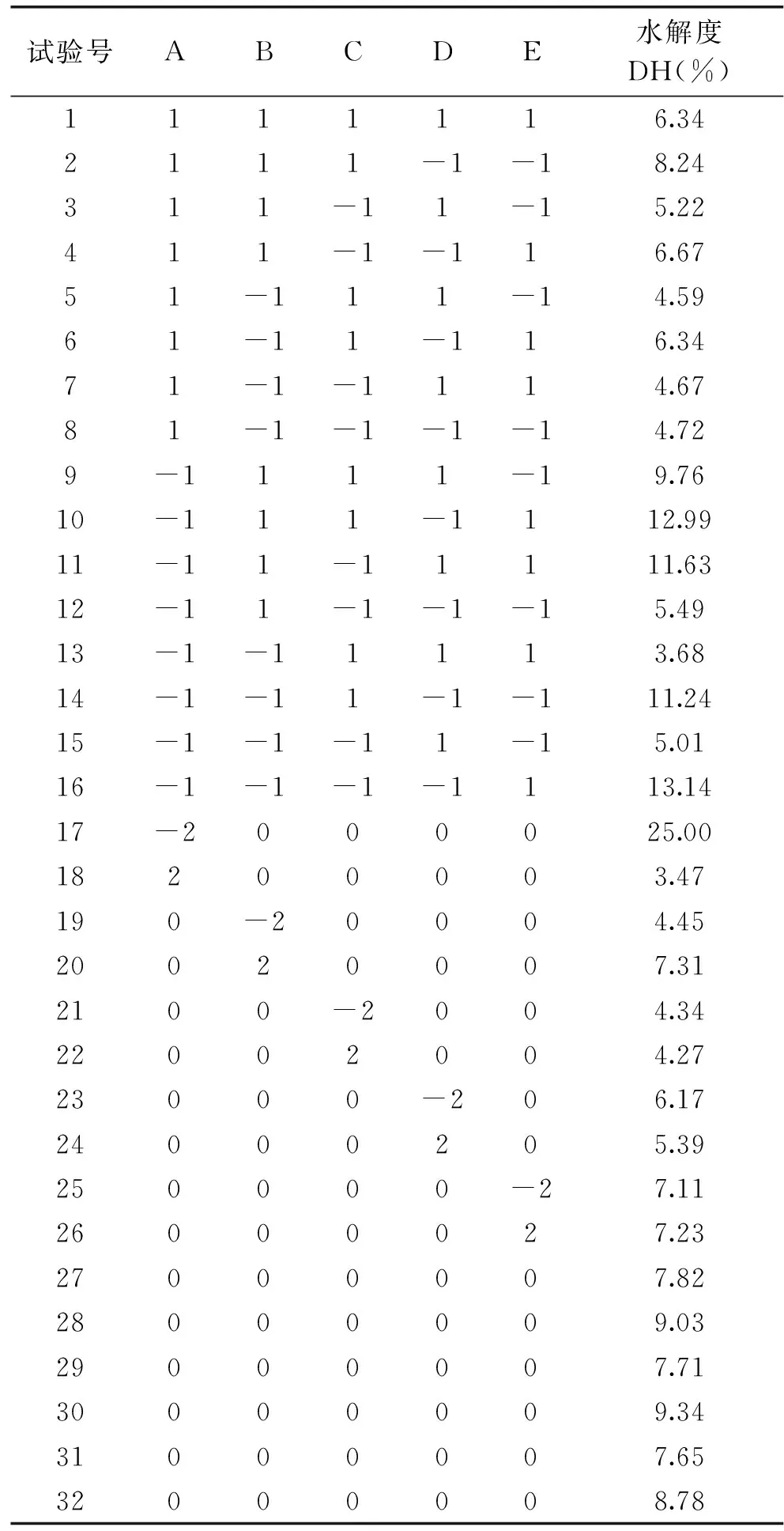
表5 胃蛋白酶酶解核桃粕蛋白试验设计方案与结果Table 5 Experimental design and results ofenzymatic hydrolysis of walnut meal protein by pepsin
回归方程的相关系数为r=0.9139,F值=3.2004(P=0.0218<0.05),说明此回归方程较显著,能代表变量之间的关系。对该回归方程的各因素进行通径分析,得到决定系数为0.8352,剩余通径系数为0.40598,这说明通径分析成立。由以上分析可说明该回归分析有效。
通过回归方程分析得到胃蛋白酶酶解核桃粕蛋白的最佳条件为:底物质量浓度为1 g/100 mL、加酶量为133.5258 U/g、温度为39.41 ℃、pH2.35、时间138.5 min,在此工艺条件下酶解,方程预测核桃粕多肽液水解度为21.67%。
为验证最佳组合的有效性,结合实际情况,最终在底物质量浓度为1 g/100 mL、加酶量为133.53 U/g、温度为40 ℃、pH2.4、时间139 min,在此条件下,用胃蛋白酶酶解核桃粕蛋白,重复3次试验,三次试验的水解度为25.90%±1.00%,略大于回归方程预计结果,且略高于二次通用旋转组合设计各组合,同时也远高于罗燕等[4,19]测定的水解度,本实验所获得的最佳条件可以于胃蛋白酶酶解核桃粕碱溶性蛋白。


表6 胰蛋白酶酶解核桃粕蛋白试验设计及实施方案Table 6 Experimental design and implementation scheme ofenzymatic hydrolysis of walnut meal protein by trypsin
回归方程的相关系数为r=0.8338,F值=2.6061(P=0.0346<0.05),说明此回归方程显著,能代表变量之间的关系。对回归方程的各因素进行通径分析得到决定系数为0.6952、剩余通径系数为0.5521,说明此通径分析成立。综合分析结果证明此回归分析有效。
通过回归方程模拟分析得到胰蛋白酶酶解核桃粕多肽的最佳组合为加酶量为800 U/g、温度为20 ℃、pH为6、酶解时间为240 min,在此条件下酶解,预测核桃粕多肽液的水解度为45.40%。为验证最佳组合的有效性,完全采用模拟得到的工艺参数进行控制,用胰蛋白酶酶解核桃粕多肽,重复3次试验,三次试验的水解度平均值为35.57%±3.00%,比回归方程计算结果略小,原因是酶解前需要调节核桃粕多肽液的pH导致底物浓度降低,且略高于二次通用旋转组合设计各组合,同时也高于使用单一胃蛋白酶和胰蛋白酶进行酶解的水解度,这说明由二次通用旋转组合设计的结果经二次多项式逐步回归分析获得的最佳组合可以应用于胰蛋白酶酶解核桃粕多肽。
2.4 体外抗氧化活性测定结果
测定三种不同方式制备的核桃粕蛋白酶解液的DPPH自由基清除率、铁离子总还原力、总抗氧化能力(FRAP法)和ABTS自由基清除率,并根据该标准曲线计算每毫升提取液的抗氧化能力相当于多少mg VC,结果见表7。
由表7实验结果显示,三种酶解液抗氧化能力整体由强到弱为双酶法酶解液、体外模拟胃肠道+混合乳酸菌酶解液、体外模拟胃肠酶解液;双酶体系蛋白的底物浓度为0.01003 g/mL,体外模拟胃肠体系蛋白的底物浓度为0.01003 g/mL,体外模拟胃肠道+混合乳酸菌体系蛋白的底物浓度为0.00919 g/mL,底物浓度基本在同一水平,体外模拟胃肠酶解液的抗氧化能力低于双酶法酶解液,体外模拟胃肠酶解与双酶法酶解相比,区别在于控制的两个酶解的条件不同,提示用本实验方法优化的酶解条件更有利于酶解,可能试验优化的酶解条件增加了水解度,从而提升了抗氧化能力;体外模拟胃肠道+混合乳酸菌酶解液的底物为体外模拟胃肠酶解液,其抗氧化性较单纯体外模拟胃肠酶解液均有较大提升,说明肠道有益菌会增加核桃粕碱溶蛋白酶解液抗氧化活性,提示其抗氧化活性的增强主要与蛋白多肽变化有关,而这种变化是蛋白水解度增加引起多肽含量增加引起的,还是由于不同的多肽结构引起的,需要后续进一步研究,也有可能两者都有。本试验优化的双酶解法及混合乳酸菌均能增加核桃粕碱溶蛋白酶解液的抗氧化活性,因此,如果采用双酶解法+混合乳酸菌酶解体系处理核桃粕蛋白,有望得到活性更强的核桃粕多肽,此内容需要进一步试验验证。

表7 不同酶解液的抗氧化能力Table 7 Antioxidant capacity of different enzymatic hydrolysates
3 结论
核桃粕蛋白质最佳提取条件为:提取溶液的pH11、提取温度65 ℃、提取时间70 min、料液比为1∶21 (g/mL),提取2次,在此条件下提取液蛋白含量为221.6233 mg/g。双酶法制备核桃粕多肽工艺条件分为两个阶段,第一阶段胃蛋白酶酶解阶段,其最佳条件为:底物质量浓度为1 g/100 mL、加酶量为133.53 U/g、温度为40 ℃、pH2.4、时间139 min,在此条件下酶解,核桃粕多肽酶解液水解度25.90%;第二阶段胰蛋白酶酶解阶段,其最佳条件为:加酶量800 U/g、温度20 ℃、pH为6、酶解时间240 min,在此条件下酶解,核桃粕多肽酶解液的水解度为35.57%。三种酶解液的总抗氧化能力VC当量值分别为:双酶酶解液0.0516 mg/mL,体外模拟胃肠道消化酶解液0.0634 mg/mL,体外模拟胃肠道消化+混合乳酸菌酶解液0.0411 mg/mL,用双酶、体外模拟胃肠道消化、体外模拟胃肠道消化+混合乳酸菌三种体系制备的核桃粕蛋白酶解液均具有抗氧化性活性,而双酶法制备的核桃粕酶解液具有较强的抗氧化活性。

