Na0.44MnO2在碱性溶液中的电化学机制
李慧,刘双宇,袁天赐,王博,盛鹏,徐丽,赵广耀,白会涛,陈新,陈重学,曹余良,*
1全球能源互联网研究院有限公司,先进输电技术国家重点实验室,北京 102211
2武汉大学化学与分子科学学院,湖北省电源材料与技术重点实验室,武汉 430072
3武汉大学动力与机械学院,水力机械过渡过程教育部重点实验室,武汉 430072
1 引言
化石能源的短缺和自然环境的恶化等问题日益严重,迫使人们寻找和发展可再生清洁能源。但是,可再生能源具有随机性、波动性与间歇性的特征,需要大规模储能系统的整合转换才能被电网消纳。在众多储能方式中,电化学储能以其较强的灵活性和较广的适用性而备受关注。锂离子电池作为综合性能最优异的电化学储能技术,在电动汽车市场占据了主导地位,但锂资源储量有限,且分布不均,这在一定程度上制约了锂离子电池在电网中的大规模应用。钠离子电池的工作原理与锂离子电池相似,且钠元素自然丰富度高、价格低廉,更适合大规模储能应用的需求1–3。与有机钠离子电池相比,水溶液钠离子电池所使用的电解液不燃、无毒,电池的安全性能和环境友好性大大提高。同时水溶液电解液多采用廉价的钠盐,显著降低了电池的成本4–6。
Na0.44MnO2作为一种钠离子电池正极材料已经被广泛研究7–10,其三维的隧道结构有利于电极的循环稳定性和倍率性能,且钠、锰元素资源丰富、无毒、环境友好、合成方法简单易产业化。研究表明,Na0.44MnO2在水溶液中具有优异的结构稳定性,因此也被用做水溶液钠离子电池的正极材料。虽然它的理论容量可达121 mAh·g-1,但在目前大多数中性水溶液体系中,其实际比容量仅有30–40 mAh·g-1,远远小于其理论容量11–14。
最近,我们首次报道了一种新型碱性水溶液Zn/Na0.44MnO2电池,该电池分别以Na0.44MnO2和Zn作为正极和负极,6 mol·L-1NaOH作为电解液。在充放电时,Na0.44MnO2正极发生钠离子的可逆脱嵌,负极则为[Zn(OH)4]2-和Zn之间的转换反应。在1.1–1.95 V (vsZn/Zn2+)的充放电窗口内,Na0.44MnO2的可逆充放电容量达到80 mAh·g-1,且具有良好的循环稳定性,展现了潜在的应用前景。为了进一步提高其比容量,将电压窗口拓宽为0.3–1.95 V时,Na0.44MnO2电极在1.0 V (vsZn/Zn2+)处出现了一个很长的放电平台,使得首周放电比容量高达275 mAh·g-1,远远超过了其理论脱嵌钠容量(121 mAh·g-1)15。对于这部分多出的容量,通过X射线粉末衍射仪(XRD)和电感耦合等离子体发射光谱(ICP-AES)分析发现放电过程中有Na+析出和Mn(OH)2的生成,然而该过程的详细电化学机制和结构转变过程仍还不清楚,如Na+何时开始从结构中释放出来、Mn(OH)2相何时开始生成,在此区间是否有其他离子的嵌入,该超额容量是否可逆等,理清这些问题可帮助理解水溶液钠离子电池嵌入材料结构稳定性的影响因素和实际可用容量。
在本工作中,我们通过对不同放电阶段下电极的XRD、扫描电子显微镜(SEM)和ICP-AES分析,详细研究了Zn/Na0.44MnO2电池在碱性溶液中过放电(1.1–0.3 V)机理。结果表明该过程可分为两个阶段:第一阶段(1.0 V平台区)为H+在Na0.44MnO2的隧道结构中嵌入,此时Na0.44MnO2能保持结构的稳定;第二阶段(1.0 V以下)包含了H+的嵌入、结构转变和Na+的脱出,即当隧道结构中的Na+空位全部被H+占据时,隧道结构开始崩塌,同时伴随着Mn(OH)2相的生成。
2 实验部分
2.1 材料合成
苯酚-甲醛辅助溶胶凝胶法合成Na0.44MnO2:首先按照0.46 : 1的化学计量比称取CH3COONa (CP,≥ 98.5%,Sinopharm)和Mn(CH3COO)2(AR,≥99.0%,Sinopharm),溶于30 mL无水乙醇(AR,≥99.7%,Sinopharm)和10 mL去离子水的混合溶液中,然后在油浴锅中70 °C加热搅拌30 min。随后相继加入0.3 g的苯酚(AR,≥ 99.0%,Sinopharm)和0.4 mL甲醛(AR,37.0%–40.0%,Sinopharm)。将温度升至80 °C,加热搅拌至形成凝胶。在80 °C下真空干燥12 h后,用研钵研磨成粉末。然后在马弗炉中空气气氛下900 °C煅烧15 h得到最终的Na0.44MnO2产物。
2.2 材料结构表征
采用ICP-AES (IRIS Intrepid II XSP,USA)对不同放电状态下的产物进行元素分析。采用SEM(ZEISS Merlin 132 Compact,Germany)表征样品颗粒的形貌,通过牛津INCAPentalFETx3能谱探头对样品进行EDS mapping分析。采用XRD (Bruker D8 ADVANCE,Germany)表征样品的结构和物相组成。
2.3 电化学测试
以Na0.44MnO2为活性物质,导电炭黑SP为导电剂,60% (w)的PTFE乳液为粘结剂,活性物质 :导电剂 : 粘结剂按质量比8 : 1 : 1制备Na0.44MnO2电极。首先把活性材料和导电碳在玛瑙研钵内研磨均匀。再取粘结剂放于小烧杯中,加少许异丙醇破乳,随后加入研磨好的粉末材料,在红外灯下调浆、烘干,最后在对辊机上碾压成膜。膜片放入100 °C真空烘箱中烘烤6 h。电池组装是在大气环境下进行的,剪取1 cm2大小的膜片(5 mg·cm-2)压制在不锈钢网上作为工作电极,砂纸打磨后的锌片(厚度约180 μm)为参比电极和对电极,6 mol L-1NaOH作为电解液,在U型玻璃管中组装成碱性水溶液电池。采用电化学工作站(Autolab PGSTAT128N,Eco Chemie,Switzerland)进行循环伏安测试,扫速为10 mV·s-1。在电池测试系统(LANDCT2001A,China)上进行恒流充放电测试,比容量基于Na0.44MnO2的质量计算,电流密度1C相当于121 mA·g-1。
3 结果与讨论

图1 (a) Na0.44MnO2电极的循环伏安曲线,扫描速率为10 mV·s-1;(b) Na0.44MnO2电极的首周充放电曲线,电流密度为0.5C,电压范围为1.95–0.3 V;(c) Na0.44MnO2电极在1.95–0.3 V电压范围内的放电曲线Fig. 1 (a) Cyclic voltammograms of the Na0.44MnO2 electrode at a scan rate of 10 mV·s-1; (b) The first charge-discharge profiles of the Na0.44MnO2 electrode at a current rate of 0.5C in the potential region of 1.95–0.3 V; (c) The discharge profiles of the Na0.44MnO2 electrode in the potential region of 1.95–0.3 V.
图1a是Na0.44MnO2电极前三周的循环伏安(CV)曲线,扫描速率为10 mV·s-1,扫描范围为1.95–0.3 V。从图中可以看到,在首周的氧化过程中出现了三个明显的氧化峰,并在随后的还原过程中(1.95–1.1 V)出现了四个还原峰,和文献中报道的Na0.44MnO2在非水电解液中的CV曲线一致,这归因于Na0.44MnO2电极在脱嵌钠过程中发生了复杂的相变11,12,16–18。当电位继续向阴极方向扫描时,在0.88 V处出现了一个宽的还原峰,而在以往报道的有机体系钠离子电池和水溶液钠离子电池中并未观测到此峰的存在,说明此时发生的还原反应不只是简单的Na+的嵌入。在第二周的阳极扫描过程中,在1.34 V附近出现一个宽的氧化峰,峰电位和峰形与第一周中0.88 V处的还原峰差异很大,说明该步反应的可逆性较差。虽然在首周阳极扫描过程中出现的三个氧化峰依然存在,但峰形、峰位置和峰高均发生了变化,其原因可能是首周0.88 V处的还原反应改变了Na0.44MnO2的结构。在第二周的阴极扫描过程中,首周在1.95–1.1 V电压范围内出现的四个还原峰基本消失,仅在1.03 V处出现了一个宽的还原峰。在第三周扫描时,CV曲线上只在0.94 V/1.39 V处出现一对明显的氧化还原峰,说明此时Na0.44MnO2的结构已经发生了转变,或是生成了其他的物质,导致反应机理也随之发生变化。图1b是Na0.44MnO2电极在1.95–0.3 V电压区间内的首周充放电曲线,电流密度为0.5C(1C=121 mA·g-1)。可以看到,在首周的充电过程中出现了三个小的充电平台,首周充电比容量为49.2 mAh·g-1(基于Na0.44MnO2的质量);在放电过程中,1.95–1.1 V电压范围内出现了四个小的平台,当继续放电时,在1.0 V处出现一个宽的电压平台,总的放电比容量达到275 mAh·g-1。Na0.44MnO2电极的首次充放电曲线与图1a中的CV扫描结果一致。
为了详细探究Na0.44MnO2在1.1 V以下的放电机理,我们首先通过XRD研究了Na0.44MnO2在放电过程中的晶体结构变化。如图1c所示,我们选取了放电比容量为80 mAh·g-1(Discharge-80,即1.0 V放电平台开始的位置)、100 mAh·g-1(Discharge-100)、120 mAh·g-1(Discharge-120)、150 mAh·g-1(Discharge-150)、200 mAh·g-1(Discharge-200)、250 mAh·g-1(Discharge-250) 以 及 放 电 到 0.3 V(Discharge-0.3)七个不同放电深度,对其中间产物的晶体结构进行了表征。同时为了确定Na0.44MnO2结构在充放电循环过程中的变化,我们也对循环10周后的Na0.44MnO2电极(10th cycle)进行了XRD表征。如图2a–d所示,Discharge-80和Discharge-100处的中间产物都能保持和原始电极(NMO-pristine)一样的隧道结构(JCPDS No.27-0750)。但当放电到120 mAh·g-1时,在XRD谱图18.8°、36.6°和49.9°处开始出现一些小的衍射峰,并且随着放电深度的增大,衍射峰的强度也越来越大。到Discharge-0.3时,位于18.8°的衍射峰的强度已经与位于19.5°的Na0.44MnO2的特征衍射峰强度相当。通过与标准PDF卡片进行比对,发现这些衍射峰应归属于Mn(OH)2(JCPDS No.18-0787)。而在循环10周后,Na0.44MnO2几乎全部转变为Mn3O4(JCPDS No.80-0382)。
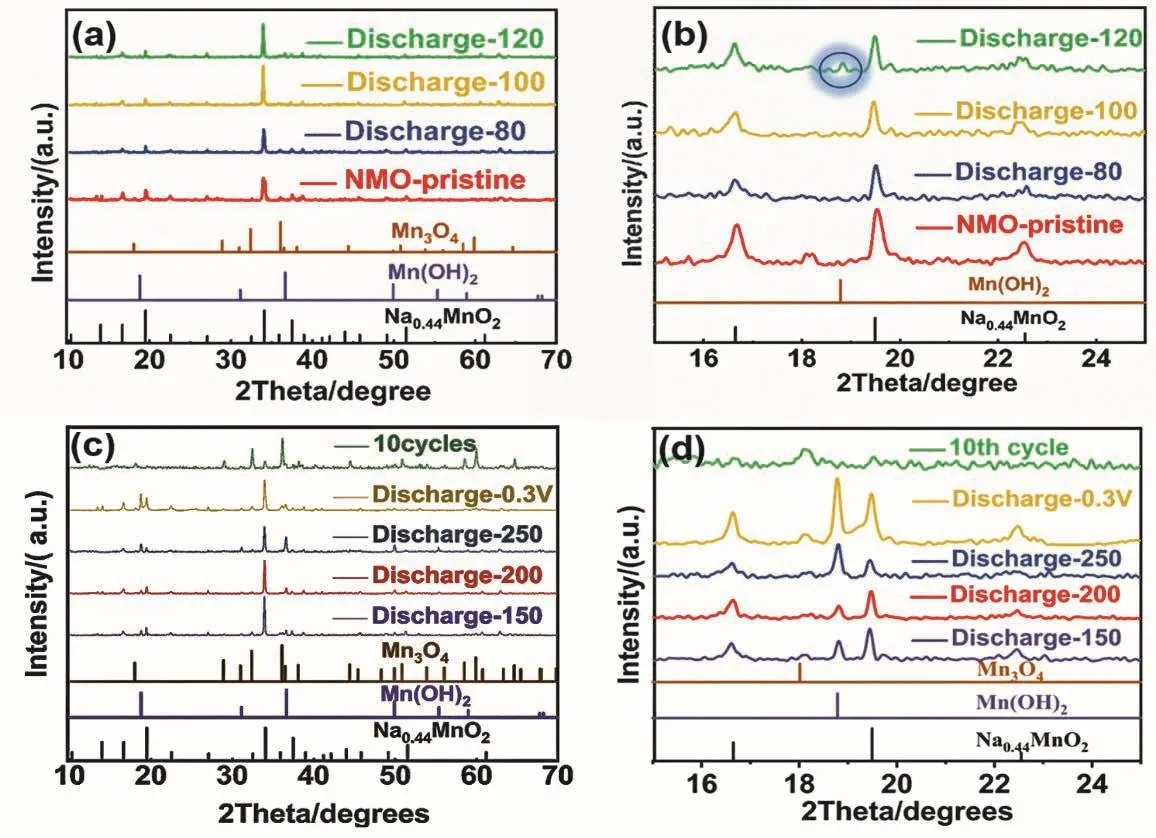
图2 (a–d) Na0.44MnO2电极在不同放电深度下以及循环10周后的XRD图谱Fig. 2 (a–d) The XRD patterns of the Na0.44MnO2 electrode at different discharge depths and after 10 cycles.

图3 Na0.44MnO2电极在不同放电深度及周次下的的SEM图像Fig. 3 SEM images of the Na0.44MnO2 electrode at different states.
为了更直观地观察Mn(OH)2的生成,我们通过SEM表征了Na0.44MnO2电极在不同放电深度及周次下的形貌。如图3所示,充放电之前的Na0.44MnO2电极表面平整,并在一些区域能隐约观察到裸露的Na0.44MnO2颗粒(图3a)。Discharge-80和Discharge-100时的电极仍能保持和原始电极一样的形貌(图3b,c)。然而当放电到120 mAh·g-1时,电极表面开始有一些块状的颗粒出现(图3d),并且随着放电深度的增大,颗粒数量逐渐增加,颗粒尺寸也随之增大(图3e–h)。值得注意的是,颗粒与XRD中Mn(OH)2相均在Discharge-120时开始出现,因此我们推测颗粒应为Mn(OH)2。充放电10周之后,电极表面几乎全部被尺寸更小的块状颗粒所覆盖,此时的块状颗粒应为Mn3O4。说明随着充放电的进行,材料的结构也随之发生了巨大变化。我们进一步通过元素mapping测试了不同放电状态下产物中各元素的分布及含量。图4给出了Discharge-120时放电产物的元素mapping图。如图所示,颗粒中Mn元素和O元素分布均匀,并且在颗粒表面几乎检测不到Na元素。Mn和O所占的原子百分比分别为31.68%和62.44%,原子比接近1 : 2。这些结果进一步说明了Discharge-120时,Na0.44MnO2电极表面生成的块状颗粒应为Mn(OH)2。

图4 Discharge-120时放电产物的元素mapping图Fig. 4 The elemental mapping images of the formed bulk particle at Discharge-120.
紧接着,我们又测试了Na0.44MnO2电极在不同放电深度及周次下的Na/Mn原子比,Discharge-80、Discharge-100、Discharge-120、Discharge-150、Discharge-200、Discharge-250、Discharge-0.3以及第10个循环时的Na/Mn原子比分别为0.56、0.55、0.53、0.49、0.41、0.31、0.27和0.17。可知,在1.0 V平台前期电极中Na+含量基本保持不变,Na/Mn比大致稳定在0.56左右,然而自Discharge-120起,有少量Na+从电极结构中释放出来,并且随着放电深度的增大,Na+在材料中含量越低,循环10周后Na/Mn比降至0.17。根据钠离子电池的工作原理,放电时,材料发生还原反应,Na+应该嵌入到正极材料中以补偿电荷,电极中Na+的含量应随着放电的进行而逐渐增加。然而测试结果显示Na+含量不增反降,说明放电过程中(在1.0 V以下)Na+并未嵌入到正极材料中。考虑到电解液体系中除了H+外再无其他阳离子可以补偿电荷,且在此电位下也不存在氢的析出反应,因此我们断定在1.0 V以下的放电过程中,Na0.44MnO2电极实现电荷补偿过程的应是H+的嵌入。
H+和金属离子的共嵌入并不是一种少见的现象,在水溶液锂离子电池中,H+共嵌入一直存在,放电时,H+嵌入和碱金属离子嵌入属于一对竞争反应4,19–22。与Na+相比,H+具有更小的离子半径,因此在某些电位下应该更容易嵌入到NaxMnO2中,甚至在已报道的一些锌锰电池中,H+能在二氧化锰正极中可逆脱嵌23–25。然而当NaxMnO2隧道结构中的钠离子空位完全被H+所占据时,H+的进一步嵌入将导致晶体结构内电荷排斥加剧,隧道结构崩塌而形成Mn(OH)2新相,同时伴随着Na+从结构中释放出来。从电化学研究看,一种离子嵌入而引发另一种离子释放的电化学过程鲜有报道,而对此类过程的理解可以丰富多离子电化学嵌入反应知识。
根据前面的分析讨论,我们可以明确在碱性条件下NaxMnO2电极在1.1 V以下的放电机理。在Discharge-80之前,电极发生可逆的Na+脱嵌反应,而放电至Discharge-100,NaxMnO2正极能维持隧道结构的稳定(图2b和d),电极中Na+含量基本保持不变,暗示着这部分容量属于H+嵌入到NaxMnO2中占据Na+的空位。根据Na0.44MnO2电极理论比容量计算,每20 mAh·g-1的容量则对应每摩尔Na0.44MnO2分子得失0.07 mol的电子,Discharge-80到Discharge-100时,大约有0.08 mol H+嵌入(考虑到0.01 mol Na+脱出),则此阶段发生的电化学反应应为:
Na0.56MnO2+ 0.07H++ 0.07e-= Na0.55H0.08MnO2
进一步放电至Discharge-120时,若此阶段容量都来源于H+的嵌入,根据20 mAh·g-1容量计算,应有0.07 mol H+嵌入结构,然而H+嵌入量(0.07 mol)已经超出材料所剩Na+空位数(0.66 - 0.56 - 0.07 =0.03 mol),因此,H+过多地嵌入将造成NaxMnO2隧道结构的破坏,并伴随着Mn(OH)2新相的生成,同时Na+(0.56 - 0.53 = 0.03 mol)从结构中释放出来。为了保持电荷平衡,此阶段H+嵌入量应该是0.1 mol (0.07 + 0.03 = 0.1 mol)。由此可以看出,从Discharge-100到Discharge-0.3 V区间,这一阶段的电化学反应方程式可以表示为:
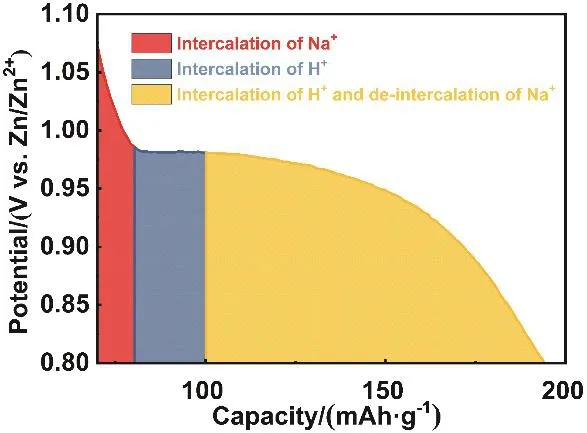
图5 NaxMnO2电极的局部放大的放电曲线Fig. 5 The enlarged partial discharge profile of the Na0.44MnO2 electrode.
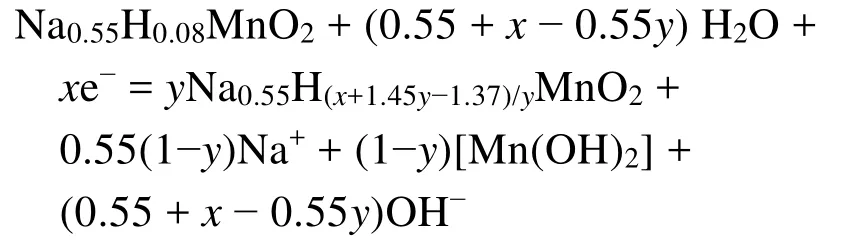
上述讨论的NaxMnO2电极在1.1 V以下的放电机理可以从图5中的放电曲线的局部放大图中清晰地展现出来。从图中可以看到1.0 V以上区间为Na+可逆嵌脱反应,1.0 V以下的放电曲线主要分为两个部分:初始的平台区和随后的斜坡区,分别对应着放电过程的两个步骤。平台区对应着初期H+嵌入到NaxMnO2中Na+的空位,此时隧道结构保持稳定,Na+的含量几乎不变;斜坡区对应H+的进一步嵌入,并伴随着隧道结构的崩塌和Mn(OH)2新相的生成,同时Na+从结构中释放出来,造成电极中的Na+含量降低。从这里可以看出,1.0 V以下区间的超额容量联系着H+的嵌入,造成材料结构转变,因此,这阶段的反应是不可逆的,从而引起循环容量的迅速衰减。
4 结论
我们通过XRD、SEM和ICP-AES等方法详细探究了Na0.44MnO2电极在碱性水溶液中的放电机制。结果表明,在1.95–0.3 V电压区间内Na0.44MnO2电极的放电过程分为三个步骤:(1) 1.0 V以上的电位区间:Na+在隧道结构中可逆嵌入,这与Na0.44MnO2在非水系钠离子电池和中性水溶液钠离子电池中的放电机理一致;(2) 1.0 V平台初期:H+嵌入到NaxMnO2中Na+的空位,此阶段Na0.44MnO2仍能保持稳定的隧道结构;(3)随后的斜坡区:当隧道结构中的钠离子空位完全被H+所占据时,H+的进一步嵌入,将造成材料隧道结构的崩塌,同时伴随着Mn(OH)2新相的生成,而使得Na+从以往的隧道结构中释放出来。由于氢离子具有比钠离子更小的半径,能够嵌入到材料中更小的空位空间,因而产生更高的比容量,但同时也会引起材料的结构破坏,严重影响了其循环稳定性。因此,要实现Na0.44MnO2在碱液中的可逆性,需要严格控制下限电位。

