IRX5促进肝癌细胞的侵袭迁移及其与miR-136-5p靶向关系的验证
代龙光,朱丽英,2,沈婕,钱雯,张競之,朱金凤,许永劼,刘歆蕾,许雯,朱科静,张令,潘卫,3,李兴,4△
肝癌是常见的消化系统肿瘤之一,是全球第六大常见的肿瘤,也是全球癌症死亡的第四大原因[1]。肝细胞癌是原发性肝癌的主要病理类型,约占原发性肝癌的80%[2]。研究显示肝癌的5 年生存率不足20%,侵袭与转移是肝癌重要的生物学特征,转移和复发是引起肝癌患者死亡的主要危险因素[3]。因此探索肝癌转移和侵袭的发生机制是改善肝癌患者生存状况的关键。miR-136-5p属于非编码RNA,其可在转录水平调控下游靶基因RAP2C[4]、MTDH[5]等的表达。有研究表明,miR-136-5p与胃癌[6]、肺鳞癌[7]等肿瘤的发生发展密切相关,但是其在肝癌中的研究报道尚少见。易洛魁族同源盒基因5(Iroquois homeobox gene 5,IRX5)编码蛋白属于核转录因子,过表达IRX5可促进舌鳞状细胞癌的增殖、侵袭和迁移[8],敲低IRX5 表达可抑制前列腺癌细胞活力、增加细胞凋亡[9]。本课题组前期研究发现,IRX5 在肝癌中高表达,运用生物信息学分析发现,IRX5 可能为miR-136-5p 的靶基因[10]。本研究旨在进一步探究IRX5 对肝癌细胞侵袭与迁移的影响,并且验证miR-136-5p 与IRX5 是否存在靶向关系,为肝癌的临床治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验材料 293T 细胞和肝癌SMMC7721 细胞购自中国科学院细胞库。空载质粒(pcDNA3.1)、过表达IRX5 质粒(pcDNA3.1-IRX5)购自上海吉玛制药技术有限公司;敲低IRX5 质粒(sh-IRX5)、阴性对照质粒(sh-NC)由重庆医科大学感染性疾病分子生物学教育部重点实验室提供;pGL3-Control载体由本实验室保存。
1.1.2 主要试剂及仪器 质粒试剂盒购自广州美基公司;高保真酶PrimeSTAR®HS、限制性内切酶XbaⅠ、T4 DNA 连接酶购自大连TaKaRa公司;脂质体2000购自美国Invitrogen公司;DualGlo®Luciferase Assay System 购自美国Promega公司;DMEM、磷酸盐缓冲液(PBS)购自美国Hyclone 公司;胎牛血清购自以色列BI公司;Transwell小室购自美国Corning公司;结晶紫购自碧云天技术有限公司。兔源IRX5 抗体(Abcam公司,英国),鼠源GAPDH 抗体(武汉三鹰生物技术有限公司,中国),山羊抗鼠二抗(Affinity公司,美国),山羊抗兔二抗(Bioworld公司,中国)。倒置荧光显微镜(Nikon公司,日本),DNA 电泳仪(北京六一生物科技有限公司,中国),PCR 仪(ABI公司,美国),多功能酶标仪(Bio-Tek公司,美国)。
1.2 方法
1.2.1 细胞培养及分组 293T 细胞和肝癌SMMC7721 细胞采用10%胎牛血清的完全培养基,置于37 ℃、5%CO2培养箱中培养。取对数生长期肝癌SMMC7721 细胞,按1×106个细胞/孔接种于6孔板中,细胞融合度达60%时进行转染。过表达IRX5 实验设2 组:空载质粒(pcDNA3.1)组和过表达IRX5(pcDNA3.1-IRX5)组;敲低IRX5实验设阴性对照(sh-NC)组和敲低IRX5(sh-IRX5)组;48 h 后观察转染细胞中绿色荧光蛋白的表达情况,并拍照。
1.2.2 Western blot 检测IRX5 的转染效率 肝癌SMMC7721细胞转染72 h 后提取细胞总蛋白,采用BCA 法测定蛋白浓度。采用SDS-PAGE 分离目的蛋白并转印至PVDF 膜上,脱脂牛奶封闭2 h。将PVDF 膜置于一抗GAPDH(1∶2 000)、IRX5(1∶500)中4 ℃孵育过夜,TBST缓冲液洗膜后,将膜置于羊抗鼠二抗(1∶4 000)、羊抗兔二抗(1∶10 000)中室温孵育2 h,ECL显影并用化学发光系统采集数据,Image J软件分析灰度值,计算各组目的蛋白的相对表达量。
1.2.3 划痕实验 将转染后的肝癌SMMC7721细胞接种到6孔板中,当细胞融合度达90%时,用200 μL的吸头划线,PBS清洗后加入无血清培养基,划痕0 h、48 h时拍照。Image J软件测定划痕面积,计算细胞迁移率=(0 h划痕面积-48 h划痕面积)/0 h划痕面积×100%。
1.2.4 Transwell实验 (1)迁移实验参照文献[11]进行。在Transwell 上室加入100 μL 无血清培养基,将600 μL 的完全培养基加入Transwell 下室中,将肝癌SMMC7721 细胞按4×104个/孔加入到上室中,置于培养箱中培养24 h,4%多聚甲醛室温固定15 min,清洗小室并风干,1%结晶紫染色15 min,再次清洗、风干后显微镜下拍照,并计数细胞数量。(2)侵袭实验。将100 μL Matrigel 基质胶加入Transwell 上室中,置于培养箱中孵育2 h。在下室中加入100 μL 完全培养基,37 ℃孵育30 min,后续铺板、固定、染色操作与迁移实验相同。
1.2.5 生物信息学软件预测miRNA 和结合位点 采用miRNA 靶基因预测软件miRanda(http://www.microrna.org)和Targetscan(http://www.targetscan.org)预测可能与IRX5 结合的miRNA及位点。
1.2.6 野生型和突变型IRX5 3'UTR双荧光素酶报告基因质粒的构建 野生型质粒pGL3-IRX5-3'UTR构建方法参照文献[11],采用SMMC7721细胞基因组DNA为模板,IRX5-3'UTR引物上游5'-GCTCTAGATAGATGGCCTTGGCAGTTATTTTTCC-3',下游5'-GCTCTAGAAGAGACCAAGGCAATGGACAGTTTAT-3'进行PCR扩增;50 μL反应体系:2×PrimeSTAR HS(Premix)25 μL、上下游引物(10 μmol/L)各1 μL、基因组DNA模板2 μL、ddH2O 21 μL;反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃延伸3 min。然后进行DNA凝胶电泳,按DNA Marker的指示切取目的片段,并进行胶回收、纯化。采用XbaⅠ酶切IRX5-3'UTR、pGL3-Control载体,用T4 DNA连接酶连接,产物转化到50 μL的DH5α感受态细胞中,并进行涂平板。挑取阳性克隆至液体LB培养基中继续培养14 h,提取质粒,酶切后琼脂糖凝胶电泳初步鉴定;质粒DNA碱基测序委托上海生工公司完成。突变型质粒(pGL3-IRX5-3'UTRMut)委托武汉金开瑞公司合成。
1.2.7 双荧光素酶实验分组及结果测定 取对数生长期293T 细胞以5 000 个/孔接种于96 孔板,进行双荧光素酶实验。根据双荧光素酶报告基因质粒的不同进行分组,设野生型质粒+阴性对照(IRX5-3'UTR-Wt+NC)组和野生型质粒+miR-136-5p(IRX5-3'UTR-Wt+miR-136-5p)组;突变型质粒+阴性对照(IRX5-3'UTR-Mut+NC)组和突变型质粒+miR-136-5p(IRX5-3'UTR-Mut+miR-136-5p)组。按野生型质粒或突变型质粒200 ng/孔,NC 或miR-136-5p 200 nmol/L 进行转染。48 h后检测荧光素酶活性,步骤如下:每孔中加入100 μL 1×PLB 置于摇床上裂解15 min,取澄清的细胞裂解产物10 μL 加入EP 管中,缓慢吹打2~3 次,立即读取荧光素酶活性值;然后加入50 μL 终止液,缓慢吹打4~5 次,立即读取海肾荧光素酶活性结果。计算各组荧光素与海肾荧光素的相对活性值。
1.3 统计学方法 采用SPSS 19.0 进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,2 组比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 IRX5转染效率的验证 转染48 h后,观察表达绿色荧光蛋白的细胞达85%以上,见图1。过表达IRX5 组IRX5 蛋白表达水平明显高于空载质粒组(n=3,t=4.041,P<0.05);敲低IRX5 组IRX5 蛋白表达水平明显低于阴性对照组(n=3,t=5.716,P<0.01),见图2。
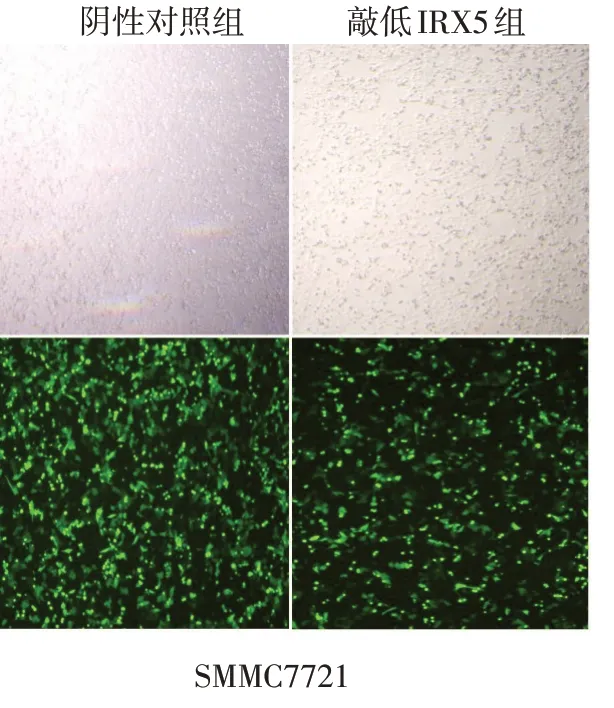
Fig.1 Expression of green fluorescent protein 48 h after transfection(×40)图1 转染48 h后绿色荧光蛋白的表达情况(×40)
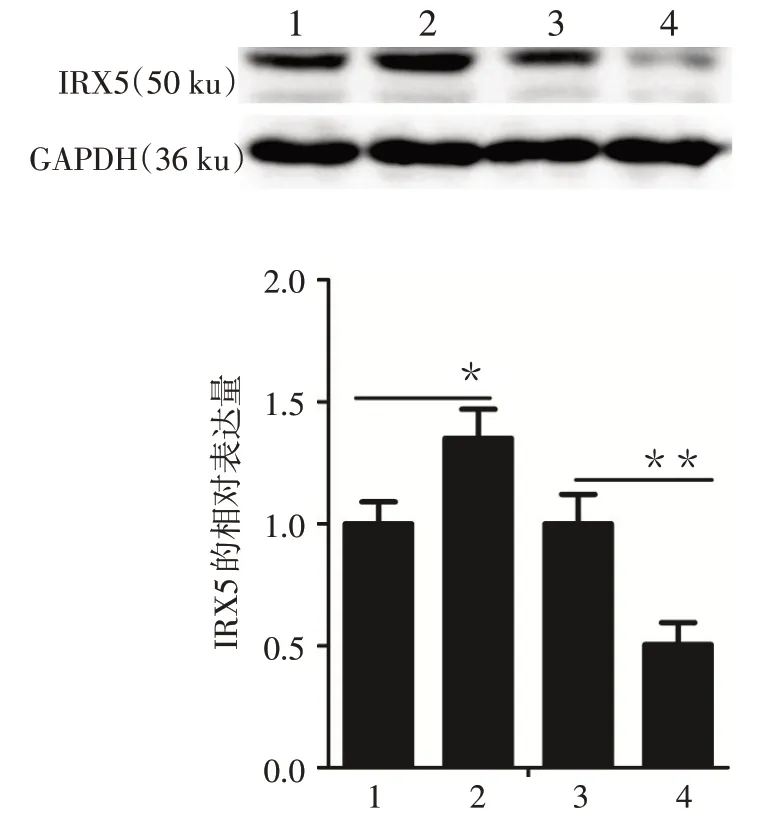
Fig.2 The expressions of IRX5 proteins detected by Western blot assay图2 Western blot检测IRX5蛋白的表达变化
2.2 IRX5 对肝癌细胞侵袭与迁移能力的影响 划痕实验结果显示,划痕48 h 后,过表达IRX5 组肝癌细胞迁移率高于空载质粒组(P<0.01);敲低IRX5组肝癌细胞迁移率低于阴性对照组(P<0.01)。Transwell实验结果显示,过表达IRX5组肝癌细胞迁移及侵袭数量均明显高于空载质粒组(均P<0.01);敲低IRX5 组肝癌细胞迁移及侵袭数量均明显低于阴性对照组(P<0.05或P<0.01),见表1、2,图3。
2.3 IRX5 结合miRNA 和结合位点的预测 通过miRanda、Targetscan 软件预测,miR-136-5p 与IRX5匹配累计权重得分为-0.15,匹配度较高;并进一步预测,IRX5 与miR-136-5p 存在1 个潜在的结合位点,见图4。
Tab.1 Effects of overexpression IRX5 on migration and invasion of SMMC7721 cells表1 过表达IRX5对SMMC7721细胞迁移和侵袭能力的影响(±s)
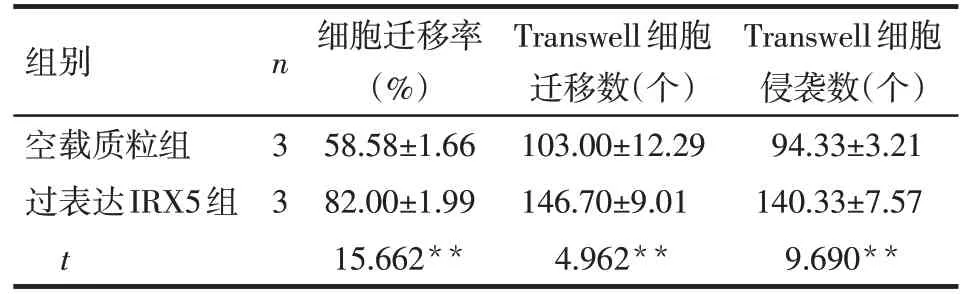
Tab.1 Effects of overexpression IRX5 on migration and invasion of SMMC7721 cells表1 过表达IRX5对SMMC7721细胞迁移和侵袭能力的影响(±s)
**P<0.01
组别空载质粒组过表达IRX5组t n 3 3细胞迁移率(%)58.58±1.66 82.00±1.99 15.662**Transwell细胞迁移数(个)103.00±12.29 146.70±9.01 4.962**Transwell细胞侵袭数(个)94.33±3.21 140.33±7.57 9.690**
Tab.2 Effects of knockdown IRX5 on migration and invasion of SMMC7721 cells表2 敲低IRX5对SMMC7721细胞迁移和侵袭能力的影响(±s)
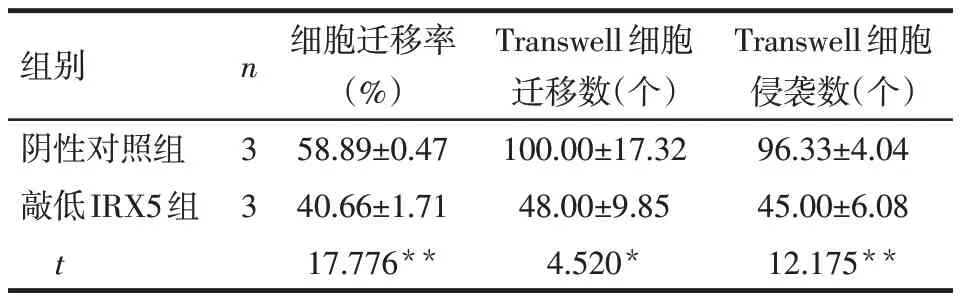
Tab.2 Effects of knockdown IRX5 on migration and invasion of SMMC7721 cells表2 敲低IRX5对SMMC7721细胞迁移和侵袭能力的影响(±s)
*P<0.05,**P<0.01
组别阴性对照组敲低IRX5组t n 3 3细胞迁移率(%)58.89±0.47 40.66±1.71 17.776**Transwell细胞迁移数(个)100.00±17.32 48.00±9.85 4.520*Transwell细胞侵袭数(个)96.33±4.04 45.00±6.08 12.175**
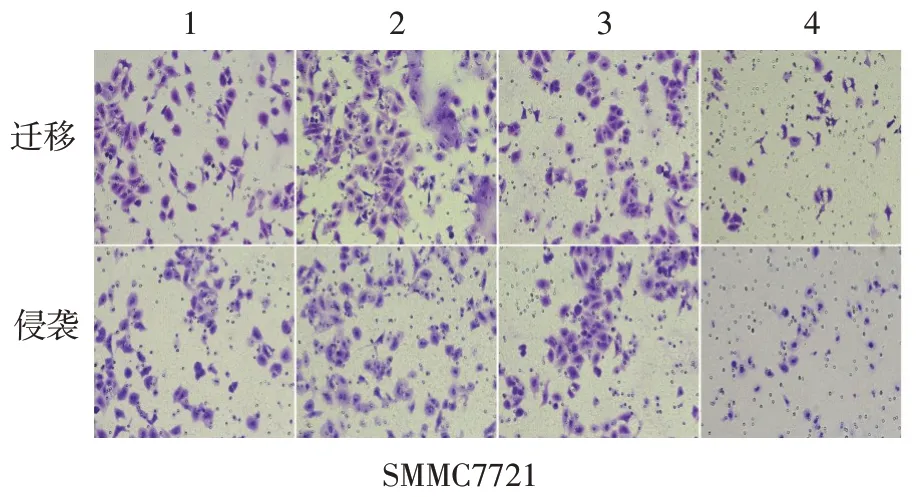
Fig.3 The results of Transwell assay(crystal violet,×200)图3 Transwell实验结果(结晶紫染色,×200)
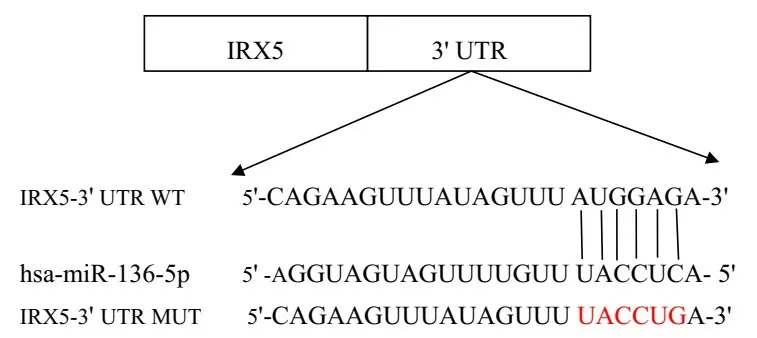
Fig.4 Target sites and mutation sites for IRX5 bind to miR-136-5p图4 miR-136-5p与IRX5结合的靶位点及突变位点
2.4 双荧光素酶报告基因质粒的构建与鉴定 以SMMC7721 细胞基因组DNA 为模板,运用设计的IRX5-3'UTR 引物扩增目的片段,电泳结果显示,1、6、7、8、9 号样本在564 bp 处有明显的扩增条带,与目标片段大小一致,见图5。将重组的野生型pGL3-IRX5-3'UTR双荧光素酶质粒用XbaⅠ进行酶切,电泳结果显示1、2、3、5 号为酶切阳性结果,酶切后存在2 个片段,分别位于564 bp 和6 000 bp 左右,与预期一致,进一步验证IRX5-3'UTR 片段与pGL3-Control 载体连接成功,见图6。IRX5-3'UTR 野生型质粒测序结果表明,测序序列与构建片段序列结果一致,结合位点位于126~132 bp,见图7。IRX5-3'UTR 突变质粒反向测序结果显示,测序序列与构建突变片段序列结果一致,其中突变碱基位于508~514 bp,见图8。
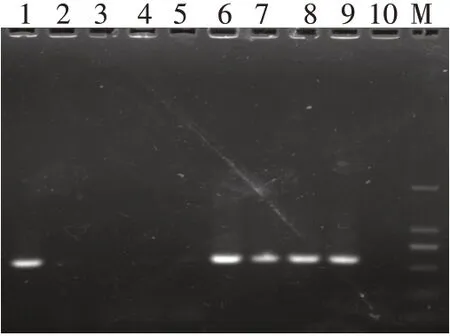
Fig.5 The amplification products of 5 IRX5-3'UTR图5 IRX5-3'UTR扩增产物
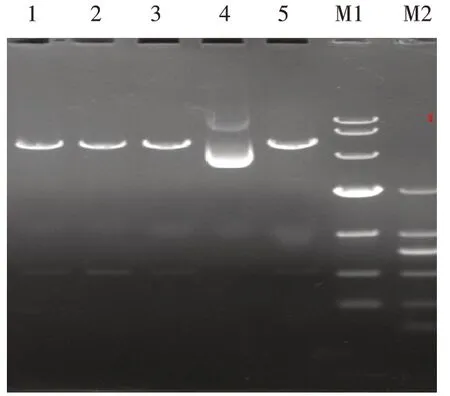
Fig.6 The enzyme cutting identification result of PGL3-IRX5-3'UTR plasmid图6 PGL3-IRX5-3'UTR质粒酶切鉴定结果
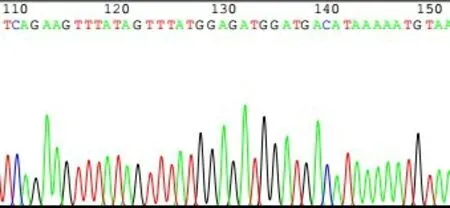
Fig.7 PGL3-IRX5-3'UTR wild-type plasmid sequencing results图7 PGL3-IRX5-3'UTR野生型质粒测序结果
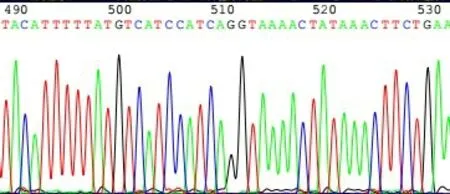
Fig.8 PGL3-IRX5-3'UTR mutant plasmid sequencing results图8 PGL3-IRX5-3'UTR突变型质粒测序结果
2.5 双荧光素酶实验结果 双荧光素酶实验结果显示,IRX5-3'UTR-Wt+miR-136-5p 组双荧光素酶活 性 明 显 低 于IRX5-3'UTR-Wt+NC 组(n=3,t=40.880,P<0.01);IRX5-3'UTR-Mut+miR-136-5p组双荧光素酶活性与IRX5-3'UTR-Mut+NC 组差异无统计学意义(n=3,t=0.020,P>0.05),见图9。
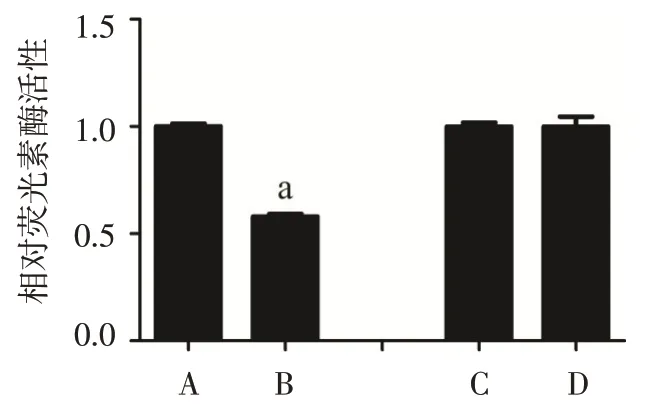
Fig.9 Results of luciferase activity in four groups图9 各组双荧光素酶活性结果
3 讨论
转录因子与肿瘤的转移密切相关,其通过上皮间质转化、降解细胞外基质进而增强肿瘤细胞的侵袭与迁移能力,最终导致肿瘤的转移,因此转录因子被认为是参与肿瘤转移过程的关键因素[12]。IRX5在前列腺癌[9]、舌鳞状细胞癌[8]、结直肠癌[13]等恶性肿瘤中表达上调,提示IRX5与肿瘤的发生发展密切相关。Zhu 等[13]研究发现,IRX5 的表达水平与结肠癌患者总生存率呈负相关。Myrthue 等[9]研究发现,IRX5可通过下调p53的表达而抑制前列腺癌细胞的凋亡。Huang 等[8]研究发现,舌鳞状细胞癌中IRX5表达上调可促进肿瘤细胞的侵袭与迁移。然而王亚玲[14]研究发现,IRX5在高转移性乳腺癌中的表达水平降低,且过表达IRX5 可以抑制乳腺癌细胞增殖、侵袭与迁移。目前IRX5 在肝癌中的研究报道尚少见。本研究结果显示,过表达IRX5可促进肝癌细胞的侵袭与迁移,敲低IRX5表达则抑制肝癌细胞的侵袭与迁移,提示IRX5在肝癌中发挥促癌作用。
有研究表明,miRNA在肿瘤中以miRNA-mRNA模式参与肿瘤的细胞周期、细胞凋亡、细胞自噬、新生血管的形成、细胞转移等过程[15]。Han 等[5]研究发现,在三阴型乳腺癌中,miR-136-5p 通过与MTDH靶向结合抑制肿瘤细胞增殖、侵袭与迁移,进而抑制肿瘤的进展。Li等[16]研究发现,在胶质瘤中,miR-136-5p通过靶向结合Bcl-2和Wnt2,抑制肿瘤细胞增殖,促进细胞凋亡,提示miR-136-5p 可以抑制肿瘤的进展。Dong 等[17]研究发现在肝癌中miR-136-5p表达下调,且通过生物信息学分析发现IRX5是miR-136-5p 的下游靶基因之一,提示miR-136-5p 可能通过IRX5 发挥抑癌作用。本研究构建了野生型和突变型IRX5 3'UTR 双荧光素酶报告基因质粒,并采用双荧光素酶实验发现miR-136-5p能够降低野生型IRX5-3'UTR 的荧光素酶活性,对突变型IRX5-3'UTR 的荧光素酶活性无明显影响,证实IRX5 是miR-136-5p 的 靶 基 因,miR-136-5p 通 过IRX5发挥抑癌作用。
综上所述,IRX5能够促进肝癌细胞的侵袭与迁移,生物信息学预测和双荧光素酶实验证实了IRX5与miR-136-5p之间的靶向关系,这为明确肝癌转移和侵袭的发生机制提供了新的实验基础,也为肝癌的临床治疗提供了新的方向。

