骨保护素参与高磷诱导大鼠血管平滑肌细胞钙化调节的机制初探
窦建新,孙丽萍,刘长山,王秀军,明义,苏亮
血管钙化是动脉粥样硬化及高血压、糖尿病血管病变等普遍存在的共同病理表现[1-2],是心血管疾病发病和死亡的主要危险因素之一,也是心血管事件发生的重要预测因素[3]。既往认为血管钙化是一个被动的、不可避免的过程,然而最近研究显示血管钙化类似于骨发育、软骨形成,是一个主动的、可调节、可预防的过程。骨保护素(OPG)是由380 个氨基酸组成的一种分泌型糖蛋白,是肿瘤坏死因子受体超家族的新成员,广泛分布于心、血管、肺、肾、肝、脑和骨骼等组织细胞中。最近研究显示OPG 不仅参与骨的形成,而且与血管钙化关系密切[4-6]。然而其在血管钙化进程中潜在的机制尚不明确。本研究以β-磷酸甘油诱导大鼠血管平滑肌细胞(VSMC)钙化模型,探讨OPG干预对VSMC钙化的影响及机制。
1 材料与方法
1.1 实验动物和材料 6只健康雄性清洁级SD大鼠(体质量100~150 g)购自上海斯莱克实验动物有限责任公司。胎牛血清、高糖DMEM、胰蛋白酶-EDTA购自美国Gibco公司,SP免疫组织化学染色试剂盒、山羊抗小鼠IgG二抗购自北京中杉金桥生物技术有限公司,BCA蛋白质定量检测试剂盒购自上海碧云天生物技术有限公司,茜素红S、OPG购自上海生工生物工程技术有限公司,β-磷酸甘油购自美国Sigma公司,碱性磷酸酶(ALP)检测试剂盒购自南京建成生物工程研究所,兔抗大鼠GAPDH多克隆抗体购自美国Sigma公司,兔抗大鼠Notch1抗体购自美国CST公司,兔抗大鼠RBP-JK抗体、山羊抗大鼠Msx2抗体购自美国Santa Cruz公司,兔抗大鼠Jagged1单克隆抗体购自北京博奥森生物技术有限公司,小鼠抗大鼠α-平滑肌肌动蛋白(α-SMA)单克隆抗体、山羊抗兔IgG二抗、兔抗山羊IgG二抗购自武汉博士德生物工程有限公司。
1.2 原代大鼠主动脉VSMC 的培养鉴定及钙化模型的建立 无菌条件下取出大鼠胸主动脉,置于无菌培养皿中,PBS冲洗,眼科剪剥除主动脉外膜,纵向剪开主动脉,钝物刮除内膜,PBS 冲洗;眼科剪剪成约1 mm×1 mm×1 mm 大小的组织块,将组织块平铺于培养皿底部,滴加少量胎牛血清,覆盖皿底,置于37 ℃、5%CO2培养箱中4~6 h(如组织贴壁不牢可延长时间);待组织与培养皿底贴附后,沿培养皿壁加入含20%胎牛血清的DMEM 培养液,置于37 ℃、5%CO2培养箱中培养;绝对静置培养3 d,此后每3 d 换液1 次。7 d 后可见到细胞从组织块边缘长出,待大多数组织块边缘的细胞达4~5层以上时,用移液管轻轻移动组织块,弃去组织块与培养液,更换新鲜培养液,隔日换液1 次。细胞呈单层生长状态达到80%融合时即可传代。细胞为梭形、不规则三角形,胞质向外伸出3个左右长短不等的突起,细胞呈束状排列,细胞汇合成片后相互重叠生长,呈典型的“峰-谷”样表现。通过形态学及对VSMC 进行α-SMA 免疫组织化学染色鉴定。贴壁于盖玻片的原代VSMC,PBS 冲洗3 次,4%多聚甲醛固定,3%H2O2孵育,山羊血清封闭,α-SMA 单抗(1∶100)孵育,PBS冲洗,二抗孵育,辣根过氧化物酶标记链霉卵白素孵育,DAB显色,脱水,透明,封片镜检,α-SMA阳性染色以胞质出现棕黄色或棕褐色为准。95%为阳性,纯度符合实验要求。
VSMC钙化模型建立与实验分组:将细胞以5×104/L接种于6 孔细胞培养板中,选择消化后生长良好的第4~8 代VSMC,以含10 mmol/L β-磷酸甘油的DMEM 培养基培养诱导钙化10 d。实验分为5 组:PBS 为对照组,以10 mmol/L β-磷酸甘油诱导钙化10 d为钙化对照组,β-磷酸甘油诱导钙化同时予以剂量梯度(1、4、8 μg/L)的OPG干预为OPG干预组。
1.3 茜素红染色 吸弃培养基并用PBS冲洗3次。95%乙醇固定15 min,去离子水洗涤2次,加入1%茜素红S溶液,室温避光30 min,去离子水洗去染液,显微镜下观察钙结节染色情况。
1.4 邻甲酚酞络合酮比色法检测细胞钙沉积含量 每组设3个复孔,细胞干预10 d后,进行钙含量测定。给予PBS洗涤3 次,每孔加入0.6 mol/L 的盐酸1 mL 进行细胞脱钙,次日收集并检测其钙含量。PBS 洗涤6 孔板中的细胞3 次后,加入0.1 mmol/L NaOH 或0.1%SDS裂解细胞,提取上清液,BCA 法检测细胞蛋白含量。结果以钙含量/蛋白含量表示。
1.5 ALP 活性测定 用PBS 洗涤6 孔板中的细胞3 次后,加入0.1%Triton X-100裂解液500 μL裂解细胞,离心后收集上清。按试剂盒说明书操作,比色法测定ALP活性。BCA法检测细胞蛋白含量,用蛋白量校正ALP含量。
1.6 Western blot 各组细胞用预冷的PBS冲洗2遍,加入RIPA裂解液,刮取细胞提取总蛋白,取上清后采用BCA法进行蛋白定量。取30 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳,转膜,封闭,加入兔抗大鼠Notch1抗体(1∶400)、兔抗大鼠Jagged-1单克隆抗体(1∶200),兔抗大鼠RBP-JK抗体(1:300)、山羊抗大鼠Msx2抗体(1∶400)4 ℃孵育过夜,加入二抗IgG(1∶5 000),室温孵育1 h,ECL试剂盒显影,以GAPDH为内参进行数据标准化,以对照组为参照样本,计算各组目的蛋白的相对表达水平。
1.7 统计学方法 应用SPSS 16.0统计软件包进行统计分析处理,符合正态分布的计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,多重比较采用SNK-q检验,检验水准为双侧α=0.05。
2 结果
2.1 钙化模型诱导 普通倒置显微镜下可见VSMC钙化模型及茜素红染色后VSMC的红色钙化结节,见图1。
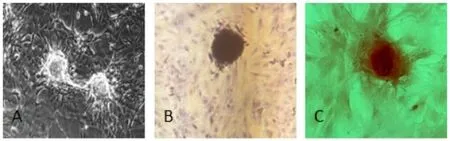
Fig.1 Calcification model of vascular smooth muscle cells induced by β-glycerophosphate图1 β-磷酸甘油诱导VSMC形成钙化模型
2.2 OPG干预对大鼠VSMC钙化的影响 给予剂量梯度的OPG 干预后,β-磷酸甘油诱导的大鼠VSMC钙化结节减少,见图2。
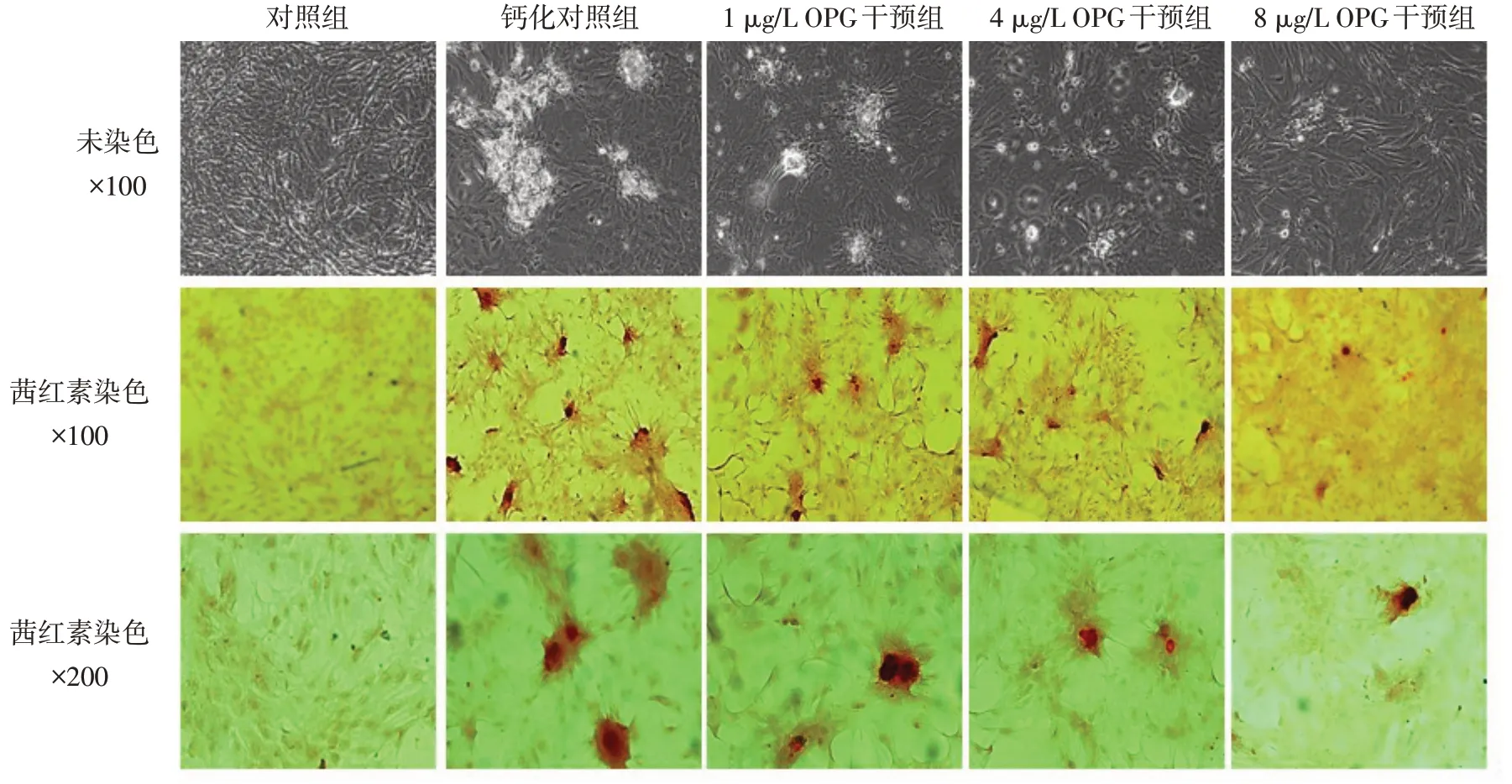
Fig.2 Effects of OPG on the calcification of vascular smooth muscle cells induced by β-glycerophosphate图2 OPG对β-磷酸甘油诱导大鼠VSMC钙化情况的影响
2.3 OPG 干预β-磷酸甘油诱导大鼠VSMC 钙化各组钙含量及ALP 活性比较 与对照组比较,钙化对照组及OPG 干预组的大鼠VSMC 钙含量明显增加,ALP活性明显增强(P<0.05)。与钙化对照组比较,OPG 干预组(1、4、8 μg/L)的大鼠VSMC 钙含量明显减少,ALP 活性明显减弱(P<0.05),且呈剂量依赖性,其中以8 μg/LOPG干预组最为明显,见表1。
Tab.1 Effects of OPG on the calcification and ALP expression of vascular smooth muscle cells induced by β-glycerophosphate表1 OPG干预β-磷酸甘油诱导大鼠VSMC钙化各组钙含量及ALP活性的比较(n=8,±s)
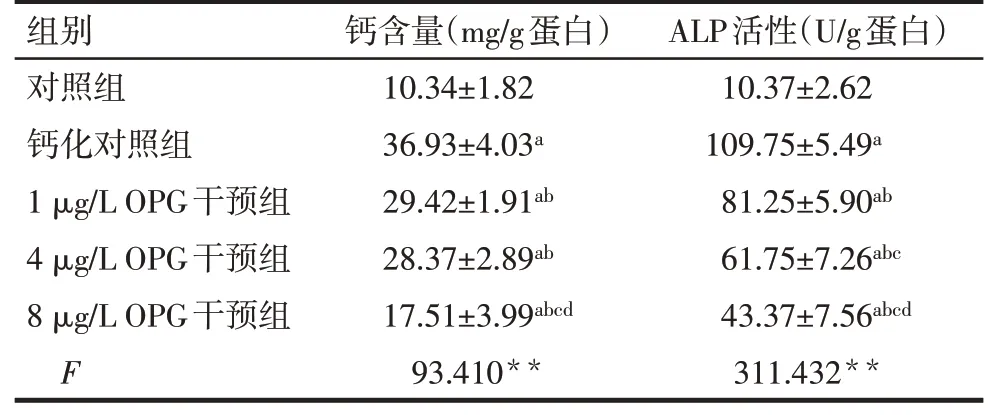
Tab.1 Effects of OPG on the calcification and ALP expression of vascular smooth muscle cells induced by β-glycerophosphate表1 OPG干预β-磷酸甘油诱导大鼠VSMC钙化各组钙含量及ALP活性的比较(n=8,±s)
**P<0.01;a与对照组比较,b与钙化对照组比较,c与1 μg/L OPG干预组比较,d与4 μg/L OPG干预组比较,P<0.05
组别钙含量(mg/g蛋白)ALP活性(U/g蛋白)对照组钙化对照组1 μg/L OPG干预组4 μg/L OPG干预组8 μg/L OPG干预组F 10.34±1.82 36.93±4.03a 29.42±1.91ab 28.37±2.89ab 17.51±3.99abcd 93.410**10.37±2.62 109.75±5.49a 81.25±5.90ab 61.75±7.26abc 43.37±7.56abcd 311.432**
2.4 OPG 干预β-磷酸甘油诱导大鼠VSMC 钙化后Notch1/RBP-JK 通路蛋白表达情况 与对照组比较,钙化对照组大鼠VSMC Notch1、RBP-JK、Jagged1、Msx2 蛋白表达水平明显升高(P<0.05)。与钙化对照组比较,给予1、4、8 μg/L OPG干预后,细胞Notch1、RBP-JK、Jagged1、Msx2 蛋白表达水平明显下降(P<0.05)。此外,与1 μg/LOPG 干预组比较,较高剂量(4、8 μg/L)OPG干预组的Notch1、RBPJK、Jagged1、Msx2 蛋白表达水平明显下降(P<0.05),见图3,表2。
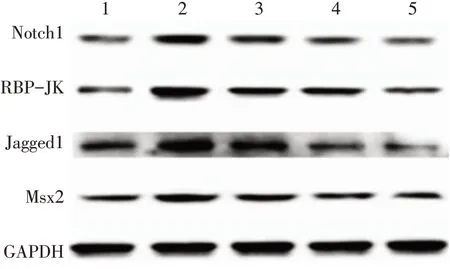
Fig.3 Expressions of Notch1/RBP-JK pathway after OPG intervention in vascular smooth muscle cells图3 OPG干预VSMC后Notch1/RBP-JK通路蛋白表达情况
Tab.2 Comparison of the protein expressions of Notch1/RBP-JK pathway after OPG intervention in vascular smooth muscle cells表2 OPG干预VSMC后各组Notch1/RBP-JK通路蛋白表达的比较(n=6,±s)
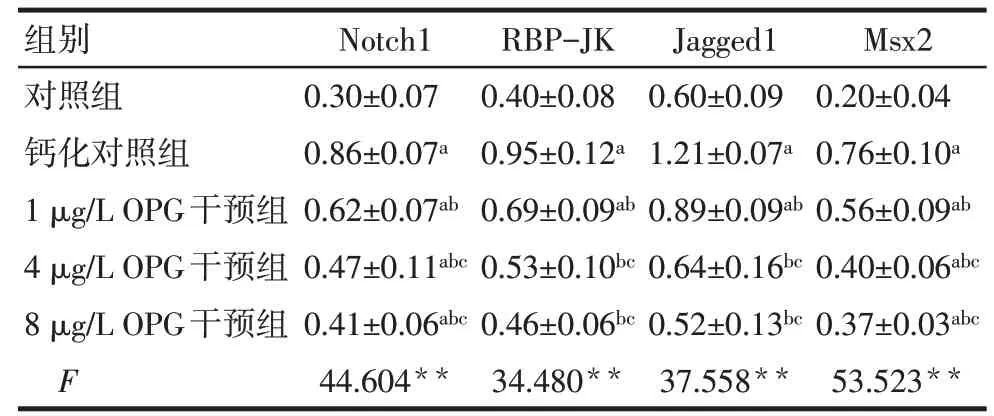
Tab.2 Comparison of the protein expressions of Notch1/RBP-JK pathway after OPG intervention in vascular smooth muscle cells表2 OPG干预VSMC后各组Notch1/RBP-JK通路蛋白表达的比较(n=6,±s)
**P<0.01;a与对照组比较,b与钙化对照组比较,c与1 μg/L OPG干预组比较,P<0.05
组别Notch1 RBP-JK Jagged1 Msx2对照组钙化对照组1 μg/L OPG干预组4 μg/L OPG干预组8 μg/L OPG干预组F 0.30±0.07 0.86±0.07a 0.62±0.07ab 0.47±0.11abc 0.41±0.06abc 44.604**0.40±0.08 0.95±0.12a 0.69±0.09ab 0.53±0.10bc 0.46±0.06bc 34.480**0.60±0.09 1.21±0.07a 0.89±0.09ab 0.64±0.16bc 0.52±0.13bc 37.558**0.20±0.04 0.76±0.10a 0.56±0.09ab 0.40±0.06abc 0.37±0.03abc 53.523**
3 讨论
血管钙化在动脉粥样硬化、糖尿病血管病变、慢性肾脏病和血管损伤中普遍存在。当血管钙化发生后,血管壁弹性及脆性增加,会损害血管的舒缩运动,易导致心肌缺血、斑块破裂、血栓形成,是心血管事件、脑卒中发生的重要预测因子。深入了解血管钙化的发病机制,寻找血管钙化相关抑制因子可能成为治疗血管钙化的潜在靶点。血管钙化的中心环节是VSMC 在高磷等因素作用下发生表型分化,转化为成骨样细胞、表达骨化及矿化相关蛋白及发生凋亡的过程,因此本研究采用β-磷酸甘油诱导大鼠VSMC钙化模型为研究对象,探讨OPG干预对VSMC钙化的影响。
OPG 是骨代谢疾病的重要调节因子,在抑制骨吸收、防止骨量丢失中有重要作用。目前越来越多的临床和基础研究均显示OPG 与心脑血管疾病及血管壁的钙化关系密切[7-9]。Caraiola等[10]研究显示OPG 水平与冠心病进展呈正相关。另有研究显示OPG水平是冠心病和外周动脉疾病患者死亡风险的强预测因子[11]。Krzanowski等[12]研究OPG水平与组织学评价的桡动脉钙化和颈动脉内膜中层厚度的关系发现,血清OPG 水平升高与动脉粥样硬化斑块的存在和桡动脉钙化的严重程度独立相关,认为循环OPG 可作为中动脉钙化和动脉粥样硬化的标志物。然而也有不同报道,Kurnatowska等[13]在为期30个月的随访研究中发现,最初无血管钙化而至研究结束时仍无钙化发生患者的OPG 水平一直明显低于钙化的患者,从而认为OPG 可以作为血管钙化的一个重要预测因子。动物研究发现OPG 基因缺陷小鼠除了出现严重的骨质疏松之外,还会出现肾动脉和主动脉中膜钙化,而且钙化的动脉是内源性OPG 表达的部位[14],这表明OPG可能有保护这些动脉免受病理性钙化的作用。Price 等[15]研究发现OPG 干预可显著抑制华法林和维生素D诱导小鼠血管钙化的发生,OPG 在防止动脉粥样硬化和钙化中可能有重要作用。本研究中应用β-磷酸甘油诱导大鼠VSMC发生钙化过程中,成骨标志物ALP 及钙含量显著增加,表明大鼠VSMC钙化过程中有矿物质沉积,伴有VSMC 表型改变和成骨因子激活。给予OPG 干预后,ALP及钙含量显著减少,说明OPG在高磷诱导的VSMC 钙化的过程中发挥抑制作用。但目前有关OPG参与血管钙化调节的分子机制尚未阐明。
血管钙化过程中多种细胞因子及通路参与调节,近年来多项研究显示Notch1-RBP-JK 通路在血管钙化中起调节作用[16-17]。Notch1-RBP-JK 是一个高度保守的信号转导通路,当Notch1 受体与配体结合后,受体的胞内区与转录抑制因子(RBP-JK)相互作用使转录激活。Msx2 是Notch1-RBP-JK 的下游因子,是血管钙化的核心调控因子,Notch1-RBP-JK通路可以通过增强Msx2 表达,促进血管钙化形成[18]。本研究结果显示,β-磷酸甘油诱导的VSMC钙化过程中存在Jagged1-Notch1-RBP-JK 通路的激活,Msx2表达升高。给予OPG 干预后Notch1-RBPJK及Msx2信号通路的激活被抑制,Msx2表达降低,Msx2 降低将抑制VSMC 向成骨样细胞分化,故给予OPG干预后,随着Msx2表达的降低,细胞钙化结节、钙含量及ALP 活性均明显下降,且该抑制作用有一定的剂量依赖性。因此,推测OPG 可能通过抑制Jagged1-Notch1-RBP-JK 通路激活参与高磷诱导大鼠VSMC钙化的调节。
OPG 水平在众多心脑血管疾病中显著增高,其不再是单纯的骨调节因子,而可能是骨质疏松、血管钙化桥梁性因子,在老年性骨质疏松及急慢性血管疾病中发挥重要作用。研究OPG 作为骨代谢、血管调控的桥梁作用,探究OPG 参与血管钙化调节的机制,有助于加深对血管类疾病的整体思考和研究,对疾病的诊治有指导意义。

