EBF1-shRNA对肺腺癌细胞体内外生物学特性的影响
王琳,李丁,秦婷婷,任丽
近年来,肺癌发病率逐年上升,5年生存率仅为15%[1];其中约85%是非小细胞肺癌(NSCLC),而肺腺癌是女性和非吸烟者NSCLC的常见类型[2]。肺腺癌的控制已成为全世界广泛关注的问题,研究肺腺癌细胞的增殖及转移对改善肺腺癌患者预后具有积极意义,但至今仍缺乏针对肺腺癌细胞增殖及转移更有效的治疗方法[3-4]。已有研究证实,肿瘤的形成往往是由基因突变引起,包括癌基因的激活和肿瘤抑制基因的失活或缺失[5]。研究显示,肺腺癌通常缺失INK4a/ARF 位点,其编码2 种抑制蛋白p16INK4a和p14ARF,是细胞周期蛋白依赖激酶(cyclin dependent kinase,CDK)抑制剂,能够调节细胞周期[6]。另有研究发现,儿童急性淋巴细胞白血病中早期B 细胞因子1(EBF1)表达缺失或功能缺陷与肿瘤细胞增殖相关[7-8]。本研究通过抑制肺腺癌细胞中高表达EBF1基因,对可能影响肺腺癌细胞增殖、侵袭及迁移能力的作用机制进行探讨。
1 材料与方法
1.1 实验动物和主要试剂仪器 SPF级雌性Balb/c Nu/Nu裸鼠8 只,体质量18~20 g,6~8 周龄,购自斯贝福(北京)生物技术有限公司,实验动物使用许可证:SCXK(京)2016-0002。饲养于独立通风笼中,恒温恒湿,喂饲灭菌裸鼠饲料,饮用双蒸水。肺癌组织及癌旁组织芯片(上海芯超公司)。Laemmli Sample Buffer(美国BIO-RAD 公司);EBF1一抗(羊抗鼠及兔抗人,美国Sigma公司);CDK6一抗(兔抗人)、P21一抗(兔抗人)、P27 一抗(兔抗人)购自美国Santa Cruz Biotechnology 公司;GAPDH 一抗(鼠抗人)、β-actin 一抗(鼠抗人)购自美国BD Biosciences 公司;Western blot二抗(北京碧云天公司);酶联免疫吸附测定(ELISA)试剂盒,BrdU试剂盒(美国Roche公司)。pSUPE-Pretro-Nea-EBF1 及自由序列购自Sigma,逆转录及PCR 试剂盒购自Thermo。超微量分光光度计Nanodrop2000(美国Thermo 公司);酶标仪BioTel Synergy H2(美国BioTek公司);流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 免疫组化染色检测EBF1 在肺癌及癌旁组织中的表达 组织芯片室温梯度乙醇脱蜡、水化,柠檬酸钠热抗原修复后滴加3%过氧化氢灭活内源酶活性,10%山羊血清封闭30 min,滴加一抗,4 ℃过夜,滴加二抗,显色,苏木素复染,1%盐酸乙醇分化,0.5%氨水反蓝后梯度乙醇脱水,凉干后滴加中性树胶封片。以出现明显棕色或黄色颗粒为阳性。
1.2.2 细胞培养和转染 肺腺癌细胞系:A549、H441;小细胞肺癌细胞系:H209、H1155;正常对照细胞系:正常支气管上皮细胞系HBE及正常肺上皮细胞系Beas-2B,上述细胞均购自ATCC。用含10%胎牛血清的RPMI-1640 培养基于37 ℃、5%CO2细胞培养箱中培养。用磷酸钙转染法将细胞转染pSUPE-Rretro-Neo-EBF1 和自由序列分别作为实验组(shRNA-EBF1组)及对照组(shRNA-control组)。
1.2.3 PCR 检测EBF1在各细胞系中的表达 提取细胞RNA,逆转录获得cDNA单链。以cDNA为模板,GAPDH作为内参基因,PCR检测EBF1的表达。引物序列:EBF1上游5'-AAAGCATCCAACGGAGTGGA -3',下游 5' -TTCCA ATCTGCGGAAATTCCA-3',扩增片段长度562 bp。PCR扩增条件:50 ℃2 min;95 ℃2 min;95 ℃15 s,60 ℃15 s,72 ℃1 min,36个循环,扩增产物在含0.5%溴化乙锭的1%琼脂糖凝胶电泳中分离。
1.2.4 Western blot 检测A549 细胞EBF1、CDK6、P21、P27 表达 将转染48 h的A549细胞用预冷的含有5%β-巯基乙醇的蛋白提取缓冲液滴加到细胞培养皿中提取细胞总蛋白,超微量分光光度计测定蛋白浓度,取50 μg蛋白在SDS-PAGE进行电泳分离后转膜到PVDF膜上,用5%脱脂奶粉封闭,TBST洗涤,滴加一抗羊抗鼠及人EBF1(1∶200)、兔抗人CDK6(1∶200)、兔抗人P21(1∶500)、兔抗人P27(1∶500),4 ℃孵育过夜,TBST洗涤,二抗兔抗羊(1∶2 000)、羊抗兔(1∶1 000)孵育后,ECL化学发光和曝光显影,Image J软件分析灰度值,计算目的蛋白相对表达量。EBF1表达水平以GAPDH为内参,CDK6、P21、P27表达水平以β-actin为内参。
1.2.5 MTT法检测A549细胞及H441细胞增殖能力 收集对数生长期细胞,调整细胞悬液浓度至1×103个/孔,接种于96孔板中,培养基总量为200 μL,每组细胞设15个复孔。待细胞贴壁每组取3孔细胞,加入10 μL MTT溶液,37 ℃孵育4 h后终止实验,利用酶标仪检测各孔490 nm处的光密度(OD)值。每24 h检测1次,连续测5 d,绘制生长曲线,以对照组生长曲线作为参考,比较实验组细胞生长情况。
1.2.6 BrdU 实验检测A549 及H441 细胞增殖能力 收集对数生长期细胞,调整细胞悬液浓度至1×103个/孔,接种于96孔板中,每孔含10%胎牛血清的RPMI-1640 培养基100 μL,5%CO2,37 ℃孵育过夜,每组设3个复孔,加入10 μmol BrdU(10 μL/孔),37 ℃孵育过夜,轻拍96孔板弃去上清,使用Cell Proliferation ELISA,BrdU 试剂盒加入FixDenat(bottle2)200 μL/孔,室温孵育30 min,轻拍96孔板弃去上清,加入100 μL/孔BrdU 抗体室温孵育90 min,轻拍96 孔板弃去上清,加入200 μL/孔洗液,轻拍96 孔板弃去上清,加入100 μL/孔显色底物,30 min 内酶标仪在450 nm及690 nm处测量各孔的OD值,去除本底,计算ΔOD=OD450-OD690,以此代表细胞增殖过程中BrdU掺入量,即表明细胞增殖能力。
1.2.7 细胞划痕实验检测A549 细胞迁移能力 将转染shRNA-EBF1 及shRNA-control 的A549 细胞分别接种于6 孔板,待细胞约70%融合时,用200 μL加样枪枪头在培养皿上划痕,PBS冲洗3遍,分别于划痕时及培养24 h时对划痕线拍照,计算细胞迁移率。细胞迁移率=(0 h 边缘距离-24 h 时边缘距离)/0 h边缘距离×100%。
1.2.8 Transwell 实验检测细胞侵袭能力 将Matrigel 胶用RPMI 1640 培养基以1∶20 稀释,在Transwell 小室中加入100 μL,37 ℃孵育4 h。用不含血清的RPMI 1640 培养基调整A549细胞浓度为5×104/mL,取200 μL细胞铺于上室,下室中加入500 μL含10%血清的RPMI 1640培养基。37 ℃培养24 h后,取出小室,PBS冲洗3遍,加入4%多聚甲醛室温固定30 min,加入0.5%结晶紫染色10 min,PBS 冲洗,棉签轻轻擦去表面细胞。随机拍照5个视野,并计算穿膜细胞数。
1.2.9 体内成瘤实验 8 只裸鼠按照随机数字表法分为2组,每组各4 只,分别皮下注射A549-shRNA-EBF1 及A549-shRNA-control。将2组细胞分别胰酶消化制成单细胞悬液,用PBS调整细胞浓度为5×107/mL。按无菌操作要求,每只裸鼠单侧腋窝皮下注射细胞悬液200 μL(1×107个细胞),4周后取出皮下肿瘤,拍照并称质量,同时采用Western blot 和免疫组化染色检测瘤体内EBF1的表达。
1.2.10 细胞周期测定 取对数生长期的细胞1×106个,用预冷75%乙醇于4 ℃固定过夜,1 500 r/min离心5 min,弃上清,以3 mL的PBS洗涤3次,加入400 μL溴化乙锭(PI,50 mg/L),100 μL RNase A(100 mg/L),4 ℃避光孵育30 min,流式细胞仪上机检测,计算各种细胞中G0/G1期、S期及G2期细胞所占比例。
1.3 统计学方法 采用GraphPad Prism 6.0软件进行数据处理。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较用2独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 EBF1在肺癌组织中的表达情况 EBF1在癌旁正常肺组织及肺癌组织的基质细胞中不表达,但在非小细胞肺癌及小细胞肺癌细胞中表达,并且EBF1主要表达于肺癌细胞的细胞核中,见图1。
2.2EBF1在肺癌细胞系中的表达情况 非小细胞肺癌细胞系A549 和H441 及小细胞肺癌细胞系H209 和H1155 中均检测到EBF1基因表达,正常支气管上皮细胞系HBE及正常肺上皮细胞系Beas-2B内未见EBF1表达,见图2。
2.3 转染EBF1特异性shRNA抑制肺腺癌细胞在体内外的增殖 Western blot 结果显示,shRNA-EBF1组较shRNA-control 组EBF1 蛋白表达量降低,见图3、表1。BrdU 实验显示shRNA-EBF1 处理后A549及H441细胞的增殖水平较shRNA-control明显降低(P<0.05),见表1。MTT实验结果发现,培养第3天开始,转染shRNA-EBF1 的A549 和H441 细胞增殖能力明显减弱,见图4。小鼠体内成瘤实验发现,与shRNA-control 组相比,shRNA-EBF1组细胞形成的肿瘤平均质量明显降低,见表1、图5;且shRNAEBF1组肿瘤内EBF1表达明显下降,见图6。
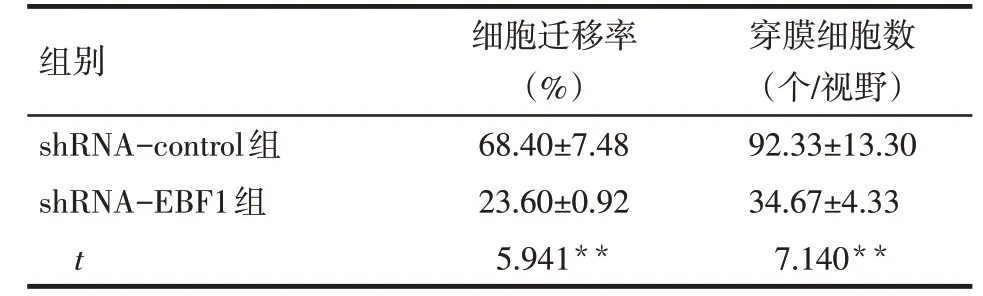
2.4 转染EBF1特异性shRNA抑制肺腺癌细胞的侵袭及迁移 划痕实验发现,shRNA-EBF1 组细胞铺片24 h 后迁移能力较shRNA-control 组细胞缓慢(P<0.01),见图7、表2。侵袭实验发现,shRNAEBF1组细胞侵袭能力较shRNA-control 组明显下降(P<0.01),见图8、表2。
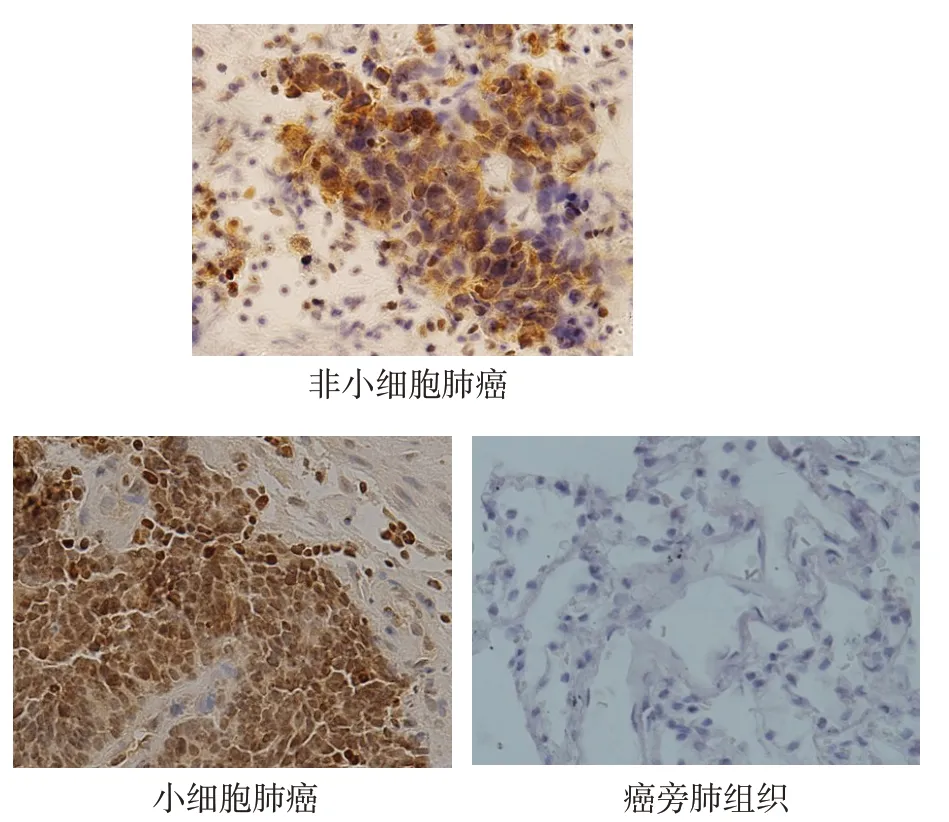
Fig.1 The expression of EBF1 in lung cancer and peripheral lung tissues(Immunohistochemical staining,×400)图1 EBF1在癌旁组织及肺癌组织中的表达情况(免疫组化染色,×400)
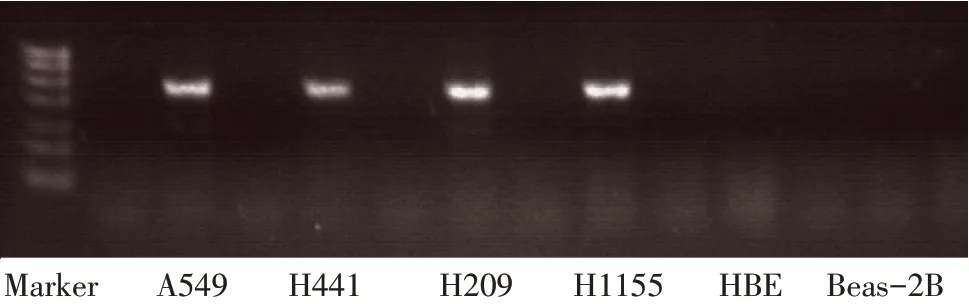
Fig.2 The expression of EBF1 in lung cancer cell lines图2 EBF1在肺癌细胞系中表达情况
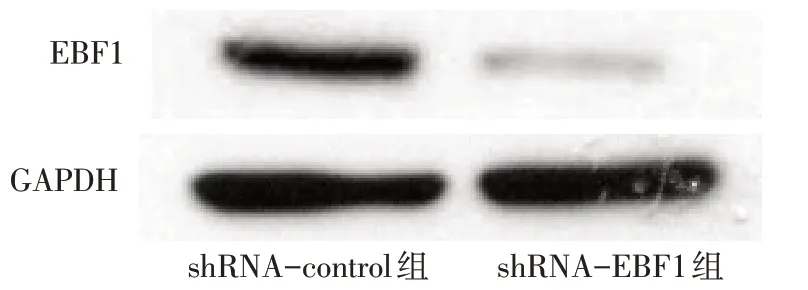
Fig.3 EBF1 specific shRNA down-regulated its expression in A549 cells图3 EBF1特异性shRNA下调其在A549表达情况
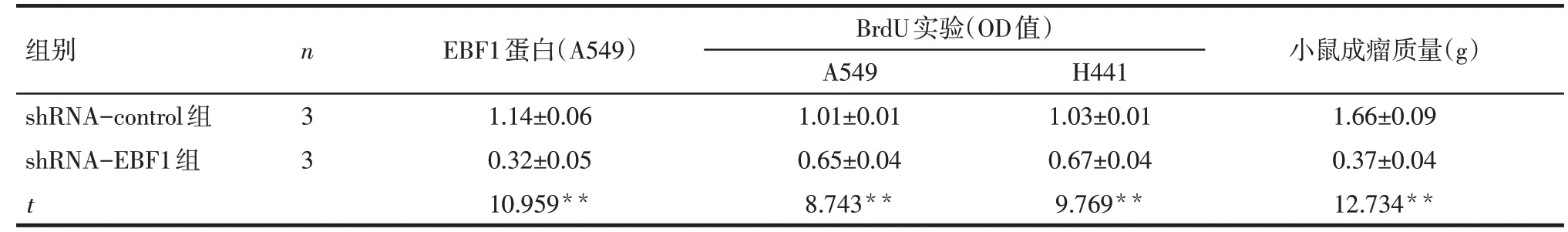
Tab.1 Comparison of EBF1 protein,cell proliferation level and ability of tumorigenicity between A549-shRNA-EBF1 group and shRNA-control group表1 shRNA-EBF1组和shRNA-control组细胞EBF1蛋白、细胞增殖水平及小鼠成瘤能力比较
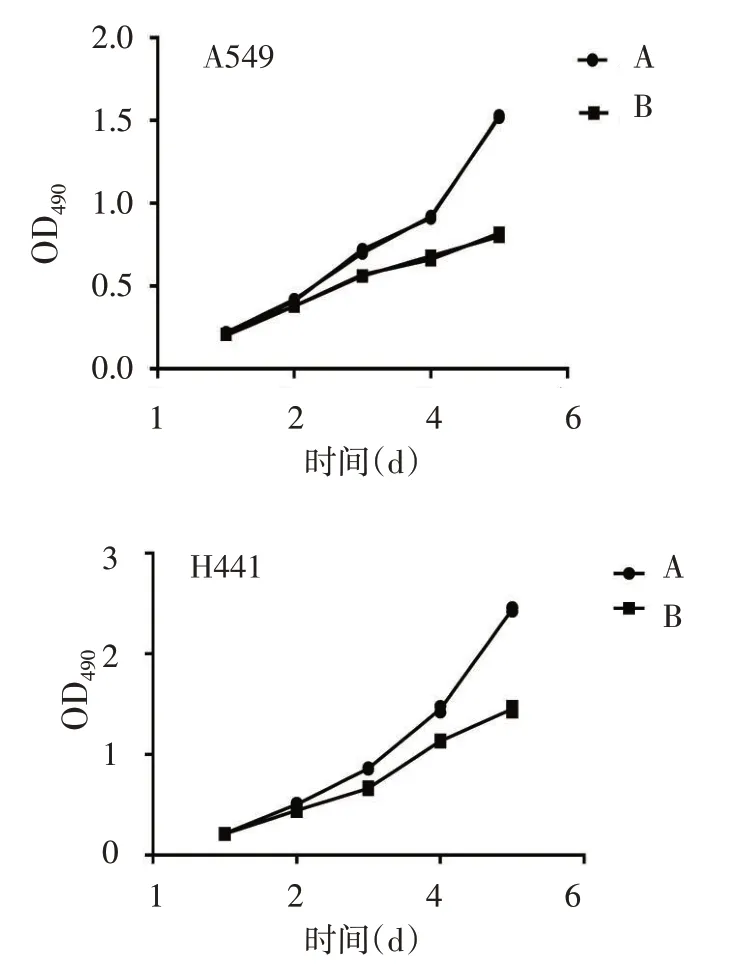
Fig.4 Effects of EBF1 knockdown on cell growth curves图4 下调EBF1后对细胞生长曲线的影响
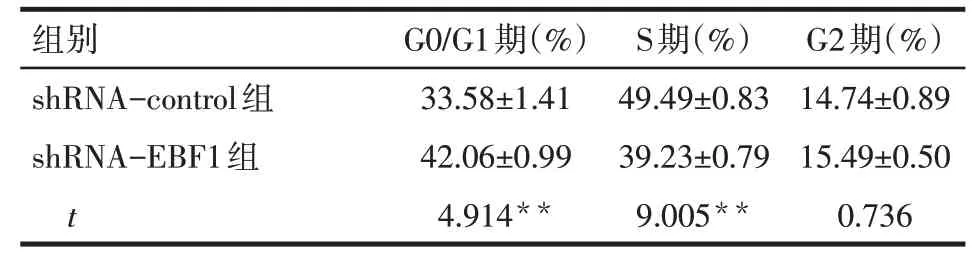
2.5 EBF1-shRNA阻滞A549细胞周期于G1期 与shRNA-control 组相比,shRNA-EBF1 组G0/G1 期细胞比例明显增加,而S 期细胞比例降低(P<0.01),见表3。
2.6 EBF1-shRNA 下调A549 细胞周期调控相关蛋白CDK6的表达 与shRNA-control组相比,shRNAEBF1 组周期蛋白依赖激酶CDK6 表达下调,同时伴有P21、P27表达增高(P<0.01),见图9、表4。
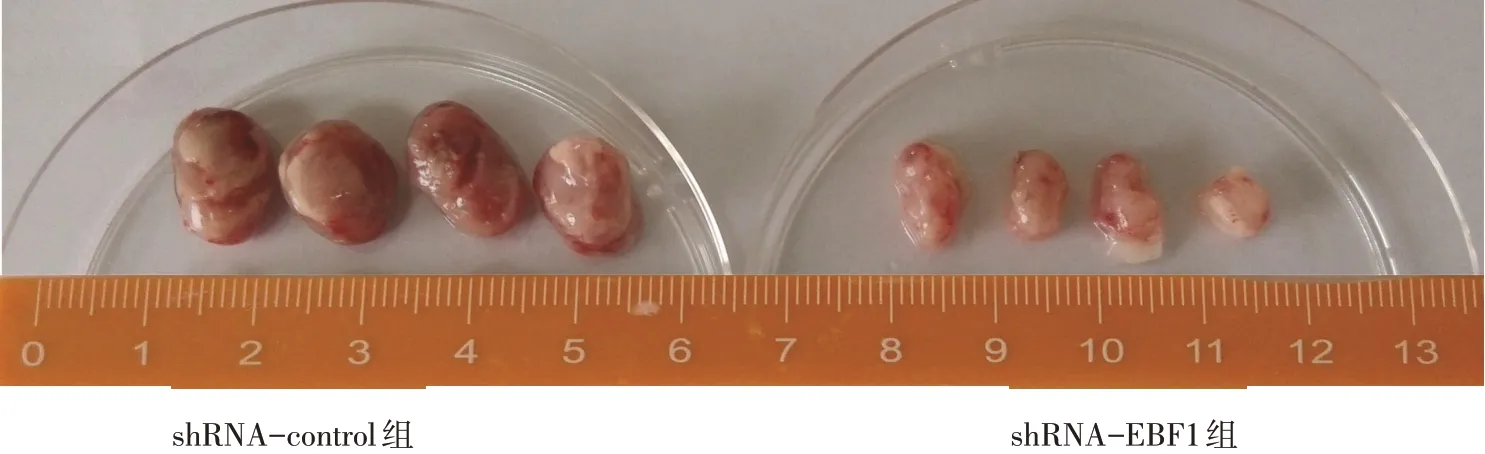
Fig.5 Effects of EBF1 knockdown on the tumorigenicity of in mice图5 下调EBF1对小鼠体内成瘤能力的影响
3 讨论
3.1EBF1基因研究现状EBF1基因位于人染色体5q34,是B细胞发育所必需的转录因子,在B细胞分化和成熟中起着重要作用[9]。研究发现,在儿童急性淋巴细胞白血病中,EBF1表达缺失,在儿童高危B 前体淋巴细胞白血病(ALL)中,EBF1缺失的频率更高[10-11]。尤其是EBF1-PDGFRB融合基因使癌细胞分化停滞在前B 细胞阶段(由于EBF1 功能缺陷)和持续增殖阶段(由于PDGFRB 激酶活性紊乱)[8]。Stone等[12]发现,EBF1和雌激素受体1(ESR1)与乳腺癌易感性增加有关。可以推测,EBF1在实体瘤的发生发展中也起着重要作用,但其作用的分子机制,特别是对肺癌的影响,目前尚不清楚。
3.2EBF1对肺腺癌A549 细胞增殖的影响及作用机制 细胞周期可分为4 个阶段:G1、S、G2 和M,它们与细胞增殖密切相关。细胞周期的异常调节对肿瘤发生机制具有重要意义。细胞周期进展受许多因素调节,如细胞周期调节蛋白、CDK、CDK 抑制剂[13]。癌基因或抑癌基因与90%以上人类肿瘤中的细胞周期变化有关。其中,与G1期相关的基因变化频率较高[14]。本研究发现,在A549 细胞中下调EBF1基因的表达能够抑制其体内外增殖,并且抑制A549细胞迁移及侵袭能力。一般而言,细胞生长抑制可能是由于细胞坏死、凋亡或者细胞周期阻滞导致。本研究发现,EBF1-shRNA 抑制A549细胞的增殖能力是通过将细胞阻滞在G1期引起的,而细胞周期与细胞增殖密切相关,表明EBF1-shRNA 通过下调EBF1在A549细胞中的表达,将A549细胞阻滞在G1期,从而抑制其在体内外的增殖能力。
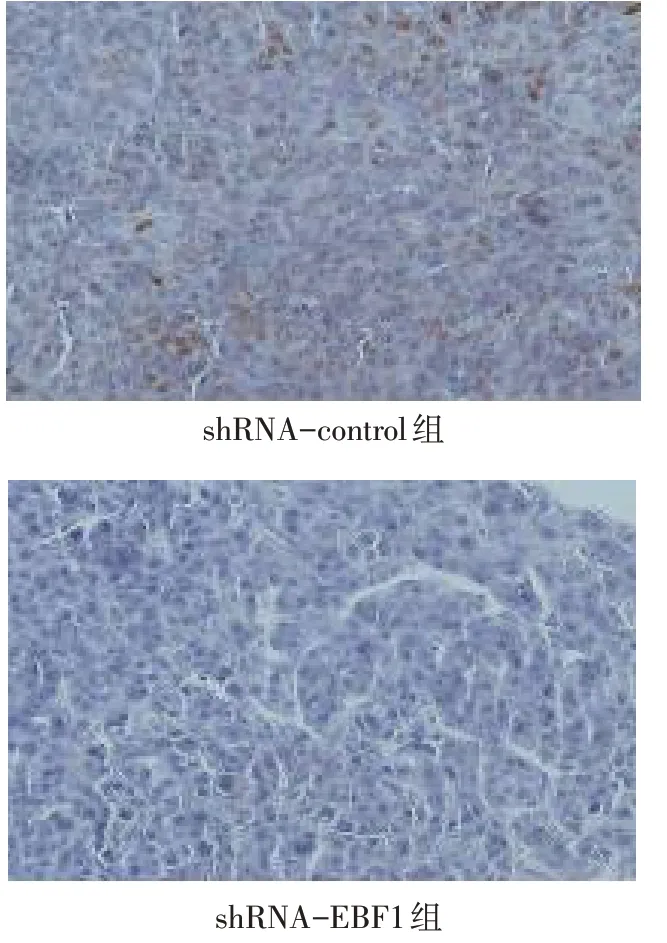
Fig.6 Expressions of EBF1 in tumorigenesis of mice after EBF1 knockdown(Immunohistochemical staining,×200)图6 下调EBF1后小鼠体内成瘤中EBF1表达情况(免疫组化染色,×200)
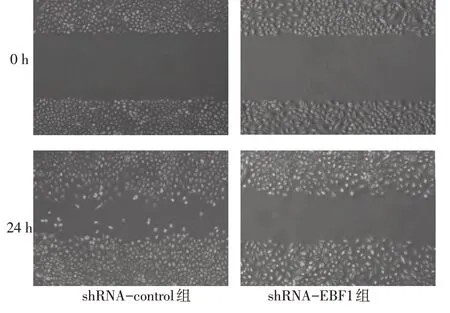
Fig.7 Effects of EBF1 knockdown on the migration of A549 cells图7 下调EBF1对A549细胞迁移能力的影响
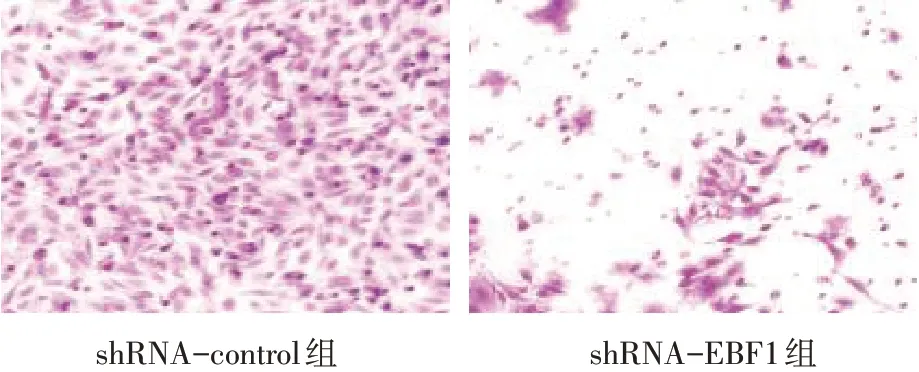
Fig.8 Effects of EBF1 knockdown on the invasion of A549 cells(crystal violet staining,×200)图8 下调EBF1对A549细胞侵袭能力的影响(结晶紫染色,×200)
Tab.2 Effects of down-regulating EBF1 on the migration and invasion ability of A549 cells表2 下调EBF1对A549细胞迁移及侵袭能力的影响(n=3,±s)
Tab.2 Effects of down-regulating EBF1 on the migration and invasion ability of A549 cells表2 下调EBF1对A549细胞迁移及侵袭能力的影响(n=3,±s)
**P<0.01
组别shRNA-control组shRNA-EBF1组t细胞迁移率(%)68.40±7.48 23.60±0.92 5.941**穿膜细胞数(个/视野)92.33±13.30 34.67±4.33 7.140**
Tab.3 Effects of down-regulating EBF1 on the cell cycle of A549 cells表3 下调EBF1对A549细胞周期的影响(n=3,±s)
Tab.3 Effects of down-regulating EBF1 on the cell cycle of A549 cells表3 下调EBF1对A549细胞周期的影响(n=3,±s)
**P<0.01
组别shRNA-control组shRNA-EBF1组t G0/G1期(%)33.58±1.41 42.06±0.99 4.914**S期(%)49.49±0.83 39.23±0.79 9.005**G2期(%)14.74±0.89 15.49±0.50 0.736
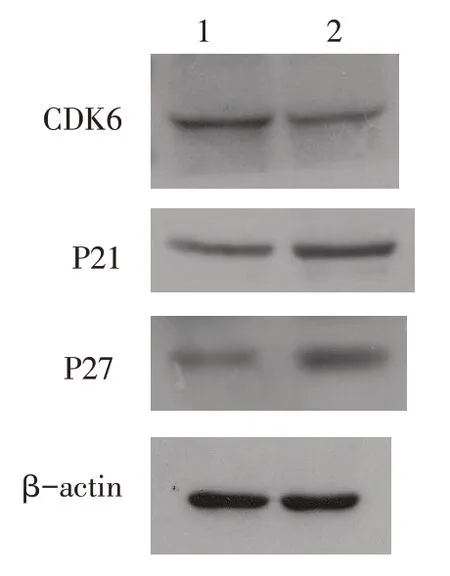
Fig.9 Effects of EBF1 knockdown on cell cycle regulation related proteins图9 下调EBF1对细胞周期调控相关蛋白的影响
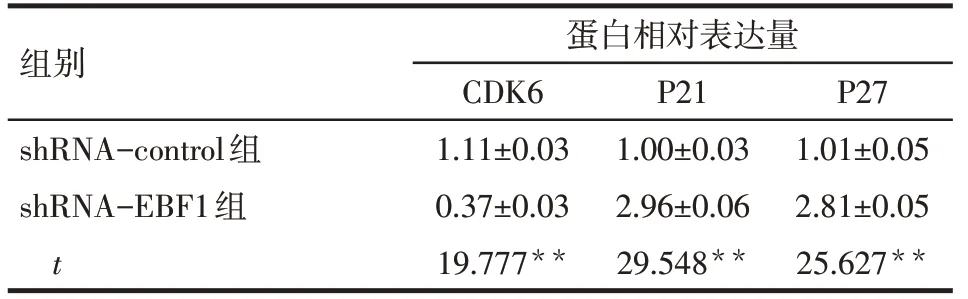
Tab.4 The expression levels of CDK6,P21 and P27 after EBF1 knockdown in A549 cells表4 A549 细胞中下调EBF1后CDK6、P21及P27表达水平的影响
细胞周期蛋白表达丰度的改变可导致不受控制的细胞增殖甚至肿瘤[15],其中在G1 期起作用的P21、P27蛋白最具代表性[16-17]。相关研究表明,P21及P27 蛋白表达的减少将导致细胞的异常增殖[18-19]。因此,为了进一步探讨沉默EBF1基因的表达抑制A549 细胞增殖的机制,笔者首先检测了P21、P27 蛋白的表达,发现shRNA- EBF1 组P21、P27蛋白表达上调。Kollmann 等[20]在研究淋巴瘤时发现,在p16INK4a缺失下,CDK6通过上调血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促进增殖和刺激血管生成并起到促进肿瘤生长的功能。因此,笔者应用Western blot技术检测了细胞中CDK6 蛋白的表达,发现shRNA- EBF1 组CDK6蛋白表达下调。当然,EBF1调控A549细胞增殖过程中是否也通过调控VEGF影响血管生成还需要以后进一步的实验加以证实。
综上所述,沉默EBF1基因的表达可将A549 细胞阻滞在G1 期而影响其增殖能力,同时伴有P21/P27表达水平的增高和CDK6蛋白表达下降,但这还需要进一步研究来证实。

