依那普利对自发性高血压大鼠肾组织AngⅡ和TGF-β/Smads变化及肾纤维化的影响
陈万里,李慧慧,朱振宇,黄安安,柳占彪,齐新
高血压已成为当今社会严重损害人类健康的常见病[1],是引发各种心脑血管疾病的重要危险因素。长期的高血压会对心脏、肾脏等靶器官造成损伤[2]。研究表明,高血压引起的肾损害已经是终末期肾病(ESRD)的第二大病因,仅次于糖尿病,且高血压会引起肾脏的纤维化[3]。肾脏纤维化是许多慢性肾脏疾病发展到ESRD 的共同途径和重要病理基础[4]。肾素-血管紧张素-醛固酮系统(RAAS)是神经-体液调节机制的重要环节,其激活可引起血管收缩、水钠潴留,在高血压的发病中有重要作用,其中血管紧张素(Ang)Ⅱ是RAAS 中最重要的效应分子[5]。目前研究表明RAAS有2个主要轴:经典的血管收缩轴[肾素-血管紧张素转换酶(ACE)/AngⅡ/AngⅡ1 型受体(AT1R)轴]和血管舒张轴[ACE2/Ang(1-7)/Mas受体(MasR)轴],它们在血管控制方面起相反作用;其中血管舒张轴对经典轴有拮抗作用,能在一定程度上延缓肾纤维化的进展[6]。目前的研究主要集中在RAAS 的血管收缩轴。AngⅡ有调节血压和促进纤维化的作用,其促纤维化作用可能与转化生长因子(TGF)-β/Smads 这一经典的信号通路有关[3]。血管紧张素转换酶抑制剂(ACEI)是临床上常用的以RAAS为靶点的抗高血压药物,主要通过抑制AngⅠ转化为AngⅡ进行降压。有研究发现,ACEI 类药物除可以有效降压外,还可以改善高血压引起的靶器官损害[7]。依那普利作为临床上常用的ACEI 类药物,降压效果良好,但在改善肾功能方面的研究较少。本研究主要探讨依那普利对自发性高血压大鼠(SHR)的降压效果,延缓肾纤维化作用及机制。
1 材料与方法
1.1 实验动物 13周龄雄性SHR、雄性Wistar-Kyoto(WKY)大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。所有动物均饲养于天津市人民医院动物房,适应性饲养1周后开始实验。
1.2 试剂及仪器 马来酸依那普利片(10 mg,扬子江药业集团江苏制药股份有限公司,国药准字H32026567)。血尿素氮(BUN)试剂盒购自南京建成生物工程研究所。AngⅡ、血清胱抑素C(CysC)、尿微量白蛋白(mALB)试剂盒购自天津安诺瑞康生物技术有限公司。TRNzol 总RNA 提取试剂盒、FastKing cDNA 第一链合成试剂盒、SuperReal 荧光定量预混试剂(增强版)均购自北京天根生化科技有限公司。引物应用Primer Premier 5.0软件设计,由上海生工生物工程有限公司合成。电子天平购自上海天平仪器厂;大鼠尾动脉血压测定仪购自美国Kent Scientific 公司;多功能酶标仪购自美国Thermo Fisher Scientific 公司;PCR 扩增仪购自美国Bio-Rad公司;光学显微镜购自日本Olympus公司。
1.3 动物分组及给药 20只SHR 大鼠适应性喂养1周后测其尾动脉血压,编号以后按照随机数字表法分为模型组和依那普利组,每组10 只,另取10 只WKY 大鼠作为对照组。依那普利组的给药剂量为1.05 mg/(kg·d),每日1次灌胃,持续10周,模型组和对照组灌胃等量生理盐水。10周后处死动物并取材。
1.4 血压及血、尿指标检测 各组在给药前(0周)及给药后每2 周测定大鼠尾动脉血压。10 周后处死大鼠前留取尿液离心取上清,处死后取腹主动脉血静置30 min 离心取上清,采用脲酶法检测各组血清中BUN水平,采用酶联免疫吸附测定(ELISA)法检测各组AngⅡ、CysC、mALB水平。
1.5 肾组织形态结构观察 大鼠处死后切取肾组织,去包膜后多聚甲醛固定,脱水、石蜡包埋、切片。按以下步骤进行Masson染色:将切片常规脱蜡及水化,用配制好的Weigert铁苏木素染色5~10 min;用酸性乙醇分化后水洗;Masson蓝化液返蓝,水洗;蒸馏水洗1 min 后丽春红品红染色液染色5~10 min。在上述操作过程中按蒸馏水∶弱酸溶液=2∶1比例配制弱酸工作液,用弱酸工作液洗1 min,磷钼酸溶液洗1~2 min,弱酸工作液洗1 min,直接入苯胺蓝染色液中染色1~2 min;弱酸工作液洗1 min,95%乙醇快速脱水3 次,每次5~10 s;二甲苯透明3次,每次1~2 min。最后中性树胶封固,待切片干燥后,在光学显微镜下观察典型病变部位并拍照。
1.6 肾组织AngⅡ、TGF-β1及下游纤维化标志物mRNA的表达 在无RNA酶条件下提取肾组织RNA,测定浓度后用FastKing cDNA第一链合成试剂盒反转录为cDNA,用SuperReal荧光定量预混试剂盒在PCR扩增仪上进行实时荧光定量PCR,扩增条件为:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,40个循环。采用2-ΔΔCt法分析基因相对表达水平,引物序列见表1。
1.7 统计学方法 所有数据均通过SPSS 21.0 软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,多组数据间比较采用单因素方差分析,多重比较采用LSD-t检验,组内多个时间点间比较采用重复测量资料的方差分析。以P<0.05为差异有统计学意义。

Tab.1 Primer sequences involved in the gene of interest表1 内参和目的基因引物序列
2 结果
2.1 依那普利对SHR大鼠的降压效果 组内比较:对照组收缩压在干预4 周时开始升高,舒张压则无明显变化(P>0.05);模型组收缩压在干预2 周时开始升高,舒张压则无明显变化(P>0.05);依那普利组收缩压和舒张压均在干预2周时开始下降。组间比较:给药前(0 周),与对照组相比,模型组和依那普利组大鼠收缩压与舒张压均显著升高(P<0.05);模型组与依那普利组收缩压与舒张压比较差异无统计学意义(P>0.05);药物干预后,与模型组比较,依那普利组的收缩压与舒张压均显著下降(P<0.05)。见表2、3。
2.2 依那普利对SHR 大鼠血清AngⅡ及肾功能的影响 与对照组比较,模型组AngⅡ、BUN、CysC 和尿mALB 水平均明显升高(P<0.05);与模型组比较,依那普利组上述指标均显著下降(P<0.05),见表4。
2.3 依那普利对SHR 肾脏形态结构的影响 Masson 染色结果显示,对照组大鼠肾组织中可见少量蓝色的胶原纤维沉积,模型组大鼠肾组织出现大量蓝色胶原纤维沉积,依那普利组的胶原纤维沉积程度较模型组明显减轻,见图1。
2.4 依那普利对SHR大鼠肾组织中AngⅡ、TGF-β1及下游纤维化标志物的mRNA表达的影响 与对照组比较,模型组Ang Ⅱ、TGF-β1、Smad2、Smad3、CollagenⅠ和Collagen Ⅳ的mRNA 相对表达量明显升高(P<0.05);与模型组比较,依那普利组的AngⅡ、TGF-β1、Smad2、Smad3、CollagenⅠ和Collagen Ⅳ的mRNA的相对表达量明显降低(P<0.05),见表5。
Tab.2 Changes of systolic blood pressure during the experiment in three groups of rats表2 3组大鼠实验期间收缩压的变化(n=10,mmHg,±s)
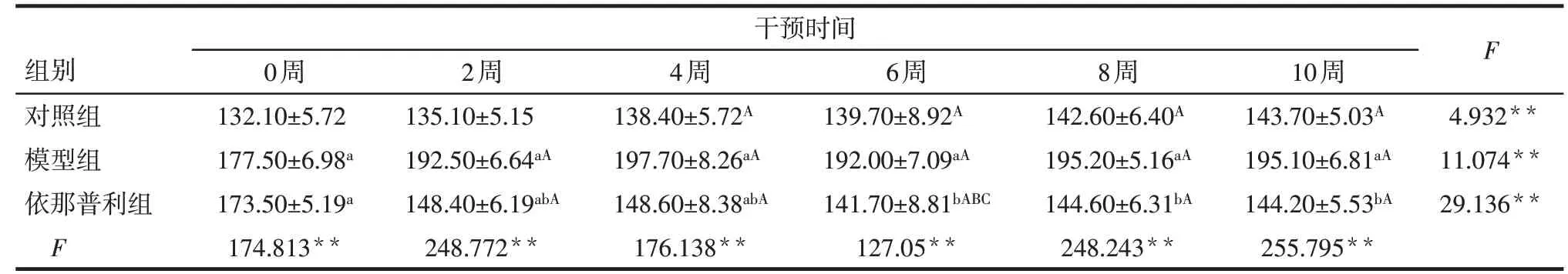
Tab.2 Changes of systolic blood pressure during the experiment in three groups of rats表2 3组大鼠实验期间收缩压的变化(n=10,mmHg,±s)
**P<0.01;F组间=964.381**,F时间=23.023**,F交互=47.534**;组间比较:a与对照组相比,b与模型组相比,P<0.05;组内比较:A与0周相比,B与2周相比,C与4周相比P<0.05;1 mmHg=0.133 kPa
干预时间组别对照组模型组依那普利组F 0周132.10±5.72 177.50±6.98a 173.50±5.19a 174.813**2周135.10±5.15 192.50±6.64aA 148.40±6.19abA 248.772**4周138.40±5.72A 197.70±8.26aA 148.60±8.38abA 176.138**6周139.70±8.92A 192.00±7.09aA 141.70±8.81bABC 127.05**8周142.60±6.40A 195.20±5.16aA 144.60±6.31bA 248.243**10周143.70±5.03A 195.10±6.81aA 144.20±5.53bA 255.795**F 4.932**11.074**29.136**
Tab.3 Changes of diastolic blood pressure during the experiment in three groups of rats表3 3组大鼠实验期间舒张压的变化(n=10,mmHg,±s)
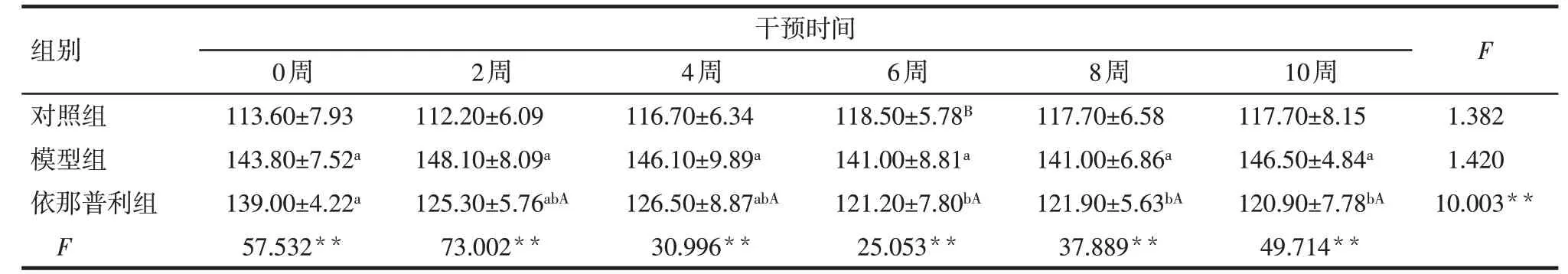
Tab.3 Changes of diastolic blood pressure during the experiment in three groups of rats表3 3组大鼠实验期间舒张压的变化(n=10,mmHg,±s)
**P<0.01;F组间=4.703**,F时间=2.190,F交互=279.106**;组间比较:a与对照组相比,b与模型组相比,P<0.05;组内比较:A与0周相比,B与2周相比,P<0.05
组别对照组模型组依那普利组F干预时间0周113.60±7.93 143.80±7.52a 139.00±4.22a 57.532**2周112.20±6.09 148.10±8.09a 125.30±5.76abA 73.002**4周116.70±6.34 146.10±9.89a 126.50±8.87abA 30.996**6周118.50±5.78B 141.00±8.81a 121.20±7.80bA 25.053**8周117.70±6.58 141.00±6.86a 121.90±5.63bA 37.889**10周117.70±8.15 146.50±4.84a 120.90±7.78bA 49.714**F 1.382 1.420 10.003**
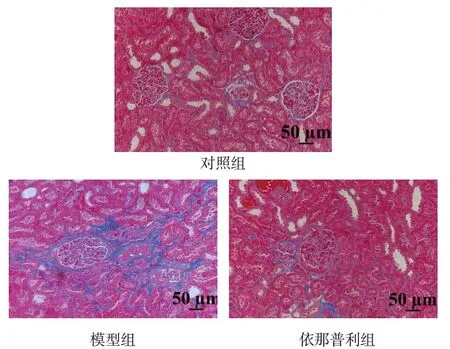
Fig.1 Effects of enalapril on renal fibrosis in SHR(Masson staining,×200)图1 依那普利对SHR肾纤维化的影响(Masson染色,×200)
Tab.4 Comparison of serum AngⅡ,BUN,CysC and mALB levels between three groups表4 3组大鼠血清AngⅡ、BUN、CysC、尿mALB水平的比较(n=10,±s)

Tab.4 Comparison of serum AngⅡ,BUN,CysC and mALB levels between three groups表4 3组大鼠血清AngⅡ、BUN、CysC、尿mALB水平的比较(n=10,±s)
**P<0.01;a与对照组相比,b与模型组相比,P<0.05
组别对照组模型组依那普利组F AngⅡ(ng/L)72.93±5.00 158.31±12.14a 83.19±12.35b 100.362**BUN(mmol/L)4.60±0.56 7.92±2.09a 5.40±0.98b 9.564**CysC(μg/L)128.37±6.31 156.45±13.50a 135.96±11.59b 10.178**尿mALB(mg/L)4.69±1.31 8.08±1.56a 5.39±0.85b 7.980**
Tab.5 Changes of AngⅡ,TGF-β1,Smad2,Collagen Ⅰand Collagen ⅣmRNA in three groups表5 3组大鼠肾组织AngⅡ、TGF-β1、Smad2、Smad3、CollagenⅠ和CollagenⅣ的mRNA表达变化(n=10,±s)
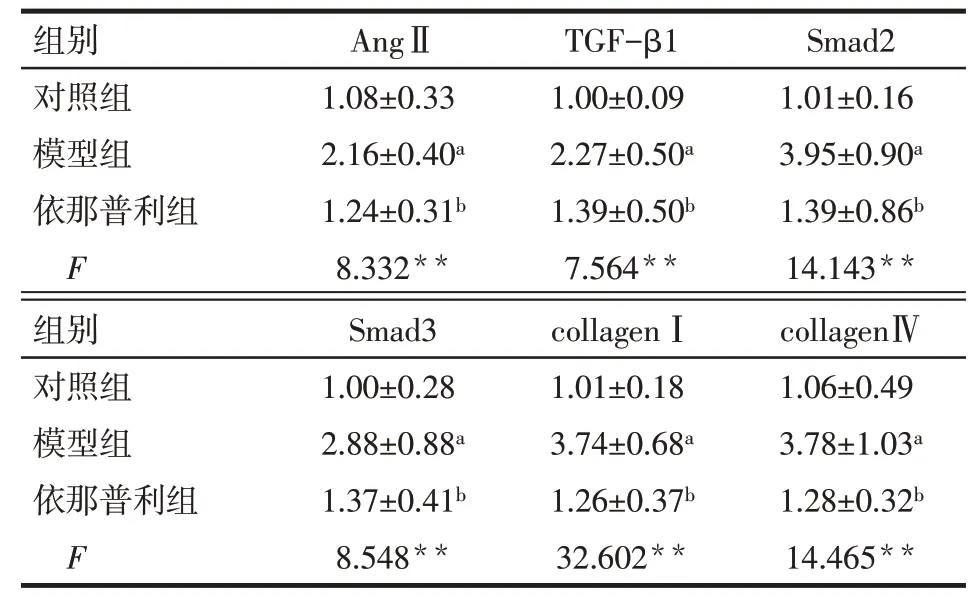
Tab.5 Changes of AngⅡ,TGF-β1,Smad2,Collagen Ⅰand Collagen ⅣmRNA in three groups表5 3组大鼠肾组织AngⅡ、TGF-β1、Smad2、Smad3、CollagenⅠ和CollagenⅣ的mRNA表达变化(n=10,±s)
**P<0.01;a与对照组相比,b与模型组相比,P<0.05
组别对照组模型组依那普利组F AngⅡ1.08±0.33 2.16±0.40a 1.24±0.31b 8.332**TGF-β1 1.00±0.09 2.27±0.50a 1.39±0.50b 7.564**Smad2 1.01±0.16 3.95±0.90a 1.39±0.86b 14.143**组别对照组模型组依那普利组F Smad3 1.00±0.28 2.88±0.88a 1.37±0.41b 8.548**collagenⅠ1.01±0.18 3.74±0.68a 1.26±0.37b 32.602**collagenⅣ1.06±0.49 3.78±1.03a 1.28±0.32b 14.465**
3 讨论
肾脏既是血压调控的重要器官,也是高血压损伤的靶器官之一。血压的升高会导致血管内皮功能损伤和肾脏缺血,使肾脏中RAAS 激活。AngⅡ是RAAS 中最重要的效应物,可通过作用于血管内皮细胞等细胞上的AT1R,激活一系列酶蛋白,直接或间接引起血管平滑肌细胞收缩、促进醛固酮的分泌、引起血管重塑、兴奋交感神经,从而导致血压升高,并发挥促炎症反应、促纤维化效应。有研究认为RAAS激活是造成肾脏损害的初始因素[8]。
长期的高血压使肾血管阻力增加,结构发生改变,肾小动脉管壁增厚,管腔狭窄,肾血流量逐渐减少,最终引起肾脏缺血性损害,尿微量白蛋白增加,出现蛋白尿。BUN 是临床常用的肾功能检测指标。CysC可自由通过肾小球滤过膜,并在肾近曲小管被重吸收和分解,当肾小球出现损伤时,CysC 水平会升高[9]。因此,CysC也是评价早期肾功能损伤和肾小球滤过功能下降的重要指标。本实验中血压监测及血、尿检测结果显示,模型组的血压以及AngⅡ、BUN、CysC、尿mALB 较对照组均出现升高,提示随着血压的升高,RAAS激活,造成了SHR肾脏功能损伤和肾小球滤过功能下降。给予依那普利后,上述指标均明显改善并恢复至接近正常水平,表明依那普利可能通过抑制RAAS 的激活,使SHR 的血压下降,并对高血压引起的肾小球损伤有保护作用。
肾脏的纤维化也被认为是反映肾功能损伤程度的主要指标,是各种进行性肾脏疾病的共同终点,主要表现为细胞外基质(ECM)的过度沉积[10]。研究指出,AngⅡ能够导致肾纤维化[11],其机制可能与其能诱导TGF-β1等促纤维化因子的表达有关[12]。有研究表明,TGF-β1是可促使胶原等ECM生成增加、降解减少,导致肾纤维化、肾功能受损最关键的细胞因子[13]。目前研究证实TGF-β1/Smads 信号通路是TGF-β1行使其功能的主要通路,也是肾纤维化的主要通路[14-15]。经典TGF-β/Smads信号通路的激活过程大致为:TGF-β1 首先与其Ⅱ型受体结合,后者出现二聚化并导致自身的磷酸化,磷酸化的Ⅱ型受体进一步磷酸化TGF-β1 的Ⅰ型受体,导致Ⅰ型受体丝氨酸/苏氨酸激酶激活,从而特异性识别并激活Smad2和Smad3,激活后的Smad2/3与受体解离并与细胞质内Smad4结合,形成异源复合物,转导进入细胞核,激活数种促纤维化因子,促进纤维化[15-16]。
本研究病理结果显示,SHR 肾脏中大量胶原纤维沉积,发生明显的纤维化,提示血压的持续升高导致肾脏的纤维化,依那普利组的纤维化程度减轻。qRT-PCR 结果显示模型组肾脏组织中AngⅡ的mRNA 相对表达量较对照组显著升高,TGF-β1、Smad2、Smad3、CollagenⅠ和CollagenⅣ的mRNA 表达也有明显增加,表明模型组肾脏在高AngⅡ水平的刺激下,TGF-β/Smads 通路被激活,ECM 生成增多,发生了纤维化。而依那普利组的上述指标均较模型组下降,提示依那普利可通过降低肾组织中AngⅡ的水平,抑制TGF-β/Smads 信号通路的激活与传导,降低纤维化相关因子的表达,改善肾纤维化。
如今各国的指南中都将ACEI 作为临床降压的基础药物,且有研究证实高血压在发病初始阶段即会对靶器官造成损伤,建议在高血压早期就关注并采取措施,防止高血压介导的器官损害的发展[17]。本研究证实,在SHR 高血压的早期即进行干预,ACEI 可以通过阻断AngⅡ对肾脏的作用,在降压的同时减轻高血压引起的肾脏损伤,显著改善肾纤维化,其作用机制可能与降低AngⅡ水平、抑制TGF-β/Smads 信号通路的表达有关。目前的研究发现除RAAS 外,高血压引起的肾脏纤维化还可能与上皮间质转化(EMT)[18]、炎症反应和氧化应激[19]、MicroRNA 的调控[20]等有关。ACEI在上述的机制和通路中发挥何种作用还有待深入研究。

