樱花叶总黄酮的超声波法提取工艺优化及其抗氧化能力的研究
杜丽娟,苏秀芳,*,梁翠君
(1.广西民族师范学院生物与食品工程学院,广西崇左 532200;2.广西高校桂西南特色植物资源化学重点实验室培育基地,广西崇左 532200)
樱花(Cerasusserrulata(Lindl.))是蔷薇科樱属的观赏性植物。樱花在我国广西、福建和云南等地广泛种植[1]。国内外学者对樱花的研究主要集中在形态特征、栽培技术、病害防治、园林应用等方面[2]。樱花叶是一种传统中药材,有止咳、平喘、宣肺、润肠、解酒、抑制恶性肿瘤等功效[3],据研究发现,这和樱花叶内的活性成分密切相关,如文飞龙等[4]研究发现樱花叶的抗氧化能力与其富含的萜类呈正相关,李友伟等[5]确定了樱花多糖的最佳提取工艺,李飞阳等[6]证实了樱花叶的抗氧化能力与黄酮含量的关系。黄酮是一大类活性成分的总称,具有强抗氧化、消炎、延缓衰老等功效。卫强等[3]发现樱花叶总黄酮经聚酰胺-大孔树脂纯化后具有较强的抗炎活性,能够明显抑制二甲苯致小鼠耳肿胀和降低冰醋酸致小鼠腹腔毛细血管通透性。吴练中等[7]发现樱花叶有效成分总黄酮含量较高,具有持久缓慢降压作用,且无毒害作用,可开发成具有保健功能的樱花叶茶等。
超声波提取法最早被用于提取曼陀罗叶中的生物碱[8],具有能大大缩短提取时间、保护提取物的结构、提高提取物的含量等特点。有学者将其应用于叶黄素[9]、果胶[10]、花青素[11]、胡萝卜素[12]等物质的提取。但是关于采用超声波法提取樱花叶总黄酮类化合物的研究鲜有报道。本研究以樱花叶为试验材料,利用超声波提取技术提取总黄酮,探究出樱花叶中总黄酮的最佳提取工艺,并评价其抗氧化能力,以期为超声波法应用于樱花叶总黄酮提取、开发与利用提供理论参考。
1 材料与方法
1.1 材料与仪器
樱花叶 采自广西民族师范学院;芦丁(BR) 国药集团化学试剂有限公司;DPPH(≥97%) 上海蓝季科技发展有限公司;无水乙醇、氢氧化钠、双氧水、抗坏血酸、硫酸亚铁、无水对氨基苯磺酸、硝酸铝、亚硝酸钠、一水柠檬酸、无水磷酸氢二钠、石油醚等 均为国产分析纯。
HZ-2A恒温水浴锅 南京南大万和科技有限公司;AR124CN电子天平 奥豪斯仪器上海有限公司;722紫外分光光度计 上海舜宇恒科学仪器有限公司;KQ-500DE中文液晶台式超声波清洗器 昆山美美超声仪器有限公司;DSY-9002高速万能粉碎机 永康市九顺莹商贸有限公司;101电热鼓风干燥箱 北京市永光明医疗仪器有限公司。
1.2 实验方法
1.2.1 总黄酮提取 参照许建本等[13]的提取方法对樱花叶总黄酮进行提取。
樱花叶干燥→粉碎过筛→脱色干燥→樱花叶粉→黄酮提取
樱花叶干燥:将新采摘的樱花叶直接用自来水冲洗干净,接着用蒸馏水冲洗3遍后,自然晾干,然后放入60 ℃的干燥箱中烘12 h,即可得干燥的樱花叶。
粉碎过筛:用粉碎机将樱花叶进行粉碎,过60目筛后得樱花叶粉。
脱色干燥:称取50 g的粉末放入1000 mL的烧杯中,加入100 mL的石油醚,用磁力搅拌器搅拌1 h左右至樱花叶粉脱色,抽滤去滤液得脱色樱花叶粉,将樱花叶粉放于室温条件下自然晾干,再放入65 ℃的烘箱中干燥4 h,即得樱花叶粉,放入封口袋保存备用。
黄酮提取:精准称量1.0000 g樱花叶粉末,放入锥形瓶中,按照一定的提取条件对黄酮进行提取,完成实验过程后,抽滤并将滤液定容至100 mL的容量瓶中,即得提取液。
1.2.2 单因素实验
1.2.2.1 乙醇浓度对总黄酮得率的影响 设置料液比1∶20 (g/mL),超声功率50 W,提取时间20 min,提取温度40 ℃,其他参数和操作同方法1.2.1,探究不同的乙醇浓度(30%、40%、50%、60%、70%)对总黄酮得率的影响。
1.2.2.2 料液比对总黄酮得率的影响 设置乙醇浓度为50%,超声功率50 W,提取时间20 min,提取温度40 ℃,其他参数和操作同方法1.2.1,探究不同的料液比(1∶20、1∶25、1∶30、1∶35、1∶40 g/mL)对总黄酮得率的影响。
1.2.2.3 超声功率对总黄酮得率的影响 设置乙醇浓度为50%,料液比1∶30 (g/mL),提取温度40 ℃,提取时间20 min,其他参数和操作同方法1.2.1,探究不同的超声功率(30、40、50、60、70 W)对总黄酮得率的影响。
1.2.2.4 提取时间对总黄酮得率的影响 设置乙醇浓度为50%,料液比1∶30 (g/mL),超声功率50 W,提取温度40 ℃,其他参数和操作同方法1.2.1,探究不同的提取时间(20、30、40、50、60 min)对总黄酮得率的影响。
1.2.2.5 提取温度对总黄酮得率的影响 设置乙醇浓度为50%,料液比1∶30 (g/mL),超声功率50 W,提取时间40 min,其他参数和操作同方法1.2.1,探究不同的提取温度(40、50、60、70、80 ℃)对总黄酮得率的影响。
1.2.3 正交试验设计 根据单因素实验结果,选取乙醇浓度(%)、料液比(g/mL)、超声功率(W)、提取时间(min)这四因素的三个水平,在最佳温度70 ℃下进行L9(34)正交试验,以确定樱花叶粉的总黄酮最佳提取工艺。
1.2.4 总黄酮得率的测定 参照Aadil等[14]的测定方法,以芦丁为标准,制备芦丁标准曲线,得到回归方程为:y=10.85x-0.001,R2=0.9994。精准移取0.50 mL的樱花树叶总黄酮提取液,放入到25 mL的比色管中,移入0.30 mL 5%的亚硝酸钠溶液,混匀,室温条件下静置6 min,移取0.30 mL10%的硝酸铝溶液放入比色管中,混匀,室温条件下静置6 min,移入4.00 mL 4%的NaOH溶液,用相对应的乙醇溶液定容至25 mL刻度线。混匀,静置15 min。采用对应的乙醇溶液为空白对照,在波长为510 nm处,测出提取液的吸光度值,总黄酮得率的计算公式见式(1):
式(1)
式中:C为黄酮的浓度(mg/mL);V为样品溶液的体积(mL); X为稀释倍数;M为樱花叶干粉末的质量(mg)。
1.2.5 抗氧化能力的测定
1.2.5.1 ·OH清除能力的测定 参照马玲龙等[15]的测定方法,移取1 mL樱花叶总黄酮提取液于比色管中,依次移入9 mmol/L FeSO4溶液、9 mmol/L水杨酸-乙醇溶液、8.8 mmol/L H2O2溶液各2 mL,混匀,然后在37 ℃的水浴锅中反应30 min后,在510 nm波长处测吸光值,记为A1。在同一条件下测定樱花叶总黄酮提取液与FeSO4、水杨酸-乙醇溶液、蒸馏水混合后的吸光值A2以及蒸馏水与FeSO4、水杨酸-乙醇溶液、H2O2溶液混合后的吸光值A0。
以抗坏血酸(VC)做阳性对照,计算公式见式(2):
·OH清除率=[1-(A1-A2)/A0]×100
式(2)
1.2.5.2 DPPH·清除能力的测定 参照Huang等[16]的测定方法,配制0.001 mg/mL的DPPH溶液。在比色管中加入DPPH溶液和樱花叶总黄酮提取液,摇匀,常温黑暗条件下放置30 min后,在波长为517 nm处测吸光值,记为A1。在同一条件下测定DPPH与无水乙醇混合后的吸光值A0,以及提取液与无水乙醇混合后的吸光值A2。以抗坏血酸(VC)为阳性对照。计算公式见式(3):
DPPH·清除率=[1-(A1-A2)/A0]×100
式(3)
1.2.5.3 NaNO2清除能力的测定 参照王敏等[17]的测定方法,移取2 mL樱花叶总黄酮提取液于10 mL的比色管中,依次向比色管中加入5 mL的pH3.0柠檬酸钠-盐酸缓冲液、1 mL 100 μg/mL的NaNO2溶液,并用蒸馏水定容至刻度线。于37 ℃的水浴中反应1 h后冷却至室温。从比色管中移取1 mL液体放入新的10 mL的比色管中,依次加入2 mL 4 mg/mL的对氨基苯磺酸溶液、1 mL 2 mg/mL的盐酸萘乙二胺,并用蒸馏水稀释至刻度,摇匀静置15 min后,于波长为540 nm处测定吸光度值,记为A。用蒸馏水取代总黄酮提取液,其他操作步骤同上,所测的吸光度值,记为A0。
配制相同浓度梯度的抗坏血酸(VC)溶液,采用上述方法,与待测液进行对比。计算公式见式(4):
NaNO2清除率=(A0-A)/A0×100
式(4)
1.3 数据处理
所有数据重复测定三次,取均值,采用Origin 8.5、SPSS 19.0软件进行图片绘制和数据处理。
2 结果与分析
2.1 单因素实验
2.1.1 乙醇浓度对樱花叶总黄酮得率的影响 由图1可见,当乙醇浓度在30%~50%之间时,随着乙醇浓度的升高,总黄酮得率随之增加,当乙醇浓度为30%时,总黄酮得率低至7.37%,当乙醇浓度在40%~60%时,总黄酮得率变化不大,乙醇浓度为50%时总黄酮得率出现最大值,此时总黄酮得率为12.41%。在乙醇浓度大于50%时,总黄酮得率随乙醇浓度的增大而缓慢下降,原因可能是乙醇浓度过高时,其他脂溶性物质、黏性物质大量溶出,与可溶性总黄酮形成竞争关系,影响总黄酮的析出,最终导致总黄酮得率下降,乔孟等[18]在研究过程中也出现了类似现象。因此选取乙醇浓度为50%时作为总黄酮提取的最适宜浓度。
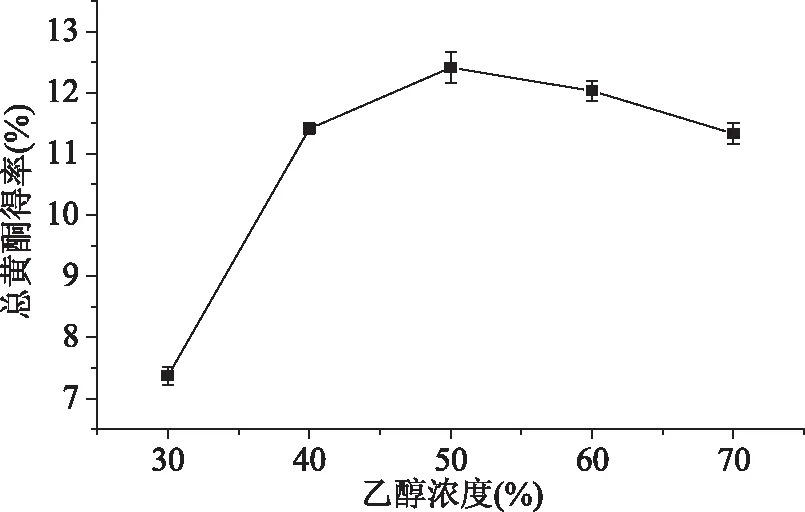
图1 乙醇浓度对总黄酮得率的影响Fig.1 Effect of ethanol volumefraction on total flavonoids yield
2.1.2 料液比对樱花叶总黄酮得率的影响 图2表明,料液比在1∶20~1∶30 g/mL的范围内,总黄酮得率呈上升趋势。当料液比为1∶30时出现高峰值,得率高达14.21%,当料液比超过1∶30时,乙醇溶液相对于固体样品的体积量越大,总黄酮得率呈下降趋势。当料液比较低时乙醇溶液较少,不利于总黄酮的溶解,当料液比过高时,杂质溶出的几率增加,从而导致总黄酮溶解量下降,同时造成资源的浪费[19]。由此可见,提取樱花叶总黄酮的料液比以1∶30为宜。
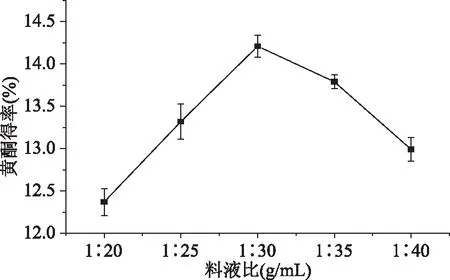
图2 料液比对总黄酮得率的影响Fig.2 Effect of ratio of materialto liquid on total flavonoids yield
2.1.3 超声功率对樱花叶总黄酮得率的影响 由图3可见,总黄酮的得率随超声功率的增大呈先上升再下降的趋势。当功率在30~50 W的范围内,总黄酮得率随着功率的增大而上升,当功率为50 W时达到一个高峰,此时的总黄酮得率高达13.88%。功率超过50 W后,总黄酮得率随功率的增大出现明显的下滑,这是由于超声波功率过大会导致总黄酮类化合物遭到破坏,故选取50 W为适宜超声功率。
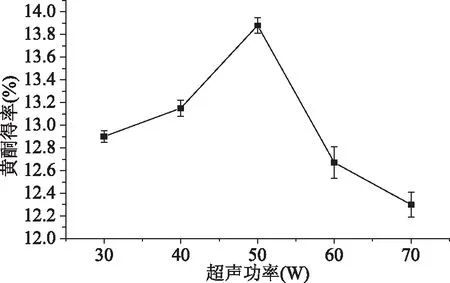
图3 超声功率对总黄酮得率的影响Fig.3 Effect of ultrasonic power on total flavonoids yield
2.1.4 提取时间对樱花叶总黄酮得率的影响 由图4表明,随着提取时间的增加,总黄酮的得率呈现出先升高再降低的规律,当提取时间在20~40 min内,总黄酮得率随时间的增加而升高,当提取时间为40 min时出现一个高峰值,此时的总黄酮得率高达13.76%,当提取时间大于40 min后,总黄酮得率随着提取时间的增加而降低,这可能是因为时间过长会导致部分的总黄酮被氧化或分解,使总黄酮得率下降,这一点和孙晶等的研究一致[20]。因此,樱花叶总黄酮的最佳提取时间为40 min。
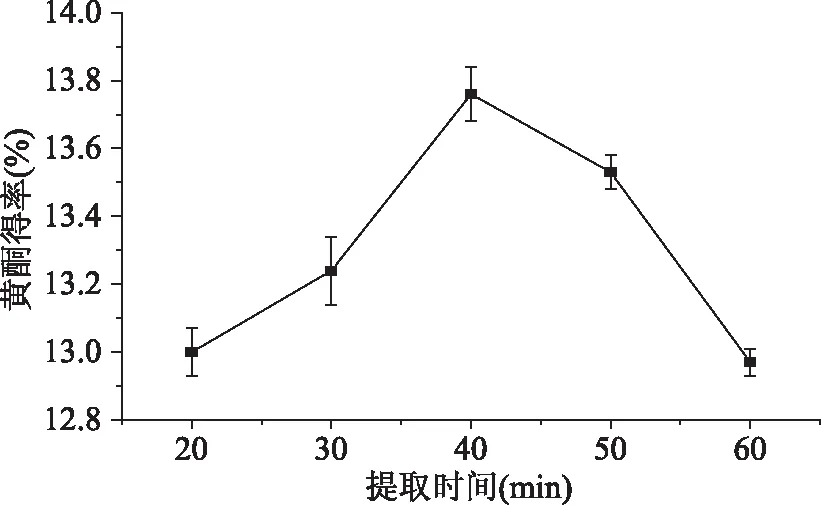
图4 提取时间对总黄酮得率的影响Fig.4 Effect of extraction time on total flavonoids yield
2.1.5 提取温度对樱花叶总黄酮得率的影响 图5结果表明,当提取温度在40~70 ℃的范围内,总黄酮得率随温度的增大而呈现缓慢上升的趋势,当提取温度达到70 ℃时,总黄酮得率最高,高达13.78%,当温度高于70 ℃后,总黄酮得率会随着温度的升高而降低,这是因为温度过高会导致热稳定性较弱的总黄酮分解[21],黄酮苷发生水解,黄酮苷元聚合,羟基氧化,苯环破坏,进而影响活性发挥,从而降低总黄酮得率,该现象在杜仲叶黄酮的研究中也出现类似的结果[22]。基于此,樱花叶总黄酮的最佳提取温度选取70 ℃为宜。
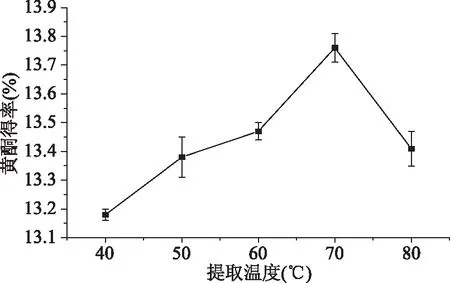
图5 提取温度对总黄酮得率的影响Fig.5 Effect of extraction temperatureon total flavonoids yield
2.2 正交试验
根据单因素实验结果,在提取温度为70 ℃时,选取乙醇溶液的浓度、料液比、超声波功率、提取时间四个影响因素。按照表1设计L9(34)正交试验,得出樱花叶总黄酮得率,结果见表2。
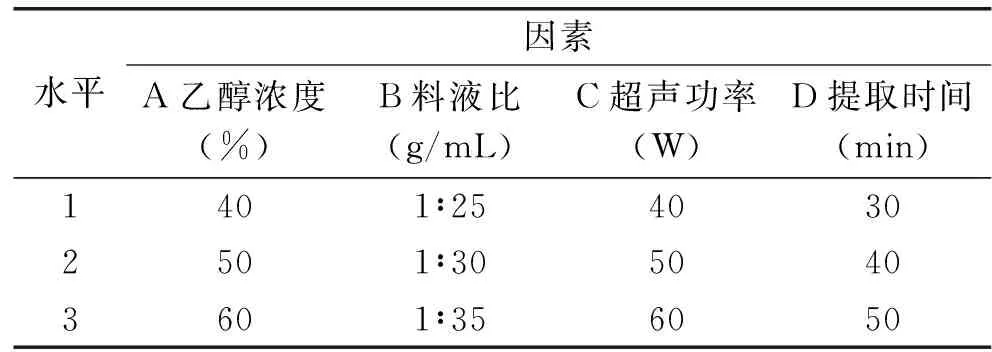
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiment
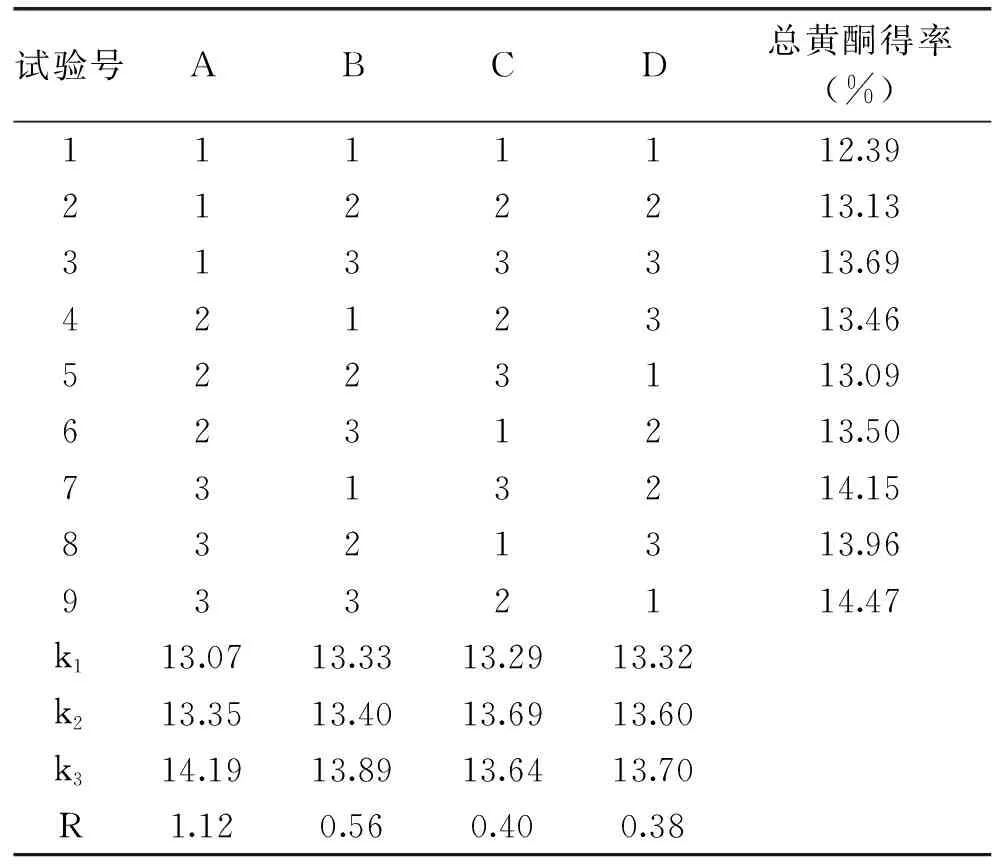
表2 樱花叶总黄酮提取正交试验结果Table 2 Results of orthogonal experimenton extraction of total flavonoids from Cerasus leaf
表2、表3的数据表明,四个因素对樱花叶总黄酮得率的影响顺序是:乙醇浓度>料液比>超声功率>提取时间,其中乙醇浓度对樱花叶总黄酮的得率呈显著影响(P<0.05),料液比、超声功率和提取时间均未达到显著影响(P>0.05)。根据正交试验结果,樱花叶总黄酮最佳提取工艺为A3B3C2D3,即乙醇浓度为60%,料液比为1∶35 g/mL,超声功率为50 W,提取时间为50 min,提取温度70 ℃。按最佳提取工艺条件进行3次平行试验,测得黄酮得率分别为14.79%、14.65%、14.79%,平均值为14.74%,高于表2中正交试验中最高得率14.47,表明正交试验优选得出的工艺条件具有可靠性。
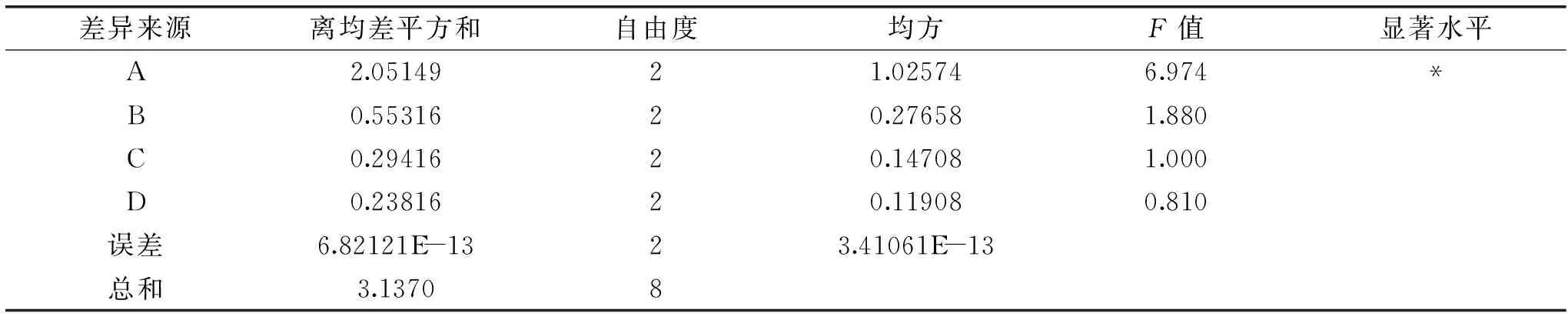
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal test
2.3 樱花叶总黄酮提取液的抗氧化能力
2.3.1 樱花叶总黄酮对·OH清除能力的测定 由图6可以得出,总黄酮提取液质量浓度在0.4 mg/mL时·OH的清除率较低(为31.87%),随着质量浓度的不断升高,清除率呈明显的上升趋势[23],其对·OH的清除能力随着质量浓度的增大而加强。在0.4~1.2 mg/mL的浓度范围之间,总黄酮提取液对·OH的清除能力略低于抗坏血酸(VC)。当樱花叶总黄酮浓度为1.2 mg/mL时,对·OH的清除率达到79.12%,经过两者的对比,表明樱花叶总黄酮具有较良好的抗氧化活性。
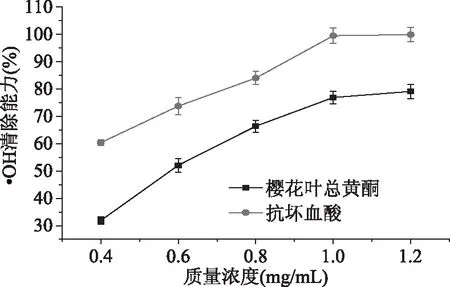
图6 樱花叶总黄酮对·OH的清除能力Fig.6 The ·OH scavenging ability oftotal flavonoids in the Cerasus leaf
2.3.2 樱花叶总黄酮对DPPH·清除能力的测定 由图7可以得出,樱花叶总黄酮以及抗坏血酸(VC)的浓度不断增大,对DPPH·的清除能力也不断提高,王芳等[24]提取菠萝皮总黄酮也出现同样规律。当樱花叶总黄酮浓度为0.50 mg/mL时,对DPPH的清除率达到94.60%,接近抗坏血酸对DPPH·清除的能力(97.50%)。
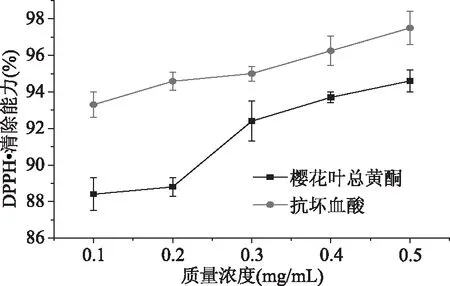
图7 樱花叶总黄酮对DPPH·清除能力Fig.7 The DPPH· scavenging ability oftotal flavonoids in the Cerasus leaf
2.3.3 樱花叶总黄酮对NaNO2清除能力的测定 由图8可知,质量浓度范围在0.20~1.40 mg/mL之间时,樱花叶总黄酮提取液对亚硝酸钠的清除率随着浓度的增大而呈明显的上升趋势,当樱花叶样品浓度为1.40 mg/mL时,对亚硝酸钠的清除率达到66.55%,说明樱花叶总黄酮具有一定的抗氧化能力。
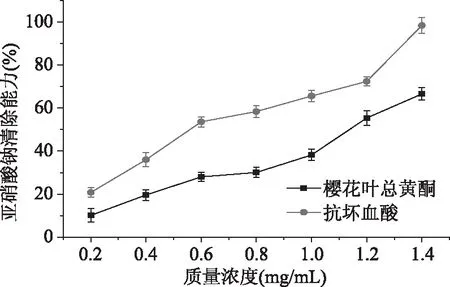
图8 樱花叶总黄酮对亚硝酸钠清除能力Fig.8 NaNO2 scavenging ability oftotal flavonoids in Cerasus leaf
3 结论
以樱花叶为研究对象,采用超声波法提取樱花叶总黄酮,并对其抗氧化能力进行探究,通过实验发现总黄酮的最佳提取工艺条件为:乙醇浓度60%、料液比1∶35 g/mL、超声功率50 W、提取时间50 min、提取温度70 ℃,此条件下,樱花叶总黄酮的得率高达14.74%。樱花叶总黄酮提取液的质量浓度越大,对·OH、DPPH·以及亚硝酸钠的清除能力就越强。当樱花叶总黄酮的质量浓度为1.2 mg/mL时,对·OH的清除能力为79.12%,当樱花叶总黄酮的质量浓度为0.5 mg/mL时,对DPPH·的清除能力为94.60%,当樱花叶总黄酮的质量浓度为1.4 mg/mL时,对NaNO2的清除能力为66.55%,表明樱花叶具有较强的抗氧化能力,可开发成具有抗氧化作用的保健食品。

