光棘球海胆seali基因克隆及表达特性分析
王 锦 张 健 刘炳正 张伟杰 常亚青 孙志惠
(大连海洋大学农业农村部北方海水增养殖重点实验室, 大连 116023)
PIWI (P-element induced wimpy testis)作为一种调控蛋白, 在干细胞维持、生殖细胞发育及体细胞基因调控中发挥重要的作用[1]。PIWI蛋白最早在果蝇(Drosophilidae)生殖干细胞中被鉴定, 是Argonaute蛋白家族的一个亚家族, 具有PIWI和PAZ两个进化上高度保守的结构域[2]。PIWI亚家族蛋白广泛存在于多种物种。在果蝇中,piwi在卵巢、精巢和体细胞中均有表达, 缺失piwi, 原始生殖细胞(Primordial germ cell, PGC)的自我更新能力将受到影响, 体细胞中过表达piwi导致生殖细胞数量增加[3,4]。在斑马鱼(Danio rerio)中,piwi(ziwi)基因在生殖细胞中特异表达, 且在卵巢和精巢中都有表达,与生殖细胞维持和斑马鱼的性别决定有关[5,6]。在小鼠(Mus musculus)中,Piwi在精母细胞和精子细胞中特异表达, 是精子发生所必需的, 而小鼠的另一Piwi同源基因Mili在卵母细胞中也有表达[7,8]。
在紫色球海胆(Strongylocentrotus purpuratus)中, 已鉴定出两种Piwi同源蛋白, Seawi和Piwi like 1(也有称Seali), 其中Piwi的表达模式与Vasa非常相似, 均在早期胚胎中呈泛表达状态[9,10]。紫色球海胆seawi基因在胚泡形成过程中募集, 随后在囊胚期的植物板处局部富集, 原肠期时迁移至肠系膜顶端, 最后合并到棱柱幼虫的两个体腔袋中并于左侧富集, 由此推测seawi基因可能在紫色球海胆生殖细胞发育过程中发挥重要作用[11]。在成体紫色球海胆中,seawi于成熟卵巢的卵母细胞均匀分布; 在绿海胆(Lytechinus variegatus)和红海胆(Mesocentrotus franciscanus)中,seawi在各组织中均有表达[9,10]。在海胆中, 针对piwi相关的研究多集中在胚胎发育时期, 成体水平的相关研究较少, 而光棘球海胆中piwi相关基因的表达情况尚不清晰。
光棘球海胆(Mesocentrotus nudus), 又称大连紫海胆, 属棘皮动物门, 海胆纲, 主要分布于辽东半岛和黄、渤海域。其性腺营养丰富、品质优良, 是我国北方沿海主要的经济种类和出口海产品之一[12]。本研究以光棘球海胆为研究对象, 克隆获得了光棘球海胆Mnseali基因的全长cDNA序列, 并利用荧光定量PCR技术检测了其在成体组织中的表达情况,并由胚胎发育时期持续检测至性成熟时性腺中的表达动态变化。此外, 通过切片原位杂交技术对Mnseali基因在性腺中细胞定位进行分析。本研究为进一步探究Mnseali在海胆生殖细胞发育中发挥的作用奠定了基础。
1 材料与方法
1.1 实验动物
本实验所用光棘球海胆, 捕捞于大连市黑石礁海域(121°33′47′′E, 38°51′55′′N)。实验前, 所用海胆在大连海洋大学农业农村部北方海水增养殖重点实验室的循环水槽中暂养一周, 培养条件为: pH 为7.96±0.02; 海水温度为(12.41±0.11)℃; 盐度为(30.13±0.21)‰。每天投喂一次海带及石莼等常见藻类植物, 每两天更换一次海水。
1.2 方法
总RNA的提取及cDNA的合成在解剖海胆后, 所取样品立即置于液氮中速冻, 备用。总RNA的提取参照SV Tolal RNA Isolation System(Promaga Z3100)说明书进行。利用琼脂糖凝胶电泳和微量分光光度计检测RNA质量。随后, 取1 μg卵巢组织总RNA, 参照SMARTer™ RACE cDNA Amplification Kit (Clontech 634923)建立卵巢cDNA文库。将总RNA反转录为cDNA的合成则参照PrimeScriptTMRTreagentKit(TaKaRa634860)说明书进行。
cDNA全长克隆在前面研究中, 我们获得了光棘球海胆性腺转录组数据库[13]。在本研究中,我们以人PIWI蛋白序列为比对序列, 在光棘球海胆性腺转录组数据库中搜索到了Mnseali的基因片段。根据所得到的基因片段, 使用PrimerPremier 5.0软件设计5′和3′RACE引物(表1), 参照SMARTer™RACE cDNA Amplification Kit (Clontech 634923)说明书克隆其cDNA全长序列。PCR扩增使用LATaq酶(TaKaRa RR02MA), PCR程序如下: 94℃预变性5min; 94℃, 30s; 62℃, 30s; 72℃, 1.15min; 30个循环;72℃延伸10min。PCR产物经1%琼脂糖凝胶电泳检验后, 切胶纯化回收DNA, 并将纯化的DNA连接pMD18-TV载体, 转化到Trans1-T1感受态细胞中,在LB培养基上涂布后于37℃培养箱中过夜。第二天挑取单菌落于装有LB液体培养基的离心管中,震荡培养, 然后通过菌落PCR筛选阳性克隆并测序。
seali序列及系统进化分析利用NCBI中ORF-Finder预测Mnseali基因的开放阅读框; 分别使用SMART(http://smart.embl-heidelberg.de/)及Ex-Pasy中的Protparam工具(https://web.expasy.org/protparam/)预测MnSeali蛋白的结构域和基本理化性质;分别采用Predict(Proteinhttps://www.predictpro tein.org/)、Swiss-model(https://swissmodel.expasy.org/)分析MnSeali蛋白的二级结构和三级结构; 随后利用Clustal W进行多重序列比对, 并用MEGA7.0对MnSeali进行系统进化分析。
荧光定量PCR验证基因表达分析使用Light-Cycler®96Instrument(Roche, LightCycler®96)进行荧光定量PCR反应, 反应体系如下: FastStartEssentialDNAGreenMaster 10 μL, 上、下游引物(10 μmol/L)0.8 μL, cDNA 2 μL, H2O 6.4 μL。PCR程序如下:95℃, 10min; 95℃, 15s; 60℃, 60s; 40个循环; 95℃,10s; 65℃, 60s; 97℃, 1s。以光棘球海胆ubiquitin基因作为内参, 采用2-ΔΔCt方法计算基因的表达情况。利用SPSS21.0软件对所得荧光定量PCR数据进行ANOVA单因素方差分析, 存在显著性差异和存在极显著性差异分别为P<0.05和P<0.01。

表1 PCR所用到的引物序列Tab. 1 Sequences of the primers used for PCR
RNA探针合成根据克隆所得到的Mnseali基因cDNA序列, 设计探针引物(表1)。随后, 参照T7 RNA Polymerase(Roche, 10881767001)和DIG RNA labeling mix(Roche, 11277073910)说明书在体外制备RNA探针, 具体操作如下: PCR扩增得到特异目的片段经切胶纯化回收后备用; 在微量离心管中配制总体积为10 μL的反应体系: PCR productor DNA2.5 μL(DNA浓度为400 ng/μL, 保证DNA总量为1 μg)、DIG RNA Labeling mixor 1 μL、Transcaription buffer 1 μL、T7 RNA聚合酶1 μL、RNA酶抑制剂1 μL、RNase-free water 3.5 μL, 充分混匀后于37℃反应2h。在反应完成后, 加入1 μL DNA酶37℃孵育15min, 以便充分消化剩余DNA模板。随后, 加入2.5 μL Licl和75 μL无水乙醇, 于-20℃沉淀过夜; 翌日, 4℃, 13000 r/min离心15min,之后用75%无水乙醇洗涤两次; 最后, 用20—30 μL无RNA酶水重悬RNA。
RNA切片原位杂交RNA切片原位杂交参照实验室前面的实验方法进行[14], 该实验主要分为6个部分, 分别为: 样品的处理,、样品固定、 杂交、 洗脱、显色和镜检。所用去离子甲酰胺购自AMRESCO(美国), 所用DiethylPyrocarbonate(DEPC)采购于Sigma-Aldrich®(上海), 所用Tween、20×SSC、PBS磷酸缓冲液粉末均采购自索莱宝公司(北京)。具体流程如下:
样品处理: 将光棘球海胆的性腺组织经4%DEPC处理的Perfluoroalkoxy(DEPC-PFA)4℃固定过夜; 第二天, 用DEPC-PBS摇洗三次, 每次5min;之后用30%蔗糖于4℃渗透过夜; 第三天, 使用组织包埋剂OCT(Tissue-Tek, 上海)进行包埋, 用Leica-CM1900-1-1进行冷冻切片; 切片后, 将玻片于37℃烘箱中烘烤1h。
样品固定: 将烘干的玻片置于装满DEPC处理的PBS(DEPC-PBS)的卧式染缸中, 室温摇洗2次, 每次5min; 用4% DEPC-PFA固定载玻片上的组织样品; 用DEPC-PBS, 室温摇洗2次, 每次5min, 洗去多余的固定液。
杂交: 在每个湿盒上放置三张滤纸, 用湿盒缓冲液(20×SSC 2.5 mL; DEPC水22.5 mL; 去离子甲酰胺25 mL)充分浸透; 每张切片加100—200 μL杂交液(探针含量1 μg/mL), 盖上盖玻片; 用封口膜将湿盒密封, 置于59℃烘箱杂交18—20h。
洗脱: 将玻片置于装满63℃预热洗脱液(20×SSC 12.5 mL; 去离子甲酰胺125 mL; Tween 0.25 mL; DEPC水112.5 mL)的卧式染缸中, 63℃摇洗2次, 每次30min; 之后用0.2×SSC于63℃摇洗2次,每次30min; 马来酸于室温摇洗两次, 每次20min; 接着, 用封阻液(10%羊血清+马来酸)室温封阻1h; 随后, 加抗体于4℃条件下孵育过夜。
显色和镜检: 用马来酸在室温中摇洗三次, 每次20min; 碱性磷酸酶显色缓冲液, 室温摇洗三次,每次5min; 随后按照说明配置碱性磷酸酶显色液(碧云天, C3206), 避光显色; 显色完成后于装满PBS的卧式染缸中, 室温摇洗2次, 每次5min, 并进行甲醇梯度脱色; 脱色完成后用甘油封片, 并使用Leica DM4B进行镜检拍照。
2 结果
2.1 Mnseali基因cDNA全长序列分析
本研究克隆得到Mnseali基因的cDNA全长序列(GenBank登录号: MK775490), 该序列全长3462 bp,其中3′UTR长度为416 bp, 5′UTR为180 bp, 其中3′UTR的加尾信号并非经典的AAUAAA或AUUAAA,而是较少见的AAUACA[15,16]。开放阅读框(Open Reading Frame, ORF)长度为2862 bp, 起始密码子(ATG)和终止密码子(TGA)分别位于181 bp处和3040 bp处, 共编码954个氨基酸。结构域预测结果表明,MnSeali蛋白具有两个进化上高度保守的结构域: PAZ(Arg385-Arg50)和Piwi(Arg493-Gln936) (图1A)。此外,Mnseali蛋白的理论分子量为107.13 kD, 理论等电点为9.43。MnSeali蛋白质的二级结构中α-螺旋(alpha-helix, H)、延伸链(strand, E)和无规则卷曲(coil, L)占比分别约为22.14%、20.78%和57.08%,其不稳定系数为48.26, 蛋白质归类为不稳定蛋白质。MnSeali蛋白质中有酸性氨基酸残基89个, 碱性氨基酸残基120个, 其亲水平均值(GRAVY)值为-0.413, 为亲水性蛋白(图1)。以已知三维结构的沙蚕(Sipunculus nudusLinne)的Piwi蛋白(Swiss-model模板号: 5 guh.1.A)为模板, 进行同源建模, 得到MnSeali的氨基酸序列与沙蚕Piwi氨基酸序列的一致性为38.37%。MnSeali氨基酸序列中含有多个疏水区域, 共有295个疏水残基, 其数量远小于亲水残基, 即该蛋白为亲水性蛋白, 与蛋白理化性质预测结果一致。另外,MnSeali蛋白中没有跨膜螺旋区,意味着该蛋白不是膜蛋白。此外,MnSeali蛋白含有三个糖基化位点, 分别位于Asn324-Thr326、Asn366-Ser368和Asn405-Thr408(图1B-C)[17]。
2.2 多重序列比对和系统进化分析
我们从NCBI下载了其他物种与Seali同源的蛋白质序列, 使用Clustal W进行多重序列比对。比对结果显示,MnSeali的蛋白质序列与紫色球海胆seali基因编码的蛋白质序列相似度最高, 其一致性为92.41%, 而与紫色球海胆seawi基因编码的蛋白质序列相似度较低, 一致性为36.47%。与其他棘皮动物的蛋白质序列也展示了较高的一致性, 譬如:与仿刺参(Apostichopus japonicus)Seali的一致性为50.83%, 与海星(Asterias rubens)Piwi-1和Piwi-2的一致性分别为40.31%和54.87%。但是与脊椎动物如斑马鱼和人的PIWI则展现出较低的同源性, 其一致性分别为39.12%和37.96%。但是, 其PIWI结构域, 无论是在脊椎动物还是在棘皮动物中均展现出较为稳定的一致性(46.22%—65.55%)。基于多重序列比对结果, 利用MEGA7构建了neighbor-joining(NJ)系统进化树, 如图2所示: 光棘球海胆Seali蛋白先与同属棘皮动物门的紫色球海胆Seali蛋白聚类, 之后与海星的Piwi-2蛋白聚类, 再与紫色球海胆的Seawi蛋白和海星的Piwi-1蛋白聚类,说明Seali/Piwi-2蛋白和Seawi/Piwi-1蛋白应是同属PIWI亚家族蛋白的两种不同基因, 其聚类结果与物种亲缘关系基本一致。
2.3 Mnseali组织表达特异性分析
如图3所示, 在光棘球海胆的性腺、肠、体腔细胞和管足四种组织中均检测到了seali转录本。Mnseali在性腺中表达量最高, 且在精巢和卵巢中呈现差异表达, 在卵巢中表达量是精巢中表达量的1.95倍, 所用海胆性腺均为生长期(Stage Ⅱ)。在其他成体组织中也有表达, 其相对表达量从高到低依次为: 体腔细胞>管足>肠。
2.4 Mnseali在不同性腺发育时期的动态表达分析
考虑到Mnseali在性腺中表达量最高, 通过持续取样, 我们获得了处于不同性腺发育时期的性腺样品: 恢复期(Stage Ⅰ)、生长期(Stage Ⅱ)、成熟前期(Stage Ⅲ)和成熟期(Stage Ⅳ)。随后利用荧光定量PCR检测Mnseali在性腺发育过程中的动态表达情况。如图4所示, 随卵母细胞的成熟,Mnseali基因的表达量逐渐升高, 在成熟期卵巢中其表达量达到峰值。而在雄性个体中, 处于恢复期、生长期及成熟前期的精巢中Mnseali基因的表达量并无显著变化, 而到了成熟期, 其表达量显著上调, 是恢复期表达量的2.05倍。
随后, 我们进一步通过RNA切片原位杂交技术分析Mnseali基因在性腺中细胞定位, 如图5所示,在卵巢,Mnseali在不同发育时期的雌性生殖细胞中均有表达。精巢中,Mnseali在除了成熟精子外的雄性生殖细胞中均有表达, 在营养细胞中未检测到Mnseali阳性信号, 且其表达情况与荧光定量结果相似。

图1 MnSeali蛋白结构域预测及其蛋白质三级结构预测Fig. 1 Prediction of the MnSeali protein domain and protein tertiary structure

图2 MnSeali系统进化分析Fig. 2 Phylogenetic analysis of MnSeali
2.5 Mnseali在胚胎发育时期及早期个体发育时期的表达水平分析
如图6所示,Mnseali基因为母源因子, 在未受精卵中即检测到了Mnseali转录本, 在四胞、囊胚、棱柱幼虫、四腕、六腕及八腕幼体中可持续检测到转录本, 且逐渐降低, 此结果与之前报道的紫色球海胆胚胎发育时期piwi基因表达量的变化趋势大致吻合。
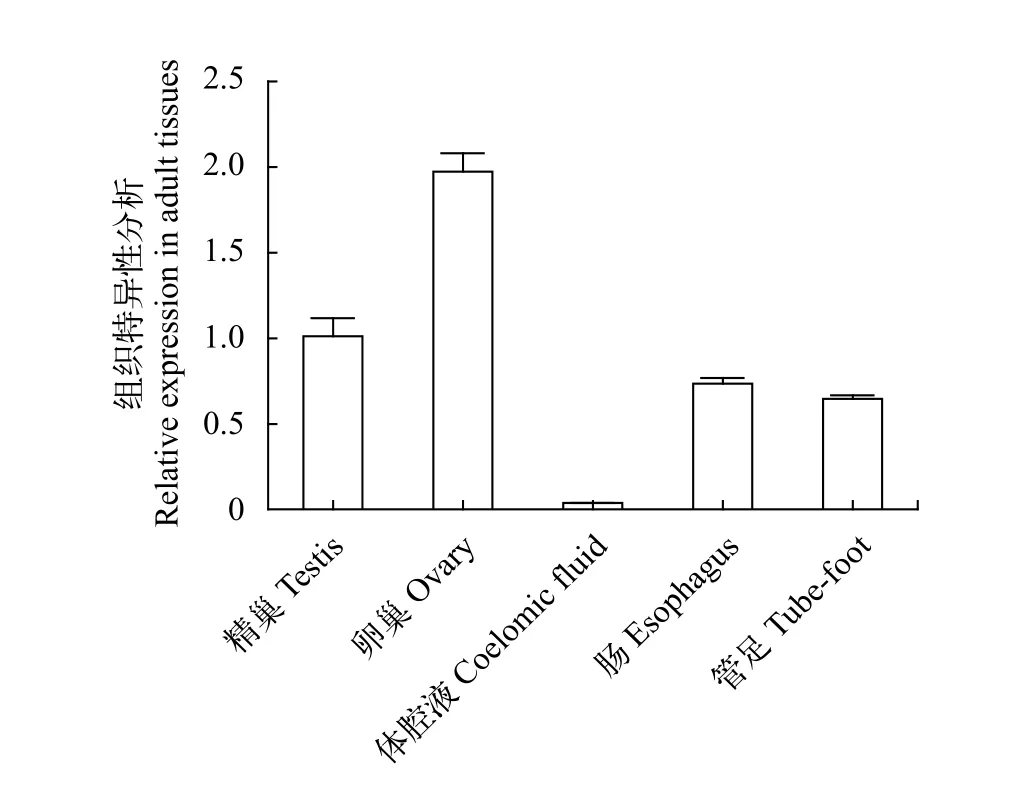
图3 Mnseali组织表达特异性分析(以精巢为参照)Fig. 3 Mnseali expression in adult tissues (Relative fold to testis)

图4 Mnseali在不同性腺发育时期的动态表达分析(以恢复期为参照)Fig. 4 Dynamic expression analysis of Mnseali in different stages of gonadal (Relative fold to stage Ⅰ)

图5 切片原位杂交分析Mnseali在不同发育时期性腺中的表达情况Fig. 5 SISH analyses of Mnseali transcripts at different stages of gonadal
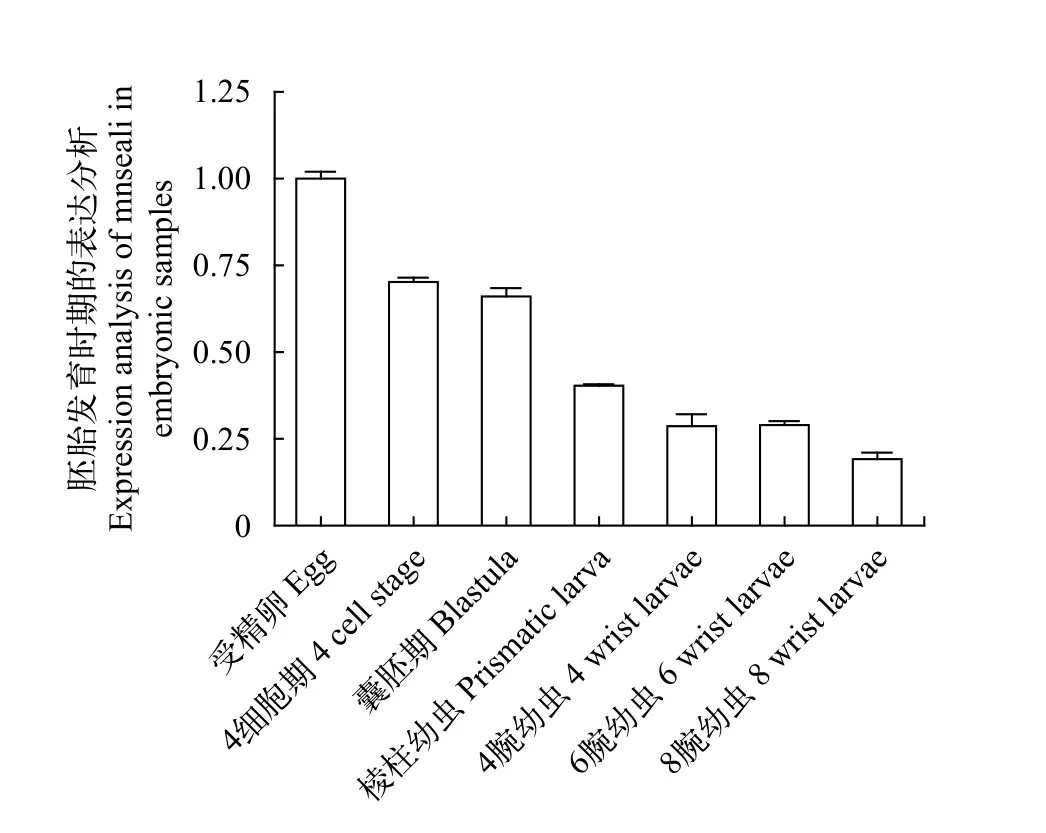
图6 Mnseali在胚胎发育时期的表达分析(以受精卵为参照)Fig. 6 Expression analysis of Mnseali in embryonic samples(Relative fold to egg)
3 讨论
本研究利用同源性克隆和cDNA末端快速扩增首次获得光棘球海胆Mnseali基因的全长cDNA序列, 该序列共编码954个氨基酸。经氨基酸序列多重比对分析, 不同物种间Seali氨基酸序列的差异较大, 其一致性为37.96%—92.41%。但是其PIWI结构域在不同物种间的一致性差异并不大(46.22%—65.55%), 这与之前报道的研究结果基本一致[2]。此外,Mnseali和紫色球海胆seali基因的氨基酸序列相似度极高, 其一致性高达92.41%, 且系统进化分析结果表明, 光棘球海胆seali基因与紫色球海胆seali基因聚为一支, 以上结果表明seali基因的进化符合光棘球球海胆的进化和分类地位。
在光棘球海胆中,seali不仅在性腺组织的生殖细胞中表达, 还在其他成体组织, 如体腔液、管足、肠中也有表达, 这种表达模式与产自大西洋西部的绿海胆(L. variegatus)表达情况相似[10]。在紫色球海胆中,seali也呈广泛表达状态[18]。但是, 在其他大多数脊椎动物中, 如非洲爪蟾(Xenopus)、斑马鱼、小鼠中,piwi均在生殖细胞中特异表达[5—8,19]。海胆中seali这种特殊的表达模式意味着seali可能在进化的过程中发生了功能歧化, 其除海胆生殖细胞发育过程中发挥作用外, 可能还有其他尚不明确的生物学功能。
与脊椎动物中一样,Mnseali为母源因子, 在囊胚期以前的胚胎中均可以检测到大量的转录本。随着胚胎发育的进行,Mnseali持续表达。无论是在精巢还是在卵巢中,seali均在生殖细胞中特异表达,这一结果与绝大多数物种piwimRNA在生殖细胞中特异表达一致。在雌性光棘球海胆个体中, 随着卵母细胞的成熟seali基因表达量逐步上调, 这暗示着seali可能和光棘球海胆卵母细胞的成熟有关。在成熟期精巢中seali的表达量上调, 推测在光棘球海胆中seali可能与精子的发生相关[21,22]。因此,Mnseali有望作为光棘球海胆生殖细胞标记因子, 追踪光棘球海胆生殖细胞的起源、迁移以及性腺的分化, 为海胆生殖细胞发育相关的研究提供了支撑。

