温度和白消安对星点东方鲀成鱼生殖细胞枯竭的影响
任玉芹 赵雅贤 周勤 夏连军 商木强 姜秀凤
摘 要:为了解高温和白消安注射对星点东方鲀(Takifugu niphobles)成鱼生殖细胞发生的影响,设置32 ℃高温组、32 ℃高温-白消安组和空白对照组,比较3组的生长、存活率以及生殖细胞凋亡情况。结果显示,高温-白消安组的体重、肥满度显著低于其他组(P<0.05),而全长与其他各组差异不显著(P>0.05),各组的存活率均在90.9%以上。高温-白消安组对生殖细胞的凋亡作用比高温组更加明显,卵巢基本看不到正常的生殖细胞,且有大量的吞噬作用造成的黄褐色沉积,生殖细胞凋亡造成的空白面积比例要显著地高于高温组(P<0.05);精巢中生殖细胞凋亡的精小囊占总的精小囊的比例高达100.0%±0.0%,也显著高于高温组空泡精小囊占总的精小囊的比例(P<0.05)。得出结论:高温-白消安组较高温组更易诱导星点东方鲀内源生殖细胞凋亡,从而可制备出生殖细胞移植的适宜受体。
关键词:星点东方鲀(Takifugu niphobles);高温;白消安;生殖细胞;移植
我国养殖河鲀鱼的总产量已经达到5万t以上。随着2016年农业部有条件开放红鳍东方鲀(Takifugu rubripes)和暗纹东方鲀两个养殖品种的加工经营,将更大地促进河鲀养殖产业的发展。相对于细腻鲜美的鱼肉,被称为“白子”(又称之为西施乳)的雄鱼精巢更是价格十倍于鱼肉的奢侈品。带有‘白子的雄鱼售价是雌鱼的1.5~2倍,并且在当前的养殖模式下,全雄苗种还具有一定的生长优势[1]。所以全雄化技术开发是河鲀养殖业界的共识。传统的全雄苗种培育技术路线是:通过雌激素诱导基因雄鱼性转化为伪雌鱼(XY),伪雌鱼与正常雄鱼交配生产超雄(YY),YY 超雄鱼与正常雌鱼(XX)交配生产的后代全部为雄鱼(XY)。如果没有性别分子标记而需要后代验证时,整个研究周期要經过5代时间,即使借助分子标记,这个过程也要经过3代以上时间,对于河鲀养殖品种来说整个过程的完成要七年以上,严重阻碍了全雄鱼苗种培育研究工作的开展。近年来鱼类生殖细胞移植(Germ cell transplantation GCT)这一新兴的生物技术研究的进展为我们提供了全新的思路[2],选择适宜的受体可大大加快性别选择育种的进程。作为生殖细胞移植受体的前题条件是其生殖腺能够支持供体的生殖细胞发育、增殖,同时满足易养殖和易人工繁育的要求。
星点东方鲀(Takifugu niphobles)与红鳍东方鲀同属东方鲀属,它们的种间遗传距离很近,种间杂交后代存活并可育[3]。星点东方鲀最大生物学个体在50 g左右,仅为红鳍东方鲀的1/150,性成熟期为一年,是十分适宜的河鲀生殖细胞移植受体鱼。以成熟个体作为受体的必要条件是不存在内源生殖细胞发生,但是具有正常功能的支持细胞(Brinster,2003)小生境(Niche)[4]。在哺乳动物GCT实验中,通常采用化疗药物处理[5-6]、放射线照射[7]和高温[8]。目前在罗非鱼(Oreochromis niloticus)[9]、银汉鱼(Odontesthes sp.)[10]和斑马鱼(Danio rerio)[11]的研究中,利用高温和白消安注射消除内源生殖细胞制备生殖细胞移植受体,成功进行了生殖细胞移植实验,并获得源自供体的功能配子或后代。在高温条件下培育红鳍东方鲀苗种,可引起生殖细胞的退化和凋亡[12],但是尚无高温配合白消安注射诱导星点东方鲀成鱼生殖细胞凋亡的实验报道。本研究中,初步观察了高温和白消安注射对星点东方鲀成鱼生殖细胞发生的影响,以期为下一步生殖细胞移植实验提供适宜的受体。
1 材料与方法
1.1 实验材料
实验鱼为2016年5-6月由北戴河金山嘴海域捕获的星点东方鲀自然繁殖亲鱼。亲鱼收购后,全部养殖在北戴河中心实验站良种场。实验用鱼在8月28日收容到试验水槽中,逐步升温,使各试验水槽达到试验要求温度。
1.2 实验方法
实验起始时间为2016年9月2日,设置1个空白对照组和2个实验组:空白对照组(自然水温,17.5~24.6 ℃),32 ℃高温组和32 ℃高温-白消安注射组(分别记录为:C、HT 和HTB)。每组为一个300 L玻璃钢水槽,各收容体重20 g以上成鱼22尾,实验组由电加热棒控温水温,流水培育,日流水量为4倍左右,每日投喂配合饲料两次,吸污处理1次。
实验开始前,全部实验鱼逐尾测量体重、体长,数据同归为起始样本S组。白消安在实验开始后的d 1,d 14,d 28按30 mg/kg的剂量进行3次腹腔注射。注射前,用MS-222 (剂量100 mg·L-1)麻醉。最后一次注射5 d后完成全部实验,整个实验周期为33 d。实验结束时,再次测量各组实验鱼体重、体长。实验开始前和结束后各随机取样10尾,解剖采集性腺中部为样本。性腺样本用波恩氏液固定24 h后保存于体积分数为70% 的酒精中。样品采用石蜡切片,经常规H.E.染色,在光学显微镜( Olympus E-300 )下观察并拍照。
1.3 性腺组织学观察
在组织样中(雌雄样n=3-5)做100左右的连续切片。卵巢发育分为Ⅰ-Ⅵ期;卵子发生时相分成卵原细胞期、卵黄发生前期、卵黄发生期、卵黄成熟期4个时相[13-16]。精巢发育分为Ⅰ-Ⅴ期;生殖细胞在发生上的顺序依次为A型精原细胞、B型精原细胞、初级精母细胞、次级精母细胞、精子细胞和精子6个时相[17-18]。组织形态学观察参考Genten(2009)[19]。每个样本选取5个典型的切片各拍摄30个数字图片。卵巢性腺退化和生殖细胞凋亡的校准参照Majhi(2009)[20]计算方法稍作变动,使用Motic Images Plus 3.2 软件截取一定面积计算空白无细胞的面积的比例。精巢性腺退化和生殖细胞凋亡的校准参照Lacerda(2006)[9]计算方法,统计空泡精小囊与正常精小囊的比例进行对比分析(图1)。
1.4 数据处理
按照肥满度=W(体重)×L-3(全长)公式计算每组的平均肥满度。 根据组织学切片结果,统计每组生殖细胞凋亡的平均比例;利用单因素方差分析比较每个组别之间体重、全长、肥满度和细胞凋亡比例是否存在显著性差异。
2 结果
2.1 生长、成活率
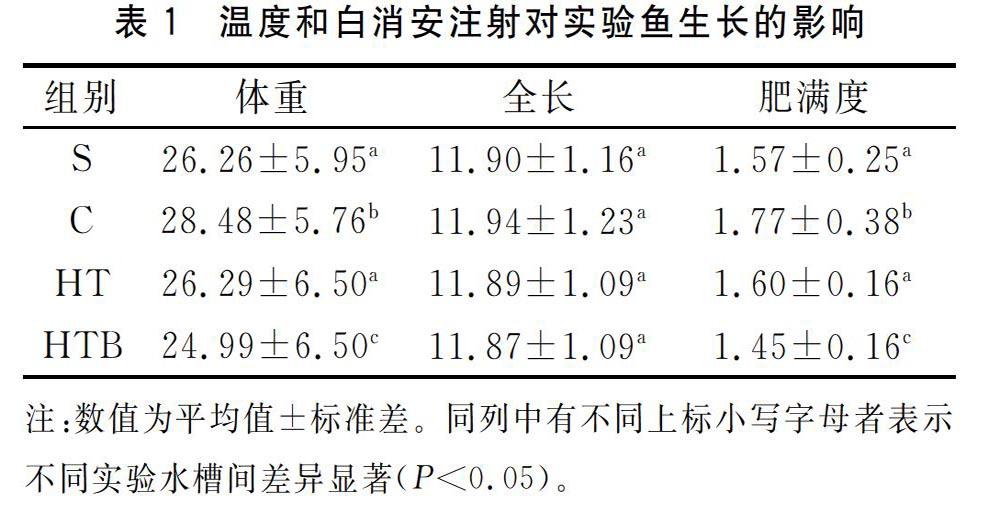
所有处理组在试验结束时,通过单因素方差分析和LSD多重比较各组生长情况见表1。全长与实验开始前的全长相比基本没有变化。对照组C体重表型值、肥满度均显著高于开始前和其他实验组(P<0.05),高温HT组体重表型值、肥满度与开始前體重表型值没有显著性差异(P>0.05),而高温-白消安HTB组体重表型值、肥满度均显著低于开始前和其他两组(P<0.05)。高温白消安HTB组有8尾存在表皮溃疡现象,实验结束时没有死亡,但是实验结束后第4天死亡2尾,成活率为90.9%。而空白对照组C和高温组HT均无死亡现象。
注:数值为平均值±标准差。同列中有不同上标小写字母者表示不同实验水槽间差异显著(P<0.05)。
2.2 温度和白消安对卵巢发育的影响
在实验开始前,雌鱼卵巢为Ⅱ期(见封三图1A-B),卵巢中以卵原细胞和卵黄发生前期卵母细胞为主。实验结束时,性腺发育良好,为Ⅲ期卵巢,以卵黄发生期卵母细胞为主,有部分为卵黄发生前期卵母细胞,卵巢中见不到卵原细胞(见封三图1C);在放大图中,可清晰看到卵膜和由扁平滤泡细胞组成的滤泡上皮(见封三图1D)。实验开始前样本和对照组卵巢一样正常发育,卵巢腔由于受到挤压而缩小。32 ℃高温明显抑制了卵巢的发育,卵巢腔由于卵母细胞的萎缩而增大,大部分卵母细胞出现异常。卵黄发生前期卵母细胞由正常的噬碱性就成深蓝黑色,而卵黄发生期细胞部分细胞核消失,部分卵母细胞还存在卵膜,但是所有的卵泡上皮都已溃散(见封三图1E-F)。32℃高温和白消安注射对生殖细胞的凋亡作用更加明显,基本看不到正常的生殖细胞,并且有大量的黄褐色染色物存在,说明巨噬作用大量发生[10]。以放大图为样本计算卵巢切片截面(1 200 μm×800 μm)的无细胞空白面积比例。统计结果显示(见封三图2):起始样本S和对照C组中,空白面积主要为卵巢腔,所占比例分别为:38%±1.0%和4.1%±1.0%,两者之间没有显著性差异(P>0.05)。高温HT组和高温-白消安HTB组的空白面积包括细胞碎片和巨噬作用残体等,空白面积所占比例分别高达58.6%±1241%和75.8%±1024%,均显著高于起始样本S和空白对照C组的空白面积比例(P<005),而HTB组卵巢的空白面积所占比例又显著地高于HT组(P<005)。
2.3 温度和白消安对精巢发育的影响
在实验开始前,雄鱼精巢为Ⅱ期,精巢中以精原细胞为主(见封三图3A-B)。实验结束时,空白对照组C的雄鱼精巢发育良好,此时为Ⅲ期精巢,生殖细胞以精母细胞为主,与实验开始前相比精原细胞大幅减少(见封三图3C-D)。高温HT组出现大量呈空泡状的精小囊(见封三图3E),同时依然存在充满精母细胞的正常精小囊,精小囊边缘零星分布着精原细胞(见封三图3F)。高温-白消安HTB组中,精原细胞全部消失,精小囊中的生殖细胞也全部凋亡。以放大图为样本计算切片截面(400 μm×600 μm)中无生殖细胞精小囊占总精小囊数的比例。起始样本S不存在无生殖细胞精小囊,不作统计对比。统计结果显示(见图4):空白对照组C生殖细胞凋亡精小囊占总的精小囊的比例为32%±06%,有些明显为切片操作引起的组织缺失。高温HT和高温-白消安HTB组诱导的生殖细胞凋亡的精小囊占总的精小囊的比例分别高达872%±8.4%和100.0%±0.0%,均显著高于空白对照C组的生殖细胞凋亡精小囊所占比例(P<005),而高温-白消安HTB组诱导生殖细胞凋亡的精小囊所占比例又显著地高于HT组(P<0.05)。
3 讨论
在本研究中发现,32 ℃高温条件下,对星点东方鲀生长和成活都没有影响。但高温和白消安组明显引起实验鱼表现出食欲下降和消瘦,且有约8尾鱼(36.4%)体表出现溃疡,并且在实验刚结束的37 d出现两尾死亡。银汉鱼性腺枯竭实验也存在类似的现象[20-21],25 ℃水温下8个星期内按照40 mg/kg剂量注射白消安2次,最终导致雌鱼表皮出现溃疡并且增加了死亡率。而该课题组进而通过降低每次雌鱼的白消安注射剂量最终避免了出现病理现象[10]。在Lacerda(2006)[9]的罗非鱼实验中,白消安的最大注射剂量为18 mg/kg,总计注射2次,均低于本实验注射剂量和注射频率,没有发现表皮溃疡和死亡。因此,推测实验过程中的生长和死亡率跟白消安剂量和注射频率相关。而Suzuki(1995)[22]研究二甲基亚枫DMSO对虹鳟、银汉鱼、青鳉这三种鱼的胚胎的毒理发现,高浓度的DMSO增加了这三个鱼种的死亡率。所以也有观点认为白消安处理组的死亡率是由白消安的溶剂DMSO浓度引起。意识到DMSO潜在的危害性,一些学者在相似研究中均采用相对低浓度的DMSO溶解白消安,最终受体鱼的死亡率都不大高[9,13,21,23-26]。今后有必要进一步开展筛选适宜的白消安剂量和DMSO浓度,既能有效凋亡内源生殖细胞又能保证制备出的受体鱼体质强壮。
GCT技术在种质资源保护和商品鱼繁育方面是非常有效的方法。通过植入消除内源性细胞成鱼体内GCT能够短时间内获得供体子代。此种方法可以较快地挽救濒危物种和加快选择育种进程。在哺乳动物和鸟类中,多次注射白消安、X - 射线或γ - 射线照射、高温促使内源性生殖细胞凋亡[5-8]。而鱼类由于性腺位于腹腔中,用射线照射比较困难,如果通过外科手术暴露出来不大切合实际。所以在鱼类中多采用通过高温培育、多次注射白消安的方法进行生殖细胞枯竭实验[9,13,21,23-26]。
高温能够促进鱼类生殖细胞凋亡。本研究结果与罗非鱼[9]、银汉鱼[21]、斑马鱼[11]和高身丽脂鲤[23]的实验结果相似,单因子高温就可以引起星点东方鲀雌、雄鱼的内源生殖细胞的凋亡。在雄鱼精巢中观察到精小囊内生殖细胞凋亡,形成空泡状精小囊,Lacerda(2006)[5]将其描述为仅有支持细胞的精小囊(Sertoli cell-only cysts),本实验高温组空泡状精小囊就可以达到87.21±842%。在雌鱼卵巢中,我们可以观察到大量的退化异常卵母细胞,细胞个体萎缩变小进而引起卵巢腔的增大。然而De Alvarenga 研究与其他已发表的数据恰恰相反,发现尼罗罗非鱼在相对较低一点儿的温度下也能获得生精细胞较高凋亡[27]。虹鳟鱼[28]、丽脂鲤[23]、银汉鱼[21]在生长适宜温度下性腺指数(GSI)没有多大变化,而一旦转入高温组,GSI显著地降低。一方面间接说明高温引起了性腺生殖细胞的凋亡,另一方面也证明了高温对受体鱼性腺存有潜在的危害性。所以,今后有必要进一步深入研究温度对星点东方鲀性腺的影响。
以往的研究报道表明实验高温配合白消安注射能有效加强对生殖细胞的凋亡作用[9,13,21,23-26]。在本研究中,高温-白消安HTB组的卵巢空白面积和精巢中空泡状精小囊比例均显著高于高温HT组(P<0.05)。在高温HT组中(图1F),部分卵母细胞的扁平滤泡上皮已经溃散,卵母细胞由正常的噬酸粉红色变为噬碱性的蓝色,而在高温-白消安组除去大部分生殖细胞已经凋亡外,还出现大量巨噬作用产生的黄褐色染色物,其他鱼类也有相似的报道[20,29-30]。我们是否可以推断,高温对雌、雄生殖细胞的作用是相同的,只是由于卵母细胞个体巨大,其退化溃败有赖于巨噬細胞作用,这是一个需要时间的过程。
参考文献:
[1] WANG Q L, ZHANG H T, REN Y Q, et al. Comparison of growth parameters of tiger puffer Takifugu rubripes from two culture systems in China[J].Aquaculture,2016,453(13):49-53.
[2] 赵雅贤,周勤,于清海,等.鱼类生殖细胞移植技术的发展及应用前景[J].中国水产科学,2017,24(2):414-423.
[3] MIYAKI K. Biological study of hybrid pufferfishes of the genus Takifugu,Tetraodontidae[D].Nagasaki:Nagasaki University,1992.
[4] BRINSTER C J, RYU B Y, AVARBOCK M R, et al. Restoration of fertility by germ cell transplantation requires effective recipient preparation[J]. Biol Reprod ,2003,69:412-20.
[5] OGAWA T, DOBRINSKI R, BRINSTER R L. Recipient preparation is critical for spermatogonial transplantation in the rat[J].Tissue Cell,1999,31:461-472.
[6] BRINSTER R L, AVERBOCK M R. Germline transmission of donor haplotype following spermatogonial transplantation[J]. Proceedings of National Academy of Science USA, 1994, 91: 11303-11307.
[7] van den AARDWEG G J, de RUITER BOOTSMAN A L, KRAMER M F, et al. Growth and differentiation of spermatogenetic colonies in the mouse testis after irradiation with fission neutrons[J]. Radiat Research ,1983,94:447-463.
[8] ROCKETT J C, MAPP F L, GARGES J B, et al. Effects of hyperthermia on spermatogenesis, apoptosis, gene expression,and fertility in adult male mice[J]. Biology of Reproduction, 2001, 65: 229-239.
[9] LACERDA S M S N, BATLOUNI S, SILVA S, et al.Germ cells transplantation in fish:the Nile-tilapia model[J].Anim.Reprod.,2006,3(2):146-159.
[10] MAJHI S K,HATTORI R S,RAHMAN S M,et al.Surrogate production of eggs and sperm by intrapapillary transplantation of germ cells in cytoablated adult fish[J].PLos One,2014.9(4):e95294.
[11] NOBREGA R H,GREEBE C D,van de KANT H,et al.Spermatogonial stem cell niche and spermatogonial stem cell transplantation in zebrafish[J].PLoS One,2010,5(9):e12808.
[12] LEE K,YAMAGUCHI A,RASHID H,et al.Germ cell degeneration in high-temperature treated pufferfish,Takifugu rubripes[J].Sexual Development,2009,3(4):225-232.
[13] 岳朝霞,高書堂,邓凤姣,等.乌鳢卵巢发育的组织学研究[J].武汉大学学报:自然科学版,1996,42(2):226-232.
[14] 张耀光,杨桂枝.南方鲶卵子发生的超微结构研究[J].西南师范大学学报:自然科学版 2004,29(2):25-31.
[15] 张贤芳,张耀光,王志坚,硬骨鱼类的卵巢发育和卵子发生研究综述[J].海南师范大学学报:自然科学版 2006(1):71-78.
[16] LUBZENSE,YOUNGG,BOBEJ,et al.,Oogenesis in teleosts:How fish eggs are formed[J].General and Comparative Endocrinology 165 (2010) :367-389.
[17] 杨艳平,温海深,何峰,等.许氏平鮋精巢的形态结构与发育组织学[J].大连海洋大学学报.2010,25(5):391-396.
[18] SCHULZ R W,de FRANA L R,LAREYRE J,et al. Spermatogenesis in fish[J].General and Comparative Endocrinology,2010,165(3):390-411.
[19] GENTEN F,TERWINGHE E,DANGUY A. Atlas of fish histology[J].Journal of Fish Biology,2009,75(3):757-758.
[20] MAJHI S K,HATTORI R S,RAHMAN S M,et al. Experimentally induced depletion of germ cells in sub-adult Patagonian pejerrey(Odontesthes hatcheri)[J]. Theriogenology, 2009 71(7):1162-1172.
[21] MAJHI S K,HATTORI R S,YOKOTA M,et al.Germ cell transplantation using sexually competent fish:an approach for rapid propagation of endangered and valuable germlines[J]. Plos one,2009,4(7):e6132.
[22] SUZUKI T,KOMADA H,TAKAI R,et al.Relation between toxicity of cryoprotectant DMSO and its concentration in several fish embryos[J].Fish Sci,1995,61:193-7.
[23] de SIQUEIRA-SILVA D H,SILVA A P,NINHAUS-SILVEIRA A,et al.The effects of temperature and busulfan (Myleran) on the yellowtail tetra Astyanax altiparanae (Pisces,Characiformes) spermatogenesis[J].Theriogenology,2015,84(6):1033-1042.
[24] LACERDA S M S N,BATLOUNI S R,COSTA G M,et al.A new and fast technique to generate offspring after germ cells transplantation in adult fish:the Nile tilapia (Oreochromis niloticus) model[J].PLoS One,2010,5:e10740.
[25] No′ BREGA R H,GREEBE C D,van de KANT H,et al.Spermatogonial stem cell niche and spermatogonial stem cell transplantation in Zebrafish[J].PLoS One,2010,5(9):e12808.
[26] LACERDA S M S N,BATLOUNI S R,ASSIS L H,et al.Germ cell transplantation in tilapia (Oreochromis niloticus) [J].Cybium ,2008,32:115-8.
[27] de ALVARENGA R,de FRAN A L R.Effects of different temperatures on testis structure and function,with emphasis on somatic cells,in sexually mature Nile tilapias (Oreochromis niloticus) [J]. Biol Reprod,2009,80:537-44.
[28] BILLARD R.Attempts to inhibit testicular growth in rainbow trout with antiandrogens (cyproterone,cyproterone acetate,oxymetholone) and busulfan given during the period of spermatogenesis[J].Gen Comp Endocrinol,1982,48:33-8.
[29] BLAZER V S.Histopathological assessment of gonadal tissue in wild fishes[J].Fish Physiol Biochem 2002;26:85-101.
[30] KOBAYASHI T,TAKEUCHI Y,TAKEUCHI T,et al.Generation of viable fish from cryopreserved primordial germ cell[J]. Mol Reprod Dev,2007,74:207-13.
Abstract:In order to study the effects of high temperature and busulfan injection on germ cell depletion of grass puffer,the growth,survival and germ cells apoptosis of grass puffers in 32 ℃ high temperature group (HT group),32 ℃ high temperature - busulfan group (HTB group) and control group were compared. The results showed that:In HTB group, the fish weight and fattiness were significantly lower than that of other groups (P<0.05),but the total length has no significant difference with that of other groups (P>0.05).The survival rates of all groups were above 90.9%.The effects of germ cell apoptosis in HTB group were more obvious than that of the HT group,of which the normal germ cells of ovaries basic can not be seen.Furthermore,there were a lot of depositions of yellowish-brown caused by phagocytosis and the blank area ratio caused by germ cell apoptosis was significantly higher than that of the HT group (P<0.05).The proportion of Sertoli cell-only cysts/seminiferous tubules caused by testis germ cell apoptosis in HTB group reached up to 100.0%±0.0% and was significantly higher than that of HT group(P<0.05).Conclusion: It was relatively more easy to get recipients with a large number of endogenous germ cell apoptosis for germ cell transplantation in HTB group.
Key words:Grass puffer(Takifugu niphobles); high temperature; busulfan; germ cell; transplantation

