饲料中维生素D3的添加水平对黄颡鱼幼鱼生长和Toll样受体TLR18、TLR19和TLR21的影响
郭 勋 程 珂 马春松 陈 昕 王春芳
(华中农业大学水产学院, 淡水水产健康养殖湖北省协同创新中心, 池塘健康养殖湖北省工程实验室, 武汉 430070)
维生素D是一种脂溶性维生素, 一般来说, 鱼类不能合成维生素D, 必须依靠摄食来满足其需求[1],维生素D3(VD3)是维生素D最重要的形式, 经鱼体吸收后转化为活性维生素D3, 维生素D3与存在于细胞核内的特异性受体(Vitamin D Receptor, VDR)结合后, 在基因转录水平上发挥其重要的调控功能[2]。维生素D3的经典作用主要是维持矿物质的稳态、参与鱼类内分泌等[3], 除经典作用外, 在哺乳动物中越来越多的研究表明, 维生素D还可以影响免疫细胞细胞因子的分泌和表达, 从而影响免疫细胞的增殖和凋亡[4], 维生素D3还参与了蛋白质激酶C(Protein Kinase C, PKC)、MAP激酶(Mitogen-activated Protein Kinase, MAPK)、磷脂酶C(Phospholipase C,PLC)和磷脂酶D(Phospholipase D, PLD)等免疫相关通路[5,6], 相关实验证明维生素D3也可以有效地干预病毒感染[7]。尽管这些报道表明维生素D3/VDR调节免疫系统功能在哺乳动物中的作用, 但其对鱼类营养免疫的作用机理, 有待深入探索。
Toll样受体(Toll-like Receptors, TLRs)是一类重要的病原体识别分子的受体(Pathogen Recognition Receptors, PRRs), 是沟通机体的先天免疫和获得性免疫的桥梁[8]。TLRs属于Ⅰ型跨膜蛋白, 主要有富含亮氨酸系列的胞外区、富含半胱氨酸系列的跨膜区和含TIR(Toll-interleukin-1 Receptot)的胞内区3个典型的功能区组成, 胞外区能特异性识别病原体, 胞内区能激活信号通路, 从而调节免疫应答[9], 鱼类TLR基因种类较哺乳类动物更多, 目前在硬骨鱼类至少发现了20种, 其中TLR18、19、20、21、22、23为鱼类所特有[10], 不同的TLRs识别的病原体不同, 细胞外的TLRs主要检测脂质和蛋白质的配体, 细胞内的TLRs主要检测核酸的配体[11]。已有研究表明,TLR18可以感受PGN(肽聚糖)、LPS(脂多糖)、Poly(I∶C)(聚肌细胞酸)和寄生虫的刺激,除上述刺激物外,TLR19和TLR21还可以感受病毒的刺激[12], 三种基因特异性识别病原体后, 启动一系列信号级联, 从而导致免疫因子的产生[13], 然而其具体的作用机制仍待进一步研究。
黄颡鱼(Pelteobagrus fulvidraco)是我国重要的淡水养殖品种, 由于其较高的市场价值, 黄颡鱼养殖规模日益增大[14]。但在密集的养殖环境下, 细菌性传染病发病的频率越来越高, 造成严重的经济损失, “裂头病”就是一种典型的黄颡鱼疾病, 已有研究表明这种疾病是由鮰爱德华氏菌(Edwardsiella ictaluri)引起的[15]。传统的药物治疗法存在药物残留和耐药性等安全问题, 疫苗预防法存在操作复杂和特异性强的问题。因此, 采用营养调控手段, 来增强黄颡鱼对病原的抵抗力是防治相关疾病的有效措施之一[16]。
本实验通过研究饲料中维生素D3的不同添加水平对鮰爱德华氏菌攻毒前后黄颡鱼主要免疫组织中的三种典型Toll样受体家族基因TLR18、TLR19和TLR21表达的影响, 以期揭示维生素D3在鱼类免疫调控中的作用, 分析黄颡鱼在营养调控后对易感病原抵抗能力的变化, 初步筛选出提高黄颡鱼免疫应答的饲料中维生素D3的适宜水平。
1 材料与方法
1.1 试验饲料的制作
以酪蛋白和脱脂奶粉为蛋白源、玉米蛋白粉为糖源、大豆油为脂肪源配制成5组不同维生素D3含量等氮等能饲料, 饲料组成和营养成分见表1。在饲料制作时, 各原料采取逐级放大法混匀, 最后加入20%的蒸馏水揉匀, 经制粒机加工后粉碎成适宜大小的颗粒, 37℃晾干至饲料水分低于10%,-20℃冰箱保存待用。
1.2 试验鱼及其饲养
试验黄颡鱼购于武汉正好鱼苗厂, 为了使试验鱼适应养殖环境以及排除鱼体残存的维生素D3的影响, 正式试验前进行为期3周的暂养, 暂养期间投喂对照组饲料。在暂养结束后, 试验鱼饥饿24h后称重, 挑选出体格健壮、规格一致的黄颡鱼(5.0±0.2) g 800尾随机放入循环水养殖系统中的20个纤维玻璃鱼缸中(内径85 cm内高70 cm)。每组试验饲料对应4缸重复, 每缸40尾鱼。养殖试验在华中农业大学水产楼附1楼013鱼房内进行。
生长试验持续12周(2017.07.22—2017.10.17),采用饱食性投喂策略, 每天投喂2次(9:00 am和15:00 pm), 每天称取定量的饲料(约为鱼重的6%),投喂时采用多次少量投喂策略, 直至鱼饱食为止,称量剩余饲料量以确定投喂量, 每两周全缸称重以调整投喂量, 试验期间水流约为1.5 L/min, 水温为16.0—26.0℃, 溶解氧浓度大于6.0 mg/L, 氨氮浓度低于0.5 mg/L, pH在8.0左右。
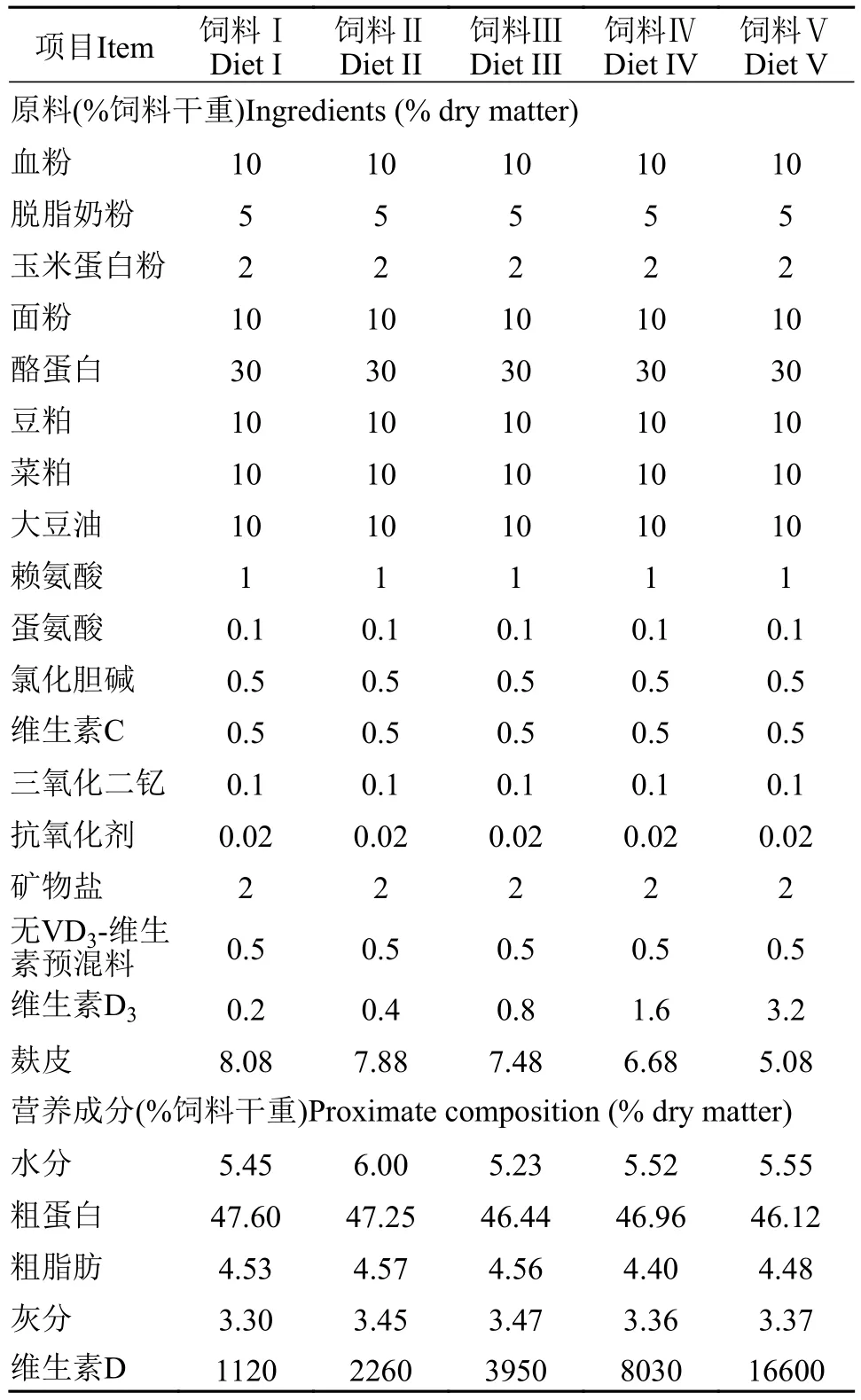
表1 实验饲料组成和营养成分Tab. 1 Formulation and proximate composition of experimental diets
1.3 生长性能的测定
在生长实验结束后, 从每组中取24尾黄颡鱼(每个重复随机取6尾), 称重, 用于计算以下相关生长指标。

式中,WG表示增重率;TGC表示积温系数;FCR表示饵料系数;FE表示饵料效率;SUR表示存活率;FBW和IBW分别为鱼体的末体质量和初体质量;d为养殖天数,t为养殖水温。
1.4 攻毒实验
在生长实验结束后, 每个饲料组随机选取55条黄颡鱼, 注射鮰爱德华氏菌进行攻毒实验, 细菌经脑心浸液培养基(Brain Heart Infusion, BHI)培养后用无菌生理盐水将菌液浓度稀释为3.14×108CFU/mL(攻毒实验前进行预实验确定的致半死浓度), 每尾鱼经腹腔注射0.1 mL的菌液, 攻毒期间不喂食,水体充氧, 不循环, 攻毒后6h开始观察黄颡鱼临床症状, 记录攻毒后黄颡鱼的死亡数, 计算各实验组的死亡率和免疫保护率, 其中免疫保护率(%)=100×(1-实验组死亡率/对照组死亡率); 并于攻毒前 (0)和攻毒后(72h) 采样, 在每个采样点, 每个饲料组分别取6条鱼的头肾、脾脏、肝脏和前肠四个组织,另取6条新鲜黄颡鱼的肌肉、头肾、肾脏、皮肤、脑、鳃、脾脏、胃上皮、小肠和肝脏, 所有取出的组织立即放入液氮速冻, 然后放入-80℃备用。
1.5 指标的测定
主要试剂和仪器 Trizol购自Invitrogen公司, Sample Protector、DL2000DNA Maker、PremixTaqTM(TaKaRaTaqTMVersion2.0)和反转录试剂盒PrimeScript®RT reagent Kit with gDNA Eraser购自宝生生物工程(大连)有限公司, 荧光定量试剂盒HieffTMqPCR SYBR®Green Master Mix(Low Rox Plus)购自翊圣生物科技(上海)有限公司。
引物的设计与合成利用NCBI数据库中的黄颡鱼TLR18基因序列(GenBank: KY123645.1)、TLR19基因序列(GenBank: KY123646.1)、TLR21基因序列(GenBank: KY123647.1)和β-actin基因序列(GenBank: KM673246.1), 利用Primier5.0软件设计相关基因的引物, 引物由上海生工生物公司合成。
总RNA的提取和cDNA的合成取黄颡鱼冷冻组织, 用trizol法提取其总RNA, 提取的总RNA用Nana Drop分光光度计测定其浓度和纯度,A260/A280值在1.8—2.0。琼脂糖凝胶电泳显示28S和18S条带明亮清晰且28S条带亮度是18S的两倍。cDNA第一链的合成参照PrimeScript®RT reagent Kit with gDNA Eraser试剂盒方法进行。首先进行基因组DNA的除去反应。反应体系: 5× gDNA Eraser Buffer 2 μL, gDNA Eraser 1 μL, Total RNA <1 μg, 加无菌蒸馏水至10 μL。反应条件: 42℃2min。然后进行反转录反应。反应体系: 5× Prime Script®Buffer 2 (for Real time) 4 μL, PrimeScript®RT Enzyme Mix Ⅰ 1 μL, RT Primer Mix 1 μL, 基因组DNA除去反应的反应液10 μL, 加无菌蒸馏水至20 μL。反应条件: 37℃ 15min, 85℃ 5s。合成的cDNA放入-20℃冰箱中保存备用。
RT-PCR以得到的cDNA为模板用Quan Studio 6 Flex RT-PCR仪进行扩增, Real-time PCR反应体系: HieffTMqPCR SYBR®Green Master Mix(Low Rox Plus)10 μL, 上下游引物 (10 μmol/L) 各0.4 μL(表2), cDNA溶液2 μL, 加无菌蒸馏水至20 μL。反应条件为: 95℃ 10s, 60℃ 20s, 72℃ 20s, 40个循环。
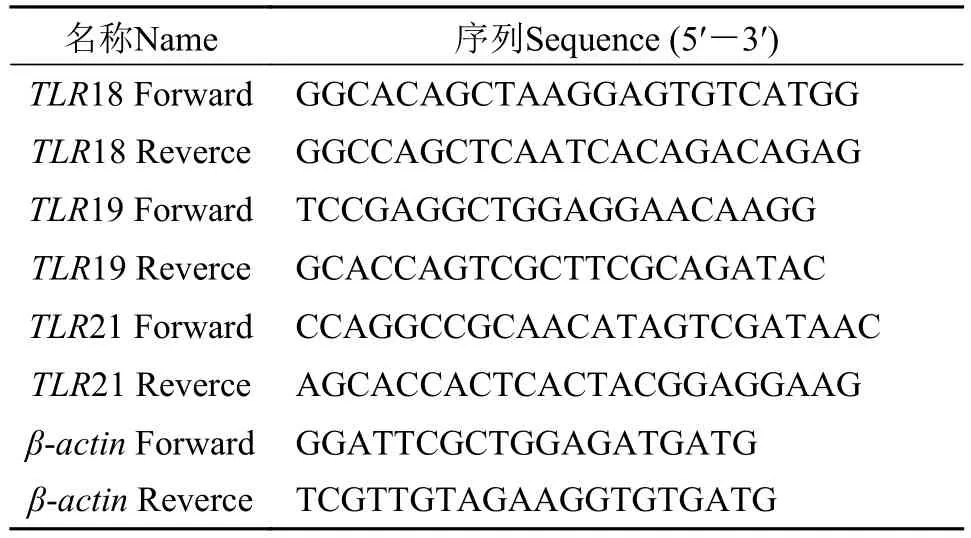
表2 Real-time PCR所用引物Tab. 2 Primers used for real-time PCR
1.6 数据处理
mRNA表达量用2-ΔΔCt法进行相对定量分析, 其中ΔΔCt=(Ct靶基因-Ct内参基因)实验组-(Ct靶基因-Ct内参基因)对照组, 试验数据以平均值±标准误表示,采用SPSS16.0进行单因素方差(One-Way ANOVA)分析, 若组间差异显著(P<0.05), 采用邓肯检验法(Duncan’s)进行多重比较分析。
2 结果
2.1 饲料中维生素D3的添加水平对黄颡鱼生长性能的影响
表3显示, 在饲料中添加维生素D3对黄颡鱼幼鱼的TGC和存活率没有影响(P>0.05)。当维生素D3添加浓度为16600 IU/kg时, 黄颡鱼增重率和饲料效率达到最大, 饲料系数最小(P<0.05)。
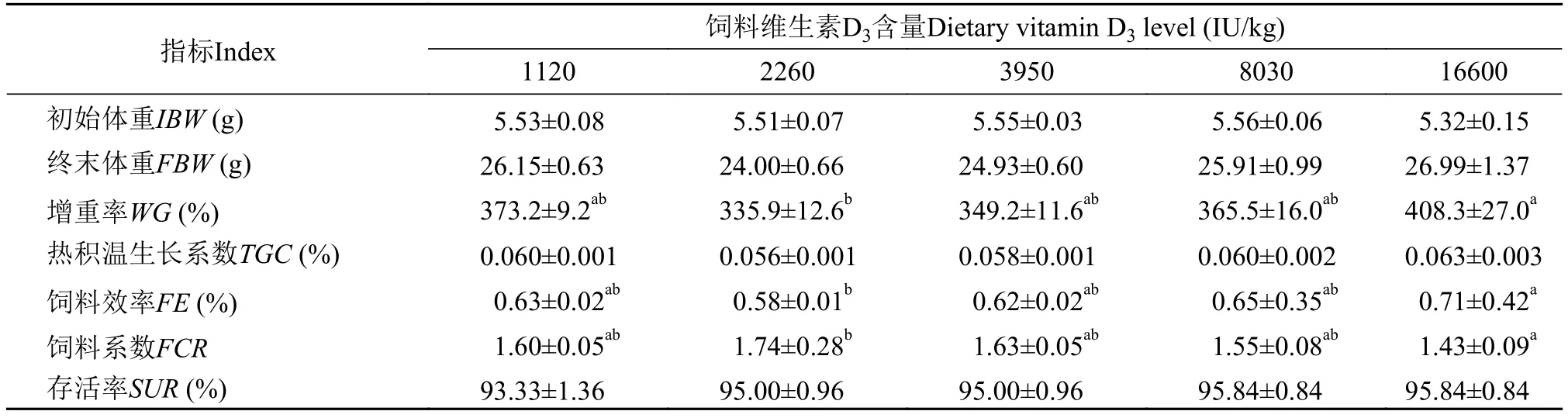
表3 在饲料中添加维生素D3对黄颡鱼幼鱼生长的影响Tab. 3 Effects of dietary vitamin D3 levels on the growth performance of juvenile P.fulvidraco
2.2 饲料中维生素D3的添加水平对活菌攻毒后黄颡鱼的死亡率和免疫保护率的影响
表4显示, 经腹腔注射鮰爱德华氏菌后, 维生素D3浓度为1120 IU/kg时, 黄颡鱼累积死亡率达到最高, 且累积死亡率随着饲料中维生素D3浓度的升高而增大, 免疫保护率随着饲料中维生素D3的浓度升高而减小, 在维生素D3浓度为16600 IU/kg时, 免疫保护率达到最大。
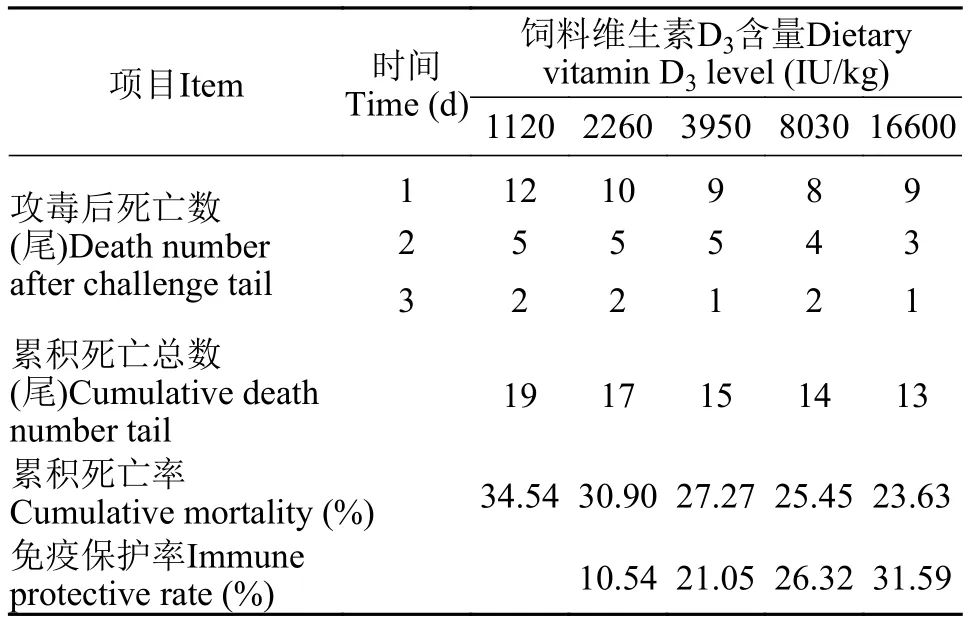
表4 在饲料中维生素D3添加水平对黄颡鱼疾病抗性的影响Tab. 4 Effects of vitamin D3 supplementation on the disease resistance of P. fulvidraco
2.3 黄颡鱼TLR 18、TLR19和TLR21基因的组织分布
以TLR19基因和TLR21基因mRNA表达量最低的肌肉为对照组, 以TLR18基因mRNA表达量最低的脑为对照组, 对肌肉、头肾、肾脏、皮肤、脑、鳃、脾脏、胃上皮、小肠和肝脏中5种基因的mRNA表达量进行相对定量分析, 得到黄颡鱼体内5种基因的mRNA组织表达分布图(图1), 3个TLR受体家族基因在各组织中都分布广泛, 其中,TLR18基因在头肾、脾脏和肝脏中的表达量较高(P<0.05);TLR19基因在头肾和脾脏中的表达量较高(P<0.05);TLR21基因在脾脏中的表达量最高(P<0.05)。
2.4 鮰爱德华氏菌刺激前后黄颡鱼TLR18、TLR19和TLR21基因
TLR18基因mRNA表达量的变化由图2可知, 相对于攻毒前水平, 攻毒后,TLR18 mRNA表达量在头肾、脾脏、肝脏和前肠中就有提高, 头肾中TLR18 mRNA的表达量在饲料VD3含量为2260和16600 IU/kg时显著高于其他处理组, 在8030 IU/kg时表达量最低(P<0.05); 脾脏TLR18 mRNA表达量随饲料中维生素D3含量增加而下降(P<0.05); 肝脏TLR18 mRNA表达量在16600 IU/kg时最高, 在3950 IU/kg时表达量最低(P<0.05); 而在前肠中TLR18 mRNA表达量在低浓度维生素D3处理组(1120 IU/kg)显著高于其他处理组(P<0.05)。
TLR19基因mRNA表达量的变化由图3可知, 和攻毒前相比, 在脾脏、肝脏、前肠以及高浓度VD3处理组的头肾中, 攻毒后TLR19 mRNA的表达量均有所上升。头肾高浓度VD3处理组(16600 IU/kg)该基因表达高于其他处理组, 但没有显著差异(P>0.05); 在脾脏、肝脏和前肠中,TLR19 mRNA表达量总体上随维生素D3水平升高显著下降(P<0.05)。
TLR21基因mRNA表达量的变化由图4可知, 和攻毒前相比, 在头肾、脾脏、肝脏和前肠中, 攻毒后TLR21 mRNA的表达量均高于攻毒前。总体来说, 攻毒后,TLR21 mRNA基因表达随着饲料中VD3浓度的升高而呈下降趋势(P<0.05)。在4种免疫组织中, 高浓度VD3处理组(16600 IU/kg)该基因表达显著低于其他处理组(P<0.05)。
3 讨论
Toll样基因的mRNA广泛的分布在硬骨鱼类中的各个组织中, 但不同的TLR基因在不同的鱼类表达模式不同。已有研究表明, 在斑点叉尾鮰(Ictalurus punctatus)中,TLR18、TLR19和TLR21在脾脏或是在肝脏中表达量最高, 在其他组织中表达量相对较少[17],TLR18在大西洋鲑(Salmo salar)的头肾分布较少, 在肝脏中分布最高,TLR19和TLR21在大西洋鲑的头肾和脾脏中表达量最高[18],TLR21在草鱼(Ctenopharyngodon idellus)的皮肤、头肾和脾脏中表达量相对较高[19]。在本研究中,TLR18、TLR19和TLR21在所检测的组织中均有表达, 其中,TLR18在脾脏中表达量最高, 但在头肾和肝脏中同样高表达, 而TLR19和TLR21在脾脏中的表达量显著高于其他组织, 其次为头肾组织。本结果证实了Wang等[20]在黄颡鱼中的发现, 但与其他鱼中已有的研究成果有所不同, 可能是由于物种的差异性, 同一基因的mRNA在不同鱼类的分布具有特异性。

图1 黄颡鱼TLR18 (A)、TLR19 (B)和TLR21 (C)基因mRNA组织表达分布Fig. 1 Tissue distribution of TLR18(A), TLR19(B), and TLR21(C) mRNA in Pelteobagrus fulvidraco

图2 攻毒前后TLR18 mRNA在黄颡鱼头肾(A)、脾脏(B)、肝脏(C)和前肠(D)中相对表达量的变化Fig. 2 Changes in the relative mRNA expression levels of the TLR18 gene in the head kidney, spleen, liver and anterior intestine after the Edwardsiella ictaluri stimulation
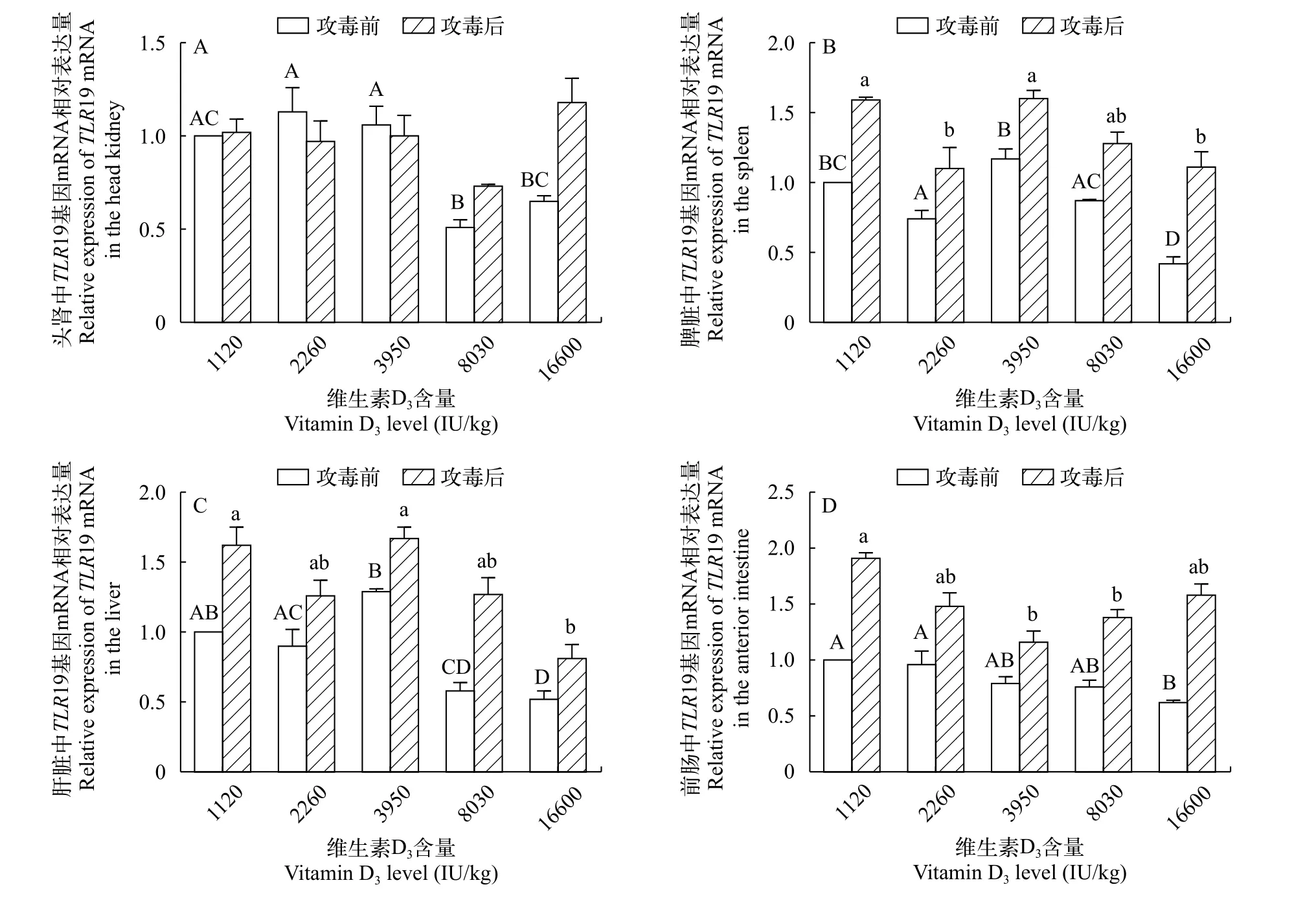
图3 攻毒前后TLR19 mRNA在黄颡鱼头肾(A)、脾脏(B)、肝脏(C)和前肠(D)中相对表达量的变化Fig. 3 Changes in the relative mRNA expression levels of the TLR19 gene in the head kidney, spleen, liver and anterior intestine after the Edwardsiella ictaluri stimulation
炎症是机体自身的一种保护性反应, 以确保消除有害刺激, 修复受损组织的愈合过程, 微生物对细胞的感染会激活炎症反应, 感染的初始由先天模式识别受体(PRRs)介导[21], TLRs是最常见的PRRs,TLRs识别特定的配体, 然后通过MyD88(Myeloid Differentiation Factor 88)信号通路或者TRIF(TIR domain-containing adaptor inducing IFN-β)信号通路, 激活核转录因子(Nuclear Factor κB, NF-κB), 进而产生促炎细胞因子[22]。到目前为止, TLR家族可以分为TLR1/3/4/5/7/11六种亚家族, 我们当前实验研究的主体是TLR18、TLR19和TLR21。TLR18是鱼类特有的基因, 隶属于TLR1亚家族, 已经被证明在硬骨鱼类的免疫中有重要作用[23]。TLR19和TLR21都属于TLR11亚家族, 大部分TLR11亚家族的成员都仅在鱼类和青蛙中发现[24]。TLR18与哺乳动物中的TLR6和TLR10类似, 用嗜水气单胞菌感染草鱼后, 草鱼体内的TLR18表达量会显著升高, 从而激活NF-κB通路, 发生炎症[25]。TLR19基因序列非常保守, 优先作用于细胞内, 能够准确识别寄生虫的感染, 研究已经证实TLR19和斑点叉尾鮰抗小瓜虫(Ichthyophthirius multifiliis)的免疫反应相关[26],TLR21结构与TLR11相似, 牙鲆(Paralichthy solivaceus)受到鳗弧菌(Vibrio anguillarum)感染后, 体内的TLR21表达量上调[27]; 斜带石斑鱼(Epinephelus coioides)中TLR21和抗海水白点虫病(Cryptocaryon irritans)的免疫反应相关[28]。由于TLR18、TLR19和TLR21在病原识别后信号转导的相似性比较高[29], 因此我们可以将此三个基因同时进行研究。在本研究中, 我们探讨了饲料中添加不同含量维生素D3喂养12周后, 再经过鮰爱德华氏菌攻毒后, 脾脏、头肾、肝脏和前肠中TLR18、TLR19和TLR21的表达。结果表明: 和攻毒前相比, 四个组织中攻毒后TLR18、TLR19和TLR21的表达都显著上升。这一结果与Wang等[20]在对经过LPS和Poly(I∶C)刺激后黄颡鱼中报道的结果一致:TLR18、TLR19和TLR21在脾脏、肝脏、头肾和血液中的表达量均增高。与斑点叉尾鮰中结果部分一致: 爱德华氏菌感染斑点叉尾鮰后, 其肝脏和脾脏中的TLR18、TLR19和TLR21表达量显著上调, 但头肾中的TLR18、TLR19和TLR21的表达量会出现显著下调[30]。本研究中的结果和文献中报道的结果都表明,TLR18、TLR19和TLR21在针对革兰氏阴性/阳性细菌和病毒的免疫应答中都起重要作用, 促进了炎症的发生。至于爱德华氏菌感染斑点叉尾鮰后头肾中此3个基因表达模式与黄颡鱼不一致, 也许存在物种特异性, 具体原因还有待进一步研究。
维生素D3是一种具有广泛生理效应的内分泌激素, 动物实验表明其对机体免疫影响的机制在分子水平上可以分为两种, 第一种是维生素D3与免疫细胞的VDR结合, 影响细胞的增殖分化和细胞因子的产生; 第二种是维生素D3可以活化免疫细胞的Toll样受体, 从而发挥免疫作用[31], 鱼类此方面的研究较少, 有关维生素D3在鱼类免疫中作用及机制仍待深入探索。已有研究表明适宜的维生素D3添加量可以显著的提高欧洲鲈(Dicentrarchus labrax)[32]、黄鳝(Monopterus albus)[33]和金头鲷(Sparus auratus)[34]相关免疫基因在免疫组织中的表达量。本实验结果也表明, 饲料中不同的维生素D3的添加水平显著影响TLR18、TLR19和TLR21在黄颡鱼头肾、脾脏、肝脏和前肠4个组织中的表达, 不论是攻毒前还是攻毒后, 维生素D3对此三个基因的影响都存在浓度剂量关系, 证实维生素D3对黄颡鱼免疫的调节作用。总体而言, 以组织表达量最高的脾脏为例,TLR18、TLR19和TLR21的表达基本随着饲料中维生素D3含量的增加而下降, 表明饲料中适宜浓度的维生素D3会促进TLR18、TLR19和TLR21的表达, 高浓度的维生素D3会抑制TLR18、TLR19和TLR21的表达, 维生素D3通过影响相关免疫基因的表达从而避免了鱼体细菌感染的发生。
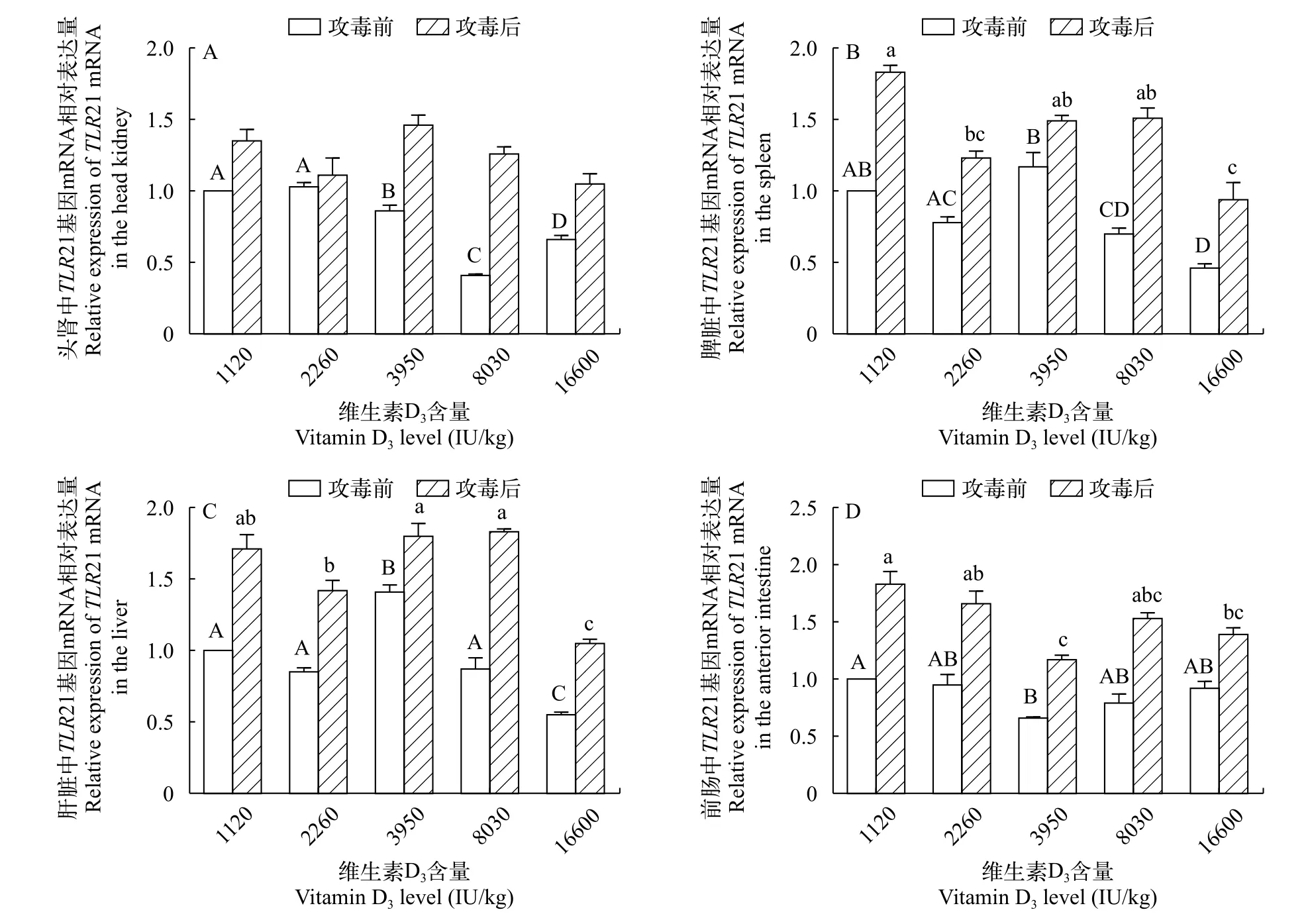
图4 攻毒前后TLR21 mRNA在黄颡鱼头肾(A)、脾脏(B)、肝脏(C)和前肠(D)中相对表达量的变化Fig. 4 Changes in the relative mRNA expression levels of the TLR21 gene in the head kidney, spleen, liver and anterior intestine after the Edwardsiella ictaluri stimulation
4 结论
本研究探讨了黄颡鱼幼鱼经过为期12周的维生素D3营养调控后, 再经致病菌攻毒后, 维生素D3的添加对黄颡鱼生长和Toll类受体TLR18、TLR19和TLR21表达的影响。结果显示, 适宜维生素D3浓度促进黄颡鱼生长和Toll类受体TLR18、TLR19和TLR21表达, 并发现TLR18、TLR19和TLR21在不同组织中的表达和饲料中维生素D3的浓度相关, 本研究结果证实了饲料中添加合适剂量的维生素D3, 可以促进相关免疫基因的表达, 从而增强黄颡鱼对病原微生物的抵抗力, 高浓度的维生素D3会抑制TLR18、TLR19和TLR21的表达, 维生素D3通过影响相关免疫基因的表达从而避免了鱼体细菌感染的发生。本结果为采用添加合适剂量的维生素D3来增强鱼类的免疫能力, 制作能提高鱼类免疫力的饲料提供了研究基础。

