糖尿病合并急性心肌梗死病人血清环状RNA-CDR1as表达及其临床价值分析
惠丽超,邱 刚,赵 韧
近年来,随着我国生活水平提高,人们饮食结构和生活习惯改变,糖尿病患病率有所升高,此类病人多伴血脂异常,以冠状动脉为代表的微血管极易受损,部分病人可出现冠状动脉粥样硬化,是合并急性心肌梗死(AMI)的基本病因,起病凶险,死亡率高[1-2]。目前临床多依赖病人症状、心电图及心肌酶学结果进行判断,部分病人症状不明显,心电图和心肌酶学改变滞后,诊断较为困难,因此寻找针对性、敏感度及特异度更高的血液学指标十分重要[3-4]。环状RNA(circRNA)是一种新型非编码RNA,其不含5′端帽子和3′端Poly(A)尾,而是由共价键直接形成闭环结构,于部分植物类病毒中首次发现,随后在人HeLa细胞质中相继发现,但表达量极低,未引起足够重视;随着研究的不断深入发现circRNA在基因表达调控中占有重要地位,与人类疾病密切相关[5-6]。小脑变性相关蛋白1 反义转录物(cerebellar degeneration-related protein 1 antisense,CDR1as)是人X型染色体CDR1基因外显子反向剪接而成的circRNA,通过与miR-7结合参与多种疾病的发生发展,在肿瘤研究中较多;在心血管方面,Geng等[7]在研究小鼠心肌梗死时发现过表达CDR1as可促进心肌细胞凋亡,提示其与心血管疾病存在一定关系,但相关的临床研究报道较少。本研究选取175例不同糖耐量合并AMI病人进行研究,探讨环状RNA-CDR1as(circRNA-CDR1as)在糖尿病合并AMI病人中的表达情况,并分析其早期诊断价值、疗效评估价值及近期预后预测价值。
1 资料与方法
1.1 临床资料 选取2014年10月—2018年10月于锦州市中心医院收治的175例AMI病人作为研究对象,符合欧洲心脏病学会(ESC)和美国心脏病学会(ACC)联合制定的AMI诊断标准,排除合并恶性心律失常、严重电解质紊乱、肝肾功能严重受损、合并恶性肿瘤、症状出现24 h内未入院者及临床资料不全者。根据口服葡萄糖耐量试验(OGTT)将175例病人分为3组:糖尿病合并急性心肌梗死(DM-AMI)组、糖耐量异常合并急性心肌梗死(IGT-AMI)组和糖耐量正常合并急性心肌梗死(NGT-AMI)组。同期50名健康体检者作为健康对照组。DM-AMI组80例,男49例,女31例;年龄(51.27±11.34)岁;吸烟41例。IGT-AMI组55例,男31例,女24例;年龄(52.82±11.93)岁;吸烟28例。NGT-AMI组40例,男24例,女16例;年龄(50.92±10.85)岁;吸烟23例。健康对照组50名,男28名,女22名;年龄(51.12±11.07)岁;吸烟29名。4组性别、年龄及吸烟等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究所有研究对象均签署知情同意书,并获得锦州市中心医院伦理委员会批准。
1.2 方法
1.2.1 血清circRNA-CDR1as检测 ①标本收集:分别于治疗前后抽取研究对象5 mL空腹静脉血于乙二胺四乙酸(EDTA)抗凝管中,颠倒混匀抗凝剂,4000 r/min离心5min,留取上清血浆于EP管中,并保存于-80 ℃冰箱中。②FQ-PCR检测:先用TRIzol试剂盒提取总RNA,后将其置于Thermo NanoDrop3000紫外分光光度计测量其浓度及纯度,确保OD260/OD280比值在1.8~2.0后进行cDNA合成(参考反转录试剂盒说明书,由上海吉凯科技有限公司帮助完成),后再以cDNA为模板进行FQ-PCR(GAPDH为内参,具体参照SYBR Ⅱ试剂盒说明书),检测仪器为美国ABI公司实时荧光定量聚合酶链反应(PCR)检测仪,以2-△△Ct表示circRNA-CDR1as相对表达水平。
1.2.2 全球急性冠状动脉事件注册(GRACE)评分 根据年龄、心率、收缩压、血肌酐、Killip分级及危险因素(入院时心脏停搏、ST 段改变、心肌坏死标记物升高)计算GRACE 评分,根据GRACE评分情况将其分为低危(≤108分)、中危(108~140分)和高危(≥140分)[8]。
1.2.3 资料收集 收集病人临床资料,包括临床特征(年龄、性别、吸烟史、高血压病史、血压、心率等)、辅助检查结果及病人住院期间生存情况。

2 结 果
2.1 4组血清circRNA-CDR1as比较 DM-AMI组、IGT-AMI组、NGT-AMI组和健康对照组血清circRNA-CDR1as分别为4.98±1.56、4.57±1.28、2.81±0.69和1.02±0.25,4组比较差异有统计学意义(F=18.342,P=0.000),由高到低依次为 DM-AMI组、IGT-AMI组、NGT-AMI组和健康对照组。
2.2 血清circRNA-CDR1as对糖尿病合并AMI的诊断价值 绘制ROC曲线,曲线下面积是0.819(95%CI0.694~0.998,P=0.018),截断值为3.28,敏感度和特异度分别为98.3%和60.0%。详见图1。

图1 血清circRNA-CDR1as诊断糖尿病合并AMI的ROC曲线图
2.3 血清circRNA-CDR1as的疗效评估价值 与治疗前比较,治疗后DM-AMI组、IGT-AMI组和NGT-AMI组血清circRNA-CDR1as均明显降低,差异有统计学意义(P<0.05);DM-AMI组、IGT-AMI组和NGT-AMI组血清circRNA-CDR1as治疗前后差值比较差异有统计学意义(F=8.975,P<0.05),其改变程度由大到小依次为DM-AMI组、IGT-AMI组和NGT-AMI组。详见表1。

表1 各组治疗前后血清circRNA-CDR1as比较(±s)
与同组治疗前比较,①P<0.05。
2.4 血清circRNA-CDR1as水平、GRACE评分与生预后的关系 住院期间,175例AMI病人中35例死亡,140例生存。与生存病人比较,死亡病人血清circRNA-CDR1as水平明显升高,且GRACE评分中危+高危者占比较高,差异均有统计学意义(P<0.05)。详见表2。
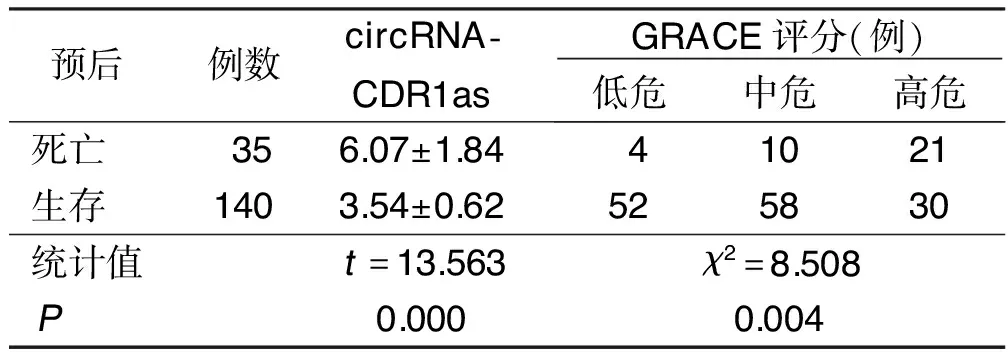
表2 血清circRNA-CDR1as水平和GRACE评分与预后的关系
2.5 血清circRNA-CDR1as水平与GRACE评分的相关性 经Spearman法分析显示,血清circRNA-CDR1as水平与GRACE评分呈正相关(r=0.729,P<0.05)。
3 讨 论
近年来,糖尿病的发病率不断增长,以2型糖尿病为主,预计2030年全球2型糖尿病人将达4.39亿人,主要集中在发展中国家,以中老年人为主[9]。而糖尿病病人极易合并AMI,近远期死亡率均较高,早期明确诊断并进行危险分层以选取最佳治疗方式对减少病人并发症及改善预后十分重要[10]。GRACE是目前预测急性冠脉综合征近远期死亡率及主要心血管事件的重要方法,被多个临床指南认可并推崇[11]。circRNA进化过程中高度保守,在人类不同组织器官中稳定存在,且不易降解,主要通过充当“miRNA海绵”、调控基因转录、调控蛋白生成、翻译蛋白质及调控蛋白质翻译等影响疾病的发生及进展[12]。CDR1as首次被Memczak等[13]发现,序列相对保守,含有74个与miR-7结合的位点,可与miR-7竞争调控miR-7靶基因和靶蛋白活性;有研究发现,miR-7a/b靶基因多聚腺苷二磷酸核糖聚合酶-1[Poly(ADP-ribose)polymerase-1,PARP-1]和特异性蛋白1(specific protein 1,SP1)在AMI发展中可保护心肌细胞不受损害,而体外过表达CDR1as可增加心肌梗死面积,与miR-7作用相反[7]。
本研究结果显示,DM-AMI组、IGT-AMI组、NGT-AMI组和健康对照组血清circRNA-CDR1as比较差异有统计学意义(P<0.05),且呈依次降低趋势,这与Zhang等[14]研究结果基本一致,说明circRNA-CDR1as与糖尿病合并AMI具有一定的关联性。随后,绘制血清circRNA-CDR1as诊断糖尿病合并AMI的ROC曲线图发现,曲线下面积为0.819(95%CI0.694~0.998,P<0.05),截断值为3.28,敏感度和特异度分别为98.3%和60.0%,提示血清circRNA-CDR1as诊断糖尿病合并AMI的敏感性较好,但特异度较低,可考虑合并心肌酶学及心电图等提高其特异性。本研究发现,治疗后病人血清circRNA-CDR1as水平明显降低(P<0.05),其改变程度由大到小依次为DM-AMI组、IGT-AMI组和NGT-AMI组,说明血清circRNA-CDR1as改变在糖尿病合并AMI中更明显,可作为糖尿病合并AMI病人疗效评估的有效指标。此外,本研究还发现死亡者血清circRNA-CDR1as水平和GRACE评分中高危病人占比明显高于生存病人(P<0.05),且血清circRNA-CDR1as水平与GRACE评分呈明显正相关(r=0.729,P<0.05),提示与GRACE评分一样,血清circRNA-CDR1as水平检查可作为急性冠脉综合征预后估测的重要指标,但本研究未探讨两者联合的预测价值,有待后续继续研究。
综上所述,AMI病人血清circRNA-CDR1as水平明显升高,糖耐量不同其表达各不相同,有望成为糖尿病合并AMI病人早期诊断、疗效评估及住院期间死亡预测的有效指标。

