散发性扩张型心肌病相关ISL1基因突变分析
乔祺 杨晨曦 顾佳宁 邸若岷 杨奕清 徐迎佳
扩张型心肌病(DCM)是最常见的心肌疾病,发病率可高达1/250[1]。DCM 主要导致进行性加重的心力衰竭、血栓栓塞、心律失常,其5年死亡率高达50%[2]。DCM 的病因复杂多样,可继发于病毒性心肌炎、冠状动脉粥样硬化性心脏病(冠心病)和先天性心脏病等,但近年的研究发现50%以上的DCM 主要是由遗传缺陷导致。目前已经发现了60多个DCM 致病基因,其中大部分编码心肌节蛋白、细胞骨架蛋白、核膜蛋白和转录因子[3-4]。作为关键的心脏转录因子编码基因之一,ISL1基因突变可导致家族性DCM[4],但ISL1基因在散发性DCM患者中的突变谱仍有待分析。
1 对象与方法
1.1 研究对象
2017年1月至2019年10月,入选226例汉族且家族史阴性的散发性DCM 患者(其中男115例,女111例,年龄为42~65岁,平均年龄48岁)和230名性别和年龄相匹配的无DCM 家族史的汉族健康对照者(其中男117例,女113例,年龄为43~65岁,平均年龄48岁)。全部入选对象均经过详细病史回顾、全面体检、心脏超声检查和常规实验室检查。DCM 的诊断标准:在心脏负荷正常且无冠心病和先天性心脏病等疾病的条件下,左室舒张末期内径>27 mm/m2及左室射血分数<40% 或左室短轴缩短率<25%[4-5]。本研究遵循医学伦理原则,经研究对象知情同意后收集其临床资料和外周静脉血标本约1 mL,使用血液基因组DNA 抽提试剂盒(美国Promega公司)提取基因组DNA。
1.2 方法
1.2.1 ISL1基因的扩增 特异性扩增ISL1基因的全部编码外显子及外显子侧翼部分内含子所用的引物序列见表1。使用热启动Taq DNA 聚合酶(德国Qiagen公司)、基因组DNA 模板和ISL1基因特异性扩增引物等聚合酶链反应(PCR)试剂在T100型PCR 仪(美国Bio-Rad公司)上扩增ISL1基因片段。PCR反应混合物的总体积是50μL,包括5×Q溶液10μL,10×PCR缓冲液5μL,上、下游引物(20μmol/L)各1μL,dNTP(各2.5 mmol/L)4μL,基因组DNA(50 ng/μL)2μL,热启动Taq DNA 聚合酶(5 U/μL)0.5μL,双蒸水26.5μL。所设定的PCR 反应条件见参考文献[5]。PCR 扩增的基因片段经过1.5%琼脂糖凝胶电泳分离后,使用凝胶回收试剂盒(日本TaKaRa公司)进行纯化。

表1 扩增ISL1基因编码区和剪接位点的引物序列
1.2.2 ISL1基因突变谱分析 以回收纯化的PCR扩增产物为模板,使用DNA 荧光测序试剂盒(美国Applied Biosystems公司)和1条ISL1基因特异性扩增引物在T100型PCR仪(美国Bio-Rad公司)上进行测序PCR。测序PCR 混合物的总体积是20μL,包括预混合液8μL,上游引物(2μmol/L)2μL,回收纯化的DNA(20 ng/μL)4μL,双蒸水6μL。使用PCR产物纯化试剂盒(德国Qiagen公司)对测序PCR 产物进行纯化,然后后在3130 XL型DNA 测序分析仪(美国Applied Biosystem 公司)上进行测序分析。
将所测得的ISL1序列与美国Nucleotide数据库(https://www.ncbi.nlm.nih.gov/Nucleotide)中的ISL1序列(登陆号:NM_002202.3)进行比对分析以识别ISL1基因变异。通过比较所检测的基因变异在DCM 患者与正常对照者中的频率以鉴别出DCM 相关ISL1基因突变。对于新发现的ISL1基因突变,检索gnomAD (http://gnomad.broadinstitute.org)、SNP (https://www.ncbi.nlm.nih.gov/SNP)、HGMD(http://www.hgmd.cf.ac.uk/ac/index.php)、PubMed(https://www.ncbi.nlm.nih.gov/Pub Med)和万方(http://librarian.wanfangdata.com.cn)数据库以明确该突变是否已有报道。
1.2.3 突变氨基酸的保守性评估 借助在线软件ClustalW2(https://www.ebi.ac.uk/Tools/msa/clustalw2)分析突变氨基酸在物种进化上的保守性。
1.2.4 ISL1基因突变的致病性预测 使用在线软件Mutation Taster(http://www.mutationtaster.org)、PolyPhen-2(http://genetics.bwh.harvard.edu/pph2)和PROVEAN(http://provean.jcvi.org)分析所发现的ISL1基因突变是否具有致病性。
1.2.5 突变型ISL1的功能分析 构建真核表达质粒野生型ISL1-pcDNA3.1和GATA4-pSSRa以及萤火虫荧光素酶报告基因NKX2.5-luc[4]。以野生型ISL1-pcDNA3.1为模板,使用一对以点突变为中心、长31 bp的引物和定位诱变试剂盒(美国Stratagene公司)通过PCR 产生ASP236Tyr突变型ISL1-pcDNA3.1 并经过DNA 酶DpnI(英国NEB公司)选择和DNA 测序证实。细胞培养及质粒转染方法见文献[4]。同时转染海肾荧光素酶报告质粒pGL4.75(美国Promega公司)作为内对照以避免转染效率对结果的影响。转染后48 h收集、裂解细胞,使用双荧光素酶报告基因分析系统(美国Promega公司)在GloMax-96型荧光定量分析仪(美国Promega公司)上分析细胞裂解液中荧光素酶的活性。以萤火虫荧光素酶与海肾荧光素酶的活性之比值表示靶基因启动子的转录活性。每1次细胞转染实验均按1式3份平行进行,以3次实验结果的平均值作为最终结果进行比较分析。
1.3 统计学分析
病例组与对照组之间连续变量如年龄、靶基因启动子的转录活性等的比较使用Student′s t检验,而两组之间分类变量如性别、种族等的比较根据具体情况使用Pearson′s卡方检验或Fisher′s精确概率检验,以双侧检验值P<0.05表示差异具有统计学意义。
2 结果
2.1 发现ISL1基因新突变
通过直接PCR-测序分析226例散发性DCM患者的ISL1基因,在1例51岁的女性DCM 患者中发现了1个新的杂合突变,其ISL1基因编码核苷酸序列第706位的鸟嘌呤(G)变成了胞嘧啶(T),即c.706G>T突变,该突变可以导致ISL1蛋白氨基酸序列第236位的天冬氨酸(Asp)变成酪氨酸(Tyr),即p.Asp236Tyr突变。经过检索gnomAD、SNP、HGMD、Pub Med和万方数据库,均无ISL1基因c.706G>T突变报道,表明本研究所发现的ISL1基因突变是1个新突变。ISL1基因c.706G>T杂合突变及其纯合野生型对照碱基序列见图1A。野生型ISL1蛋白结构域及所发现的p.Asp236Tyr突变在结构域上的位置见图1B。

图1 ISL1基因c.706G>T杂合突变及其纯合野生型对照碱基序列
2.2 突变氨基酸在跨种进化上完全保守
通过在线软件ClustalW2比对分析人、猩猩、狗、牛、小鼠、大鼠、禽、斑马鱼、果蝇、蚊和线虫等物种的ISL1蛋白序列,结果表明第236位的天冬氨酸在多物种的进化上完全保守(见图2)。

图2 跨物种ISL1蛋白氨基酸序列比对分析结果
2.3 ISL1基因c.706G>T突变具有致病性
本研究所发现的ISL1基因c.706G>T 突变即p.Asp236Tyr突变经MutationTaster预测为致病性突变,预测值约等于1.00;经PolyPhen-2预测为极可能致病突变,预测值等于1.00(敏感性为0.00,特异性为1.00);经PROVEAN 预测为恶性突变,预测值为-8.553。此外,在MutationTaster数据库中没有ISL1基因c.706G>T突变,进一步表明本研究发现的ISL1基因c.706G>T 突变是新突变。
2.4 Asp236Tyr-突变型ISL1功能障碍
在转染的10T1/2细胞中,等量(250 ng)的野生型ISL1-pcDNA3.1(ISL1)和ASP236Tyr-突变型ISL1-pcDNA3.1(ASP236Tyr)对靶基因NKX2-5启动子的转录激活作用分别为(5.61±0.96)倍和(1.66±0.52)倍(t=6.27749,P=0.00329);而在同时转染了等量(250 ng)的野生型GATA4-pSSRa后,所诱导的转录激活分别为(23.82±2.76)倍和(9.18±1.42)倍(t=8.16253,P=0.00123)。见图3。
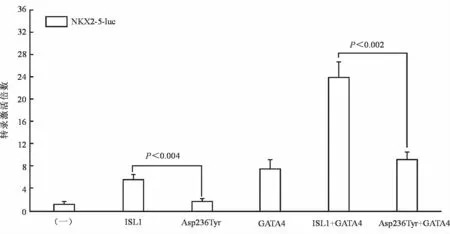
图3 Asp236Tyr-突变型ISL1对靶基因NKX2-5的转录激活功能障碍
3 讨论
本研究在226例散发性DCM 患者中发现了1例患者ISL1基因1个新的杂合错义突变c.706G>T(p.Asp236Tyr),突变率约为0.44%。该基因突变不存在于230名健康对照者,被改变的氨基酸在人、猩猩、狗、牛、小鼠、大鼠、禽、斑马鱼、果蝇、蚊和线虫等多物种的进化上完全保守,在线软件Mutation Taster、PolyPhen-2和PROVEAN 均预测该突变是致病突变。功能分析表明该突变显著降低了ISL1对靶基因NKX2.5的转录激活效应,而且损害了ISL1与GATA4之间的协同激活功能。因此,ISL1基因c.706G>T(p.Asp236Tyr)突变极有可能是该DCM 患者的分子病因,但该基因突变导致DCM 的具体机制仍需要深入研究。
ISL1基因定位于人类常染色体5q11.1,编码一种由349个氨基酸所组成的转录因子蛋白[4]。该蛋白有2个功能上重要的结构域(见图1B),即同源盒结构域(HD)和转录激活结构域(TAD)。ISL1通过HD与靶基因启动子结合,并通过TAD 激活靶基因的表达,从而在胚胎心脏发育和出生后心脏结构重构方面发挥关键作用[6-9]。有研究表明,ISL1可以单独激活或与其转录合作伙伴如TBX20和GATA4等协同激活靶基因MEF2C和NKX2-5等的表达[4],而 TBX20、GATA4、MEF2C 和NKX2-5这些心脏核心转录因子都在心脏发育与重构方面具有重要调控功能,功能缺失性突变不仅可导致先天性心脏病,还可导致DCM[10-16]。因此,ISL1基因突变很可能通过影响MEF2C和NKX2-5等其他心脏关键基因的表达而导致DCM。
ISL1遗传缺陷导致DCM 的易感性增加可部分归因于心脏发育不全和适应性重构不良。在胎心发育期间,第二生心区ISL1-阳性祖细胞产生了流出道细胞以及心房、右心室和左心室的部分细胞[6],来源于诱导多能干细胞、胚胎干细胞、胚胎或出生后心脏组织的表达ISL1的细胞具有多能性,可以形成不同类型的心脏细胞,包括心肌细胞、内皮细胞、起搏细胞以及平滑肌细胞[7-9]。此外,出生后的小鼠、大鼠和人的心肌细胞也存在ISL1+心脏祖细胞,提示ISL1在出生后的心脏再生和适应方面具有重要作用[4,8-9]。在裸鼠心肌梗死模型的梗死区心肌内注入ISL1+心脏祖细胞,可观察到梗死区植入的细胞增殖、分化成心肌细胞,而模型小鼠的心脏血管增生增加,心肌梗死面积减小,心功能增强[17]。在另一项研究中,对心肌梗死小鼠模型植入来源于ISL1+心脏祖细胞的功能性心脏补片,可以改善小鼠心功能,减少左室心肌疤痕面积,减轻心肌纤维化及心力衰竭[18]。这些研究表明ISL1在心脏重构和功能适应方面的重要作用。
总之,本研究发现ISL1基因功能缺失性突变可导致散发性DCM,进一步扩大了DCM 相关ISL1基因突变谱,对DCM 患者的遗传咨询和早期精准医学防治具有一定的意义。

