磁性纳米Fe3O4的制备及其对Cr6+的吸附
张盼青,王利军
(陕西师范大学地理科学与旅游学院,陕西西安 710119)
重金属具有毒性高、难降解、易迁移和易富集等特性,其环境污染已引起人们的广泛关注[1]。铬(Cr)是一种典型重金属,广泛存在于皮革、纺织、印染、金属冶炼与加工、钢铁制造、航空航天等领域废水中[2-3]。Cr有Cr3+和Cr6+之分,Cr6+具有致癌性,人体过量摄入会引起呕吐、腹痛、皮炎等症状[4-6]。因此,从废水中去除Cr已成为一项十分紧迫的课题[7]。氧化法、絮凝法、吸附法、化学混凝法、膜分离法、生物混凝法等众多技术已被广泛应用于含重金属的废水处理中[8-9]。其中,吸附、化学混凝法、沉淀、反渗透、还原等多种处理技术已应用于污水中Cr的处理[10]。化学混凝法和吸附法处理重金属较为相似。化学混凝法是通过向废水中投加化学混凝剂,破坏胶体的稳定性,使细小悬浮颗粒和胶体微粒聚集成较粗大的颗粒而沉淀,得以与水分离,使废水得到净化。吸附法是利用多孔性固体(吸附剂)吸附污水中某种或几种污染物(吸附质)以回收或去除,从而使污水得到净化。另外,化学混凝法大部分是化学方法,而吸附法包括离子交换、物理和化学法;化学混凝法无法保证回用水的质量,而吸附法可以保证[11-12]。此外,化学混凝法的混凝剂有些较为昂贵,吸附剂是采用简单易得的材料制备得到的,且吸附法被证明是最方便、成本最低的方法,效果优于其他方法[13]。
目前,使用的重金属吸附材料种类繁多,如活性炭、硅藻土、沸石、高分子水凝胶、碳纤维、石墨烯、生物质、纳米材料等[14]。这些吸附材料虽然已经广泛使用,但是吸附处理后具有难分离、纳米材料易团聚的缺点。磁性纳米材料具有磁性,吸附后易分离,由于具有比表面积高、生物兼容性强、毒性低、化学性质稳定、表面易改性等特性而被广泛应用[15]。磁性纳米材料改性可以通过表面修饰不同化学基团来实现,常修饰的化学基团包括氨基(-NH2)、羟基(-OH)和羧基(-COOH)等[16]。因此,磁性纳米材料已在化学生物检测(细胞和酶的固定化、生物分离系统、免疫分析、药物传递和生物传感器)、生产制造业、航天航空及国防等方面有着广泛的应用[17]。同时,由于磁选分离具有不产生二次污染、易分离、成本低、效率高、环保等优点,磁性纳米材料被广泛应用于废水中重金属离子的处理[18],且是水体中重金属的理想吸附材料[19]。在众多磁性纳米材料中,磁性纳米Fe3O4因其良好的磁响应效果、稳定的化学性质、高的催化活性以及粒径可控、耐光、毒性低、易制备等特点,被广泛使用[20]。根据国内外文献报道,磁性纳米Fe3O4的制备方法有沉淀法、水热法、微乳液法、溶胶-凝胶法、高温热分解法等[20]。其中,水热法的制备工艺复杂,高温热分解法、溶胶-凝胶法、微乳液法制备出的粒子通常只溶于有机溶剂,生产成本高,而沉淀法制备工艺简单、成本低,适合工业生产[20]。沉淀法分为共沉淀法、氧化沉淀法以及还原沉淀法,其中,共沉淀法是目前制备磁性纳米Fe3O4最普遍的方法。
磁性材料吸附去除Cr的研究已有报道。Farokhi等[21]研究了壳聚糖/氧化铈/氧化铁纳米复合材料对Cr6+和Co2+的吸附;Thinh等[22]研究了磁性壳聚糖对Cr的吸附;Soltani等[23]研究了壳聚糖@骨炭负载的磁性Fe3O4对Cr的去除。这些研究都是对磁性纳米Fe3O4进行了改性,应用成本较高。Pinakidou等[24]基于X-Ray吸收精细光谱,研究了磁性纳米Fe3O4对去除水中Cr6+的钝化机理。然而,很少有研究探索磁性纳米Fe3O4对Cr吸附的动力学、热力学及其影响因素。因此,本文选用共沉淀法制备磁性纳米Fe3O4,并对制备的材料进行表征,重点研究了磁性纳米Fe3O4对Cr6+吸附的动力学、热力学、影响因素及其去除效果,以期为含Cr废水的处理提供科学依据。
1 材料与方法
1.1 仪器和试剂
日本电子公司JEM-2100型超高分辨透射电子显微镜(HR-TEM)、德国布鲁克公司TENSOR II型近红外-中红外光谱仪(FT-IR,光谱为11 000~350 cm-1)、德国布鲁克公司D8 Advance型X-Ray衍射仪(XRD)、麦克默瑞提克(上海)仪器有限公司的多站比表面积及空隙分析仪(BET)、德国斯派克Arcos型电感耦合等离子发射光谱仪(ICP-AES)。
FeCl3·6H2O[分析纯,福晨(天津)化学试剂有限公司]、FeCl2·4H2O(分析纯,天津市大茂化学试剂厂)、NaOH(分析纯,天津市光复科技发展有限公司)、K2Cr2O7(分析纯,天津市博迪化工有限公司)。
1.2 磁性纳米Fe3O4的制备和表征
磁性纳米Fe3O4的制备采用共沉淀法[25]。分别称取2.4 g FeCl2·4H2O和6.5 g FeCl3·6H2O置于250 mL烧杯中,加入225 mL超纯水,超声分散10 min,将混合液倒入500 mL三口烧瓶中。在室温、N2氛围和机械搅拌下,往三口烧瓶滴加1 mol/L的 NaOH溶液90 mL,滴加结束后在60 ℃陈化1 h。反应结束后,用蒸馏水洗至中性,置于磁铁上磁性分离,在60 ℃烘箱干燥,制备得黑色磁性纳米Fe3O4。
采用日本电子公司JEM-2100型HR-TEM、德国布鲁克公司TENSOR II型FT-IR、德国布鲁克公司D8 Advance型XRD和麦克默瑞提克(上海)仪器有限公司的BET对制备的磁性纳米Fe3O4进行表征。
1.3 吸附试验
1.3.1 吸附动力学试验
配制50 mg/L的Cr6+溶液,并准备9个20 mL预先洗干净的顶空瓶。在每个顶空瓶内分别准确加入0.05 g制备的磁性纳米Fe3O4和10 mL浓度为50 mg/L的Cr6+溶液,在25 ℃的恒温水浴振荡器中振荡,振荡频率为150次/min,分别在5、10、15、20、30、45、60、120、180 min时取出顶空瓶,置于磁铁上磁性分离,用德国斯派克Arcos型ICP-AES测定溶液中Cr6+的浓度。每个样品重复3次。
1.3.2 吸附热力学试验
分别配制5、10、20、30、40、50、60、80 mg/L的Cr6+溶液,并准备8个20 mL预先洗干净的顶空瓶。在每个顶空瓶内分别加入0.05 g制备的磁性纳米Fe3O4,依次加入10 mL浓度为5、10、20、30、40、50、60、80 mg/L的Cr6+溶液,在振荡频率为150次/min的恒温水浴振荡器里振荡60 min,置于磁铁上磁性分离,溶液中Cr6+浓度测定同上。每个样品重复3次。分别在15、25、35 ℃进行试验。
1.3.3 吸附影响因素试验
(1)Cr6+初始浓度和温度影响试验
过程和热力学试验相同。
(2)吸附剂投加量影响试验
在6个20 mL预先洗干净的顶空瓶内先分别投加0.01、0.02、0.03、0.04、0.05、0.06 g制备的磁性纳米Fe3O4,再分别加入10 mL浓度为50 mg/L的Cr6+溶液。在25 ℃恒温水浴振荡器里振荡60 min,振荡频率为150次/min,置于磁铁上磁性分离,溶液中Cr6+的浓度测定同上,每个样品重复3次。
(3)pH影响试验
准备7个20 mL预先洗干净的顶空瓶,分别加入0.05 g制备的磁性纳米Fe3O4,依次加入溶液pH值分别为1、2、3、4、5、6、7的浓度为50 mg/L的Cr6+溶液。在25 ℃恒温水浴振荡器里振荡60 min,振荡频率为150次/min,磁性分离,溶液中Cr6+的浓度测定同上,每个样品重复3次。
(4)离子种类和强度影响试验
配置Cr6+浓度为50 mg/L,介质为NaNO3(浓度为0、0.01、0.05、0.10 mol/L)、KCl(浓度为0、0.01、0.025、0.050 mol/L)和Ca(NO3)2(浓度为0、0.01、0.025、0.050 mol/L)。在每个顶空瓶内分别加入0.05 g制备的磁性纳米Fe3O4,以及Cr6+溶液10 mL,在振荡频率为150次/min的恒温水浴振荡器里振荡60 min,置于磁铁上磁性分离,溶液中Cr6+浓度测定同上。每个重复3次。
1.3.4 吸附量和去除率计算
吸附量通过式(1)计算。
(1)
其中:q——吸附量,mg/g;
c0——Cr6+的初始浓度,mg/L;
c——吸附后溶液中Cr6+的浓度,mg/L;
V——溶液体积,L;
m——吸附剂的质量,g。
去除率通过式(2)计算。
(2)
其中:η——去除率。
2 结果与讨论
2.1 磁性纳米Fe3O4的表征
图1为制备的磁性纳米Fe3O4的TEM、FT-IR和XRD表征结果。由图1(a)可知,制备的磁性纳米Fe3O4的大小在50 nm以下,呈球形有序排列,但是表面不是很光滑,且有团聚。由图1(c)可知,制备的磁性纳米Fe3O4在580 cm-1处有特征吸收峰,属于Fe-O的振动峰[26],说明成功制备了磁性纳米Fe3O4。由图1(b)可知,制备的磁性纳米Fe3O4有8个特征峰,2θ角分别为30.1°、35.5°、43.1°、53.4°、57.1°、62.5°、71.5°和74.5°,对应的晶面分别是(220)、(311)、(400)、(422)、(511)、(440)、(620)和(553)。同时,特征峰尖锐而强烈,且没有观察到杂质峰,与Wei等[27]的结果一致,表明制备的磁性纳米Fe3O4纯度较高。由图1(d)可知,磁性纳米Fe3O4具有典型的IV型等温线特征,表明样品表面与样品之间存在较强的相互作用,说明所制备的磁性纳米Fe3O4为介孔材料(孔宽为2~50 nm)。BET对制备的磁性纳米Fe3O4的表征结果表明,制备的磁性纳米Fe3O4的比表面积为17.45 m2/g,无微孔表面积,总孔隙体积为0.14 cm3/g,BJH模型测得吸附平均孔宽为7.84 nm。Yan等[28]表征Fe3O4的比表面积为20.5 m2/g,总孔隙体积为0.133 cm3/g,平均孔宽为25.7 nm,比表面积和总孔隙体积与本试验结果较为一致。

图1 磁性纳米Fe3O4的TEM (a)、 XRD (b)、 FT-IR (c)、 N2 (d)吸附/脱附等温线Fig.1 Image of TEM (a), XRD (b), FT-IR (c), N2 (d) Adsorption/Desorption Isotherm of Magnetic Nano-Fe3O4
2.2 磁性纳米Fe3O4吸附Cr6+的动力学
图2为制备的磁性纳米Fe3O4吸附Cr6+的动力学曲线。由图2可知,磁性纳米Fe3O4吸附Cr6+的过程分为两个部分。第一部分是快速吸附阶段,在前60 min吸附速率很快,吸附量快速增加;第二部分是缓慢吸附阶段,在60 min之后,吸附速率较为缓慢,吸附量基本保持不变,吸附慢慢达到平衡。这表明,磁性纳米Fe3O4吸附Cr6+在60 min基本达到吸附平衡。这与陈忠涛[29]在功能化Fe3O4微纳米结构的合成及其吸附Cr6+中的研究结果一致。
同时,本文对磁性纳米Fe3O4吸附Cr6+的动力学过程进行了研究。表1是利用准一级动力学模型和准二级动力学模型[30]对磁性纳米Fe3O4吸附Cr6+动力学过程的拟合结果。由表1可知,准一级动力学拟合的相关系数(R2=0.966)略大于准二级动力学拟合的相关系数(R2=0.907),平衡吸附量qe在准一级动力学模型中也略大些,达到8.182 mg/g。这说明,准一级动力学更适合用来描述磁性纳米Fe3O4吸附Cr6+的动力学过程。Thinh等[22]研究磁性壳聚糖纳米粒子对Cr6+的去除,Cr6+初始浓度为40 mg/L的动力学平衡吸附量为19.94 mg/L,比本研究的平衡吸附量大,这可能是由于壳聚糖对磁性纳米Fe3O4的负载增加了吸附剂表面的吸附位点,使吸附量增加。
2.3 磁性纳米Fe3O4吸附Cr6+的热力学
图3为磁性纳米Fe3O4吸附Cr6+的热力学曲线。由图3可知,随着溶液中Cr6+平衡浓度的增加,平衡吸附量也增加。但是,当溶液中Cr6+的平衡浓度小于2.5 mg/L时,平衡吸附量增加比较迅速;当溶液中Cr6+的平衡浓度大于2.5 mg/L时,平衡吸附量增加较为缓慢。在3个温度中,随着溶液中Cr6+
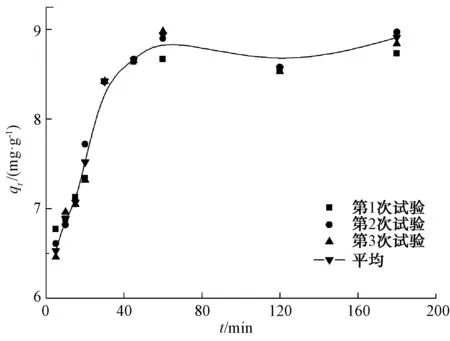
图2 磁性纳米Fe3O4吸附Cr6+动力学曲线Fig.2 Kinetics Curves of Adsorption of Cr6+ on Magnetic Nano-Fe3O4
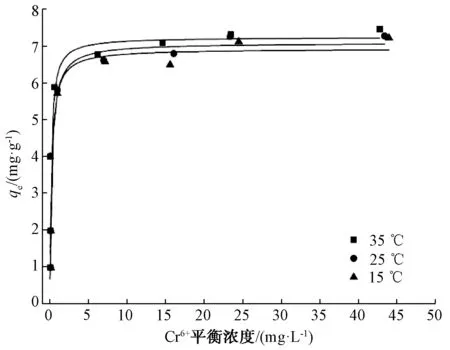
图3 磁性纳米Fe3O4吸附Cr6+的等温线Fig.3 Absorption Isotherms of Cr6+ on Magnetic Nano-Fe3O4

表1 准一级和准二级动学曲线拟合Tab.1 Fitting of Pseudo-First-Order and Pseudo-Second-Order Kinematic Curves
平衡浓度的增加,35 ℃时的平衡吸附量最大,25 ℃次之,而15 ℃时的平衡吸附量最低。表明,随着温度升高,磁性纳米Fe3O4对Cr6+的吸附呈增加趋势,说明此吸附过程为吸热过程。
通常用Langmuir[31]和Freundlich[32]模型来拟合吸附等温线。Langmuir 模型用于简单的单层物理吸附,主要描述吸附剂表面的吸附行为。Freundlich 模型为经验模型,适用于多层离子之间的化学吸附,离子浓度对吸附的影响非常大,随着离子浓度的增加,表层离子之间的交互作用增强,吸附会从2层变成3层甚至更多层。表2是利用Langmuir和Freundlich等温吸附模型对磁性纳米Fe3O4吸附Cr6+等温吸附线的拟合结果。由表2可知,Langmuir等温吸附模型对磁性纳米Fe3O4吸附Cr6+的等温吸附线拟合结果的相关系数R2略大于Freundlich等温吸附模型拟合的相关系数R2(25 ℃除外),说明Langmuir等温吸附模型可以较好地描述磁性纳米Fe3O4吸附Cr6+的等温曲线,这与李专等[33]研究纳米Fe3O4对Cr6+吸附等温线的结果一致。KL为吸附平衡常数,拟合结果大于0,说明磁性纳米Fe3O4对Cr6+的吸附过程可以自发进行,吸附是通过表面物理吸附,最大吸附量分别为7.325 mg/g(35 ℃)、7.083 mg/g(25 ℃)和6.916 mg/g(15 ℃)。但是,在李专等[33]的研究中,pH值为7、温度为25 ℃时,Langmuir等温模型计算的纳米Fe3O4对Cr6+的最大吸附量为13.4 mg/g,高于本研究结果,这可能与试验温度、pH等因素有关。
2.4 磁性纳米Fe3O4吸附Cr6+的影响因素
2.4.1 初始浓度和温度对吸附的影响
图4是初始浓度和温度对磁性纳米Fe3O4吸附Cr6+的影响结果。由图4可知,随着Cr6+初始浓度的增加,平衡吸附量整体呈增加趋势。当Cr6+的初始浓度小于40 mg/L时,温度对平衡吸附量没有显著的影响,平衡吸附量随初始浓度的增加均呈线性增加;当初始浓度大于40 mg/L时,平衡吸附量随初始浓度的增加缓慢增加,且温度越高,平衡吸附量随初始浓度的增加越大(35℃>25℃>15℃)。这与陈忠涛[29]在功能化Fe3O4微纳米结构的合成及其吸附Cr6+的研究中初始浓度和温度对Cr6+吸附的影响相同,在相同温度下,随着Cr6+初始浓度的增加,磁性Fe3O4对Cr6+的吸附量均呈增加趋势,且高温条件下吸附量增加更为明显。
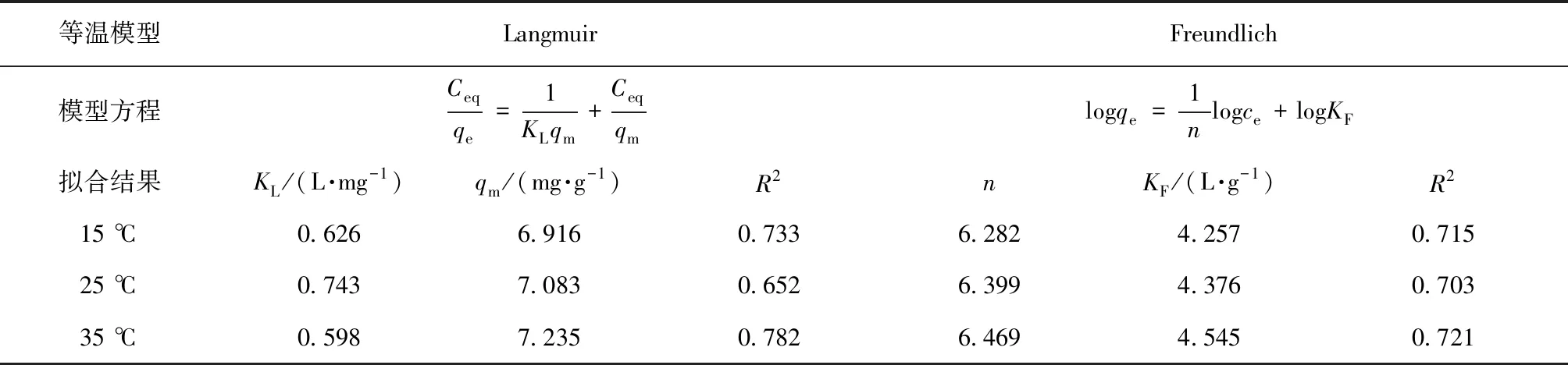
表2 Langmuir和Freundlich 等温模型拟合Tab.2 Fitting of Langmuir and Freundlich Isotherm Models

图4 初始浓度和温度对吸附的影响Fig.4 Influences of Initial Concentration and Temperature on Adsorption
2.4.2 吸附剂投加量对吸附的影响
图5为磁性纳米Fe3O4投加量对Cr6+吸附去除效果的影响。由图5可知,随着磁性纳米Fe3O4吸附剂投加量的增加,吸附去除率先线性快速增加,后缓慢增加。磁性纳米Fe3O4的投加量在0.01~0.06 g时,随着吸附剂投加量的增加,去除率由10%线性增加到85%。这是因为,当溶液中Cr6+浓度恒定时,增加吸附剂的用量即增加可吸附Cr6+的活性吸附位点,吸附去除率随着吸附剂投加量的增加而线性增大。当吸附剂投加量继续增加时,去除率达到92%基本保持不变。李静萍等[34]研究凹凸棒黏土负载纳米TiO2-Fe3O4对Cr6+的吸附去除中发现,随着吸附剂投加量的增加,Cr6+的去除率先线性增加到77%,到达一定吸附剂量后,去除率趋于平稳,保持在77%左右。本研究中吸附剂Fe3O4投加量对Cr6+的去除率可达92%。
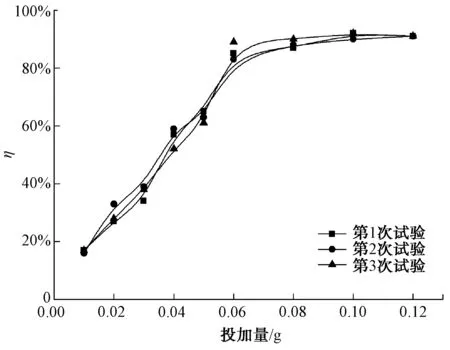
图5 吸附剂投加量对吸附的影响Fig.5 Influences of Adsorbent Dosage on Adsorption
2.4.3 溶液pH对吸附的影响
溶液的pH对吸附剂的表面电荷、电离度、吸附剂与吸附质之间的相互作用以及金属离子的存在形式具有重要的影响,故溶液的pH是磁性纳米Fe3O4吸附去除Cr6+的重要参数,探讨其影响具有重要的意义。溶液pH对磁性纳米Fe3O4吸附Cr6+的影响如图6所示。由图6可知,溶液pH值在1~3时,磁性纳米Fe3O4对Cr6+的平衡吸附量随着溶液pH的增加由7.8 mg/g增加到9.3 mg/g。这可能是由于Fe2+的急剧氧化,致使磁铁矿数量增加,更有助于对Cr6+的还原和吸附[35]。pH值大于3时,磁性纳米Fe3O4对Cr6+的平衡吸附量随着溶液pH的增加由9.3 mg/g降到4.8 mg/g。因此,pH值在1~3时,磁性纳米Fe3O4对Cr6+的吸附去除效果较为明显。Thinh等[22]在磁性壳聚糖纳米粒子对Cr6+的去除研究中显示,pH值为3时,磁性壳聚糖纳米粒子对Cr6+的吸附去除最大,这与本研究中pH值=3时磁性纳米Fe3O4对Cr6+的吸附去除最大相一致。
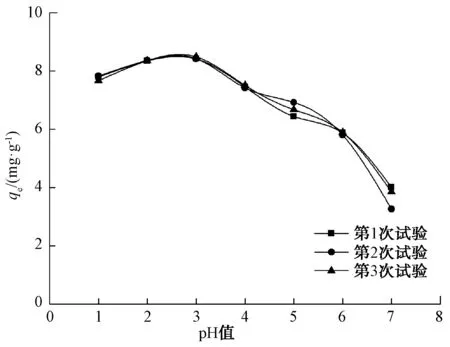
图6 pH值对吸附的影响Fig.6 Influences of pH Values on Adsorption
2.4.4 Na+、Ca2+、K+对吸附的影响
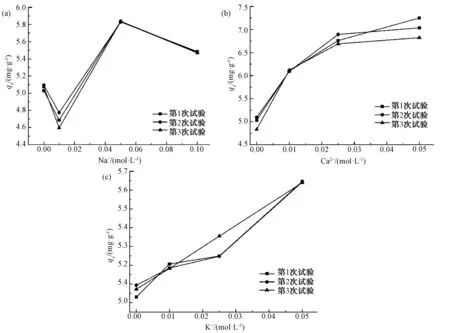
图7 金属离子对吸附Cr6+的影响 (a) Na+; (b) Ca2+; (c) K+Fig.7 Influence of Mental Iron on Adsorption of Cr6+ (a) Na+; (b) Ca2+; (c) K+
3 结论
(1)TEM、FT-IR和XRD表征结果表明,利用共沉淀法成功制备了磁性纳米Fe3O4。
(2)吸附动力学结果表明,准一级动力学方程可以描述磁性纳米Fe3O4吸附Cr6+的动力学过程,在60 min能达吸附平衡,以物理吸附为主。
(3)吸附热力学结果表明,Langmuir等温吸附模型可以描述磁性纳米Fe3O4吸附Cr6+的热力学过程,吸附过程可以自发进行,最大吸附量为7.235 mg/g (35 ℃)。
(4)影响因素结果表明,Cr6+的初始浓度增加,平衡吸附量增加;温度增加平衡吸附量增加;吸附去除率随着吸附剂投加量的增加而增加,达到92%保持不变;溶液pH值为1~3时,磁性纳米Fe3O4对Cr6+吸附去除效果明显;溶液中阳离子种类和浓度对磁性纳米Fe3O4吸附Cr6+具有促进作用。

