妊娠期糖尿病患者血清组织蛋白酶S与HOMA-IR的相关性*
王辰玥, 王蔚, 姜李媛
1杭州市丁桥医院妇产科(浙江杭州 310000); 2杭州市妇产科医院妇产科(浙江杭州 310000)
妊娠期糖尿病是妊娠前糖代谢正常或潜在糖耐量减退,妊娠期才出现的糖尿病,是围生期最常见并发症之一,可导致母婴不良结局,糖代谢多于产后恢复正常,但日后患2型糖尿病机会升高[1]。研究显示,胰岛素抵抗是妊娠期糖尿病的主要发病原因之一,因此尽早发现胰岛素抵抗,做好相关措施控制,对预防妊娠期糖尿病的发生十分重要[2]。临床常用胰岛素抵抗指数(insulin resistance index,HOMA-IR)评价个体胰岛素抵抗水平[3]。组织蛋白酶S(cathepsin S,Cat S)是半胱氨酸蛋白酶中的重要成员,在抗原呈递过程中发挥重要作用,研究发现其在肥胖人群中表达异常,与体质指数(BMI)高度相关[4],因此猜测其在胰岛素抵抗中可能发挥作用。本研究通过分析妊娠期糖尿病患者血清Cat S水平与HOMA-IR的相关性,以期为妊娠期糖尿病发病研究提供新的线索。
1 资料与方法
1.1 一般资料 选取2017年10月至2019年6月在本院产科择期行剖宫术的妊娠期糖尿病孕妇77例为妊娠期糖尿病组,另选取同期择期剖宫术的糖耐量正常孕妇82例为对照组。其中妊娠期糖尿病组孕妇年龄24~35岁,平均(28.71±3.69)岁;孕周24~28周,平均(26.71±2.35)周。纳入标准:符合美国糖尿病学会2016年制定的诊断标准[5],孕妇于妊娠24~28周行75 g葡萄糖耐量试验后,FPG≥5.1 mmol/L,1hPG≥10.0 mmol/L,2hPG≥8.5 mmol/L,血糖有一项超过正常值即可诊断为妊娠期糖尿病;初次妊娠;单胎妊娠;孕前无糖尿病、高血压及家族遗传病史;患者产检资料完整。排除标准:合并严重心肝肺肾脏器功能衰竭者;合并多囊卵巢综合征者;近期使用影响糖代谢药物者;合并高血压;合并肝、肾脏疾病;合并其他代谢类疾病。对照组年龄24~35岁,平均(27.95±3.96)岁;孕周24~28周,孕周(26.92±2.47)岁,均为健康单胎孕妇。本研究经患者知情同意并签署知情同意书,符合医院伦理审查。
1.2 主要试剂及仪器 Cat S活性检测试剂盒(货号:K144-100)购自艾美捷科技有限公司;LDZ4-0.8型离心机购自北京医用离心机厂;BS-220全自动生化分析仪购自深圳迈瑞生物医疗电子股份有限公司。
1.3 方法
1.3.1 标本采集 所有受试者均晨起空腹抽取肘静脉血5 mL,以3 000 r/min离心20 min,小心吸取上清液,置于-80℃冰箱保存。
1.3.2 指标检测方法 记录受试者孕前及入组时体重、身高,分别计算孕前BMI,用BMI1表示、入组BMI用BMI2表示、BMI变化用BMI3表示,BMI3=BMI2-BMI1,并记录受试者TG、TC水平。
采用全自动生化分析仪测所有对象空腹血糖(fasting plasma glucose,FPG)水平,德国罗氏电化学发光免疫分析仪测空腹胰岛素(fins,FIN)水平,稳态评估模型评估HOMA-IR,按照公式HOMA-IR=(FPG×FIN)/22.5计算。酶联免疫吸附法检测血清Cat S水平,检测试剂盒为Cat S活性检测试剂盒(K144-100)(艾美捷科技有限公司),严格按照操作说明书进行。

2 结果
2.1 两组一般临床资料及实验室指标水平比较 两组受试者年龄、孕周、BMI1、TC水平差异无统计学意义(P>0.05);与对照组相比,妊娠期糖尿病组BMI2、BMI3、TG、FPG、FINS、HOMA-IR水平显著升高(P<0.05)。见表1。
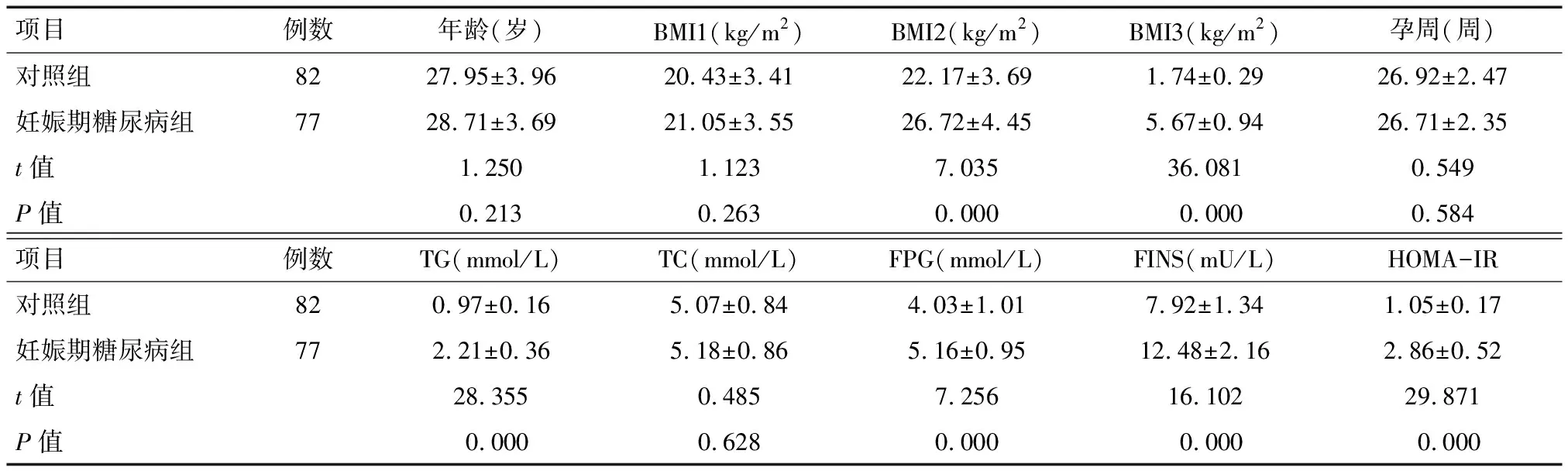
2.2 两组受试者血清Cat S水平比较 与对照组相比,妊娠期糖尿病组患者血清Cat S水平显著升高(P<0.05)。见表2。
2.3 妊娠期糖尿病组血清Cat S水平与各指标相关性分析 Pearson相关性显示,妊娠期糖尿病组患者血清Cat S水平与BMI3、TG、FINS、HOMA-IR水平均呈正相关(r=0.612、0.637、0.517、0.728,P<0.05)。见表3。
2.4 影响HOMA-IR的多元线性回归分析 将HOMA-IR为因变量,以年龄、BMI2、BMI3、FPG、FINS、血清Cat S为自变量进行多元回归分析,结果显示血清BMI3、FPG、FINS、Cat S是HOMA-IR的影响因素(P<0.05)。见表4。
2.5 Logistic回归分析妊娠期糖尿病的危险因素 以是否患有妊娠期糖尿病为因变量,以年龄、BMI2、BMI3、血清Cat S、HOMA-IR、TG为自变量,结果显示,血清BMI3升高、Cat S升高、HOMA-IR升高、TG升高均是妊娠期糖尿病发生的危险因素(OR=1.358、2.035、1.898、1.939,P<0.05)。见表5。
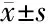
项目例数年龄(岁)BMI1(kg/m2)BMI2(kg/m2)BMI3(kg/m2)孕周(周)对照组8227.95±3.9620.43±3.4122.17±3.691.74±0.2926.92±2.47妊娠期糖尿病组7728.71±3.6921.05±3.5526.72±4.455.67±0.9426.71±2.35t值1.2501.1237.03536.0810.549P值0.2130.2630.0000.0000.584项目例数TG(mmol/L)TC(mmol/L)FPG(mmol/L)FINS(mU/L)HOMA-IR对照组820.97±0.165.07±0.844.03±1.017.92±1.341.05±0.17妊娠期糖尿病组772.21±0.365.18±0.865.16±0.9512.48±2.162.86±0.52t值28.3550.4857.25616.10229.871P值0.0000.6280.0000.0000.000


项目例数Cat S对照组821.03±0.20妊娠期糖尿病组771.48±0.39t值8.129P值0.000
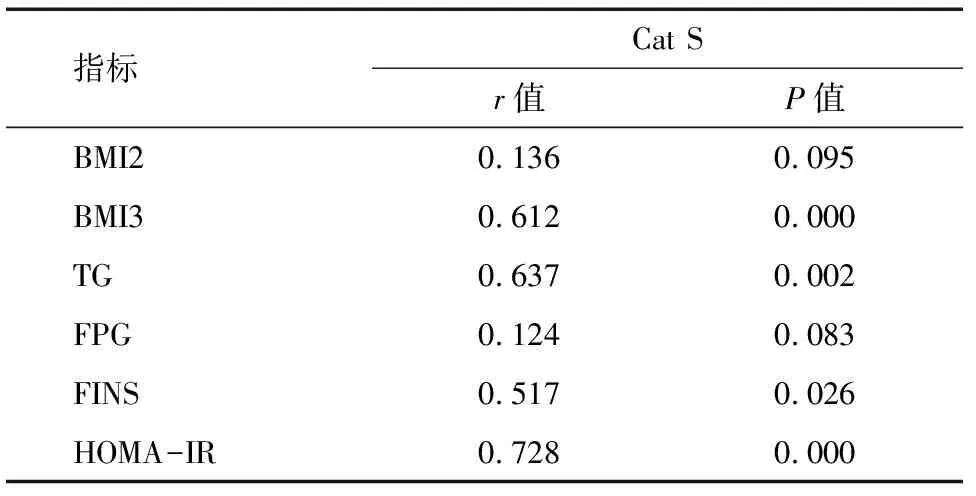
表3 妊娠期糖尿病患者血清Cat S水平与各指标相关性分析
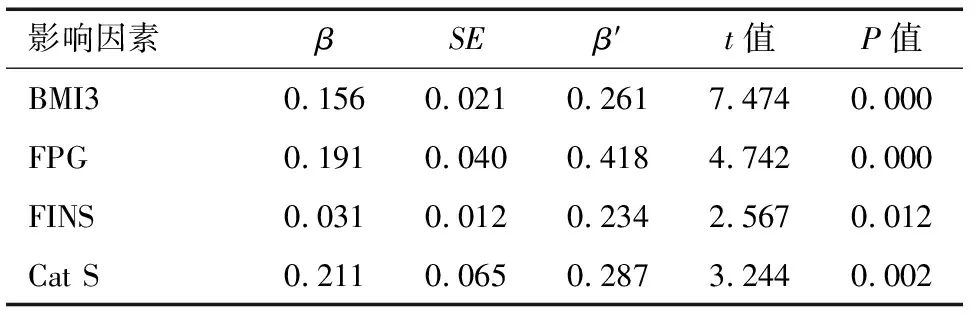
表4 影响HOMA-IR的多元线性回归分析
3 讨论
妊娠期糖尿病发生机制较为复杂,病因、机制尚未完全阐明,目前多认为胰岛素抵抗在其中发挥重要作用。胰岛素抵抗是指各种原因导致胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性分泌过多胰岛素以维持血糖稳定的现象[6]。胰岛素的分子结构功能异常、胰岛素的拮抗激素分泌过多、胰岛素受体的数量下降及结构功能受损等因素,都会影响胰岛素的生物活性以及与受体的结合从而导致胰岛素抵抗的发生。研究表明,胰岛素抵抗常常发生在骨骼肌、肝脏以及白色脂肪组织中[7]。
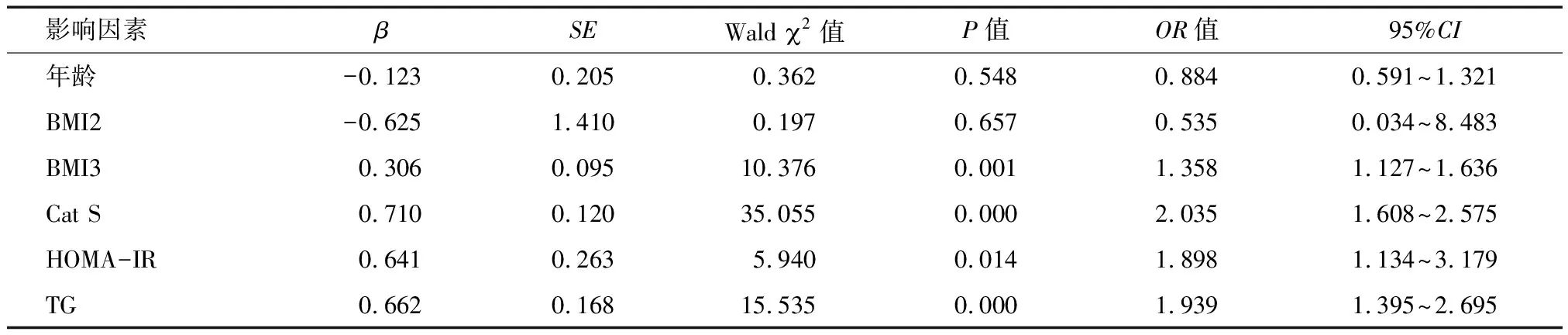
表5 二元logistic回归分析妊娠期糖尿病的危险因素
CatS基因定位于人染色体1q21,主要分布于脾、心脏、淋巴结及脂肪组织中[8]。Cat S是Cat家族的一员,Cat广泛分布于各种细胞溶酶体,是一类组织蛋白水解酶,可水解体内各种酶与蛋白质,调节各种生理与病理反应。CatS基因是首个被发现的与BMI高度相关的基因,脂肪组织本身可分泌炎性细胞因子调控机体胰岛素代谢平衡。肥胖是胰岛素抵抗的重要原因之一,2型糖尿病患者诊断时80%伴有肥胖[9],研究发现高脂饮食诱导的肥胖小鼠胰岛素水平较高[10]。本研究中,妊娠期糖尿病患者多伴随BMI显著升高,李娜等[11]研究显示,肥胖者存在高胰岛素血症,脂肪组织对胰岛素敏感性下降,与消瘦者相比有降低的葡萄糖氧化和升高的脂肪氧化,外周糖摄取率降低。李伟等[12]研究显示,中心型肥胖者血胰岛素抵抗水平较体重健康者严重。Ye等[13]研究显示,在酒精性脂肪肝患者中,患者血清Cat S水平与胰岛素抵抗水平密切相关。本研究中妊娠期糖尿病患者血清Cat S水平显著高于正常孕妇,提示Cat S与妊娠期糖尿病密切相关,可能原因为Cat S调控糖脂代谢参与妊娠期糖尿病进程。本研究中妊娠期糖尿病患者血清FPG、FIN水平与HOMA-IR均显著高于正常孕妇,提示妊娠期糖尿病患者体内存在严重的胰岛素抵抗。
本研究中Pearson结果显示,血清Cat S水平与HOMA-IR、TG呈正相关,提示血清Cat S水平能一定程度上反映胰岛素抵抗水平,糖脂代谢异常及胰岛素抵抗可影响血清Cat S水平,而血清Cat S水平变化可反映胰岛素抵抗程度。Cat S水平上升可能是肥胖状态下机体产生的代偿效应。同时多元回归分析表明血清Cat S水平、FBG、FINS、BMI3水平是HOMA-IR的影响因素,提示血清Cat S变化及孕期BMI变化与HOMA-IR升高密切相关,因此孕期需严格控制体重。此外,Cat S水平、HOMA-IR、TG、BMI3与妊娠期糖尿病独立相关,结合Pearson结果,提示Cat S可能通过影响胰岛素抵抗在妊娠期糖尿病中发挥作用,未来可以研发针对Cat S的抑制剂类药物,用于治疗胰岛素抵抗。
综上所述,血清Cat S可能能作为预测妊娠期糖尿病胰岛素抵抗的指标,孕期监测血清Cat S水平意义重大。通过检测孕期血清Cat S水平变化,可及时采取措施治疗胰岛素抵抗,从而降低产妇及胎儿不良结局,方便有效。本研究也存在一定不足,本研究样本较少,需要做样本扩大试验。

