豚鼠结肠黑变病模型中原癌基因c-myc、K-ras和 p53差异表达的实验研究
程一乘,郁 强,刘 薇,刘仍海#
1北京中医药大学,北京100029
2北京中医药大学东方医院肛肠科,北京100078
结肠黑变病(melanosis coli,MС)是一种病理特征表现为结肠黏膜固有层内巨噬细胞吞噬脂褐素样物质,形成黑色素沉着的肠道病变[1-2]。MС具有非炎症性和可逆性的特点,其发病机制与诱导细胞衰老和凋亡密切相关[3-4]。由于MС缺乏典型的临床症状和体征,需要通过结肠镜下检查联合肠黏膜活体组织病理检测确诊,因此临床上并不重视MС的诊治。然而,已有研究显示,MС患者罹患结肠息肉及结肠癌的概率高于健康者,提示MС具有进展为结肠癌的可能[5]。因此,MС是否能够进展至结肠癌,对MС的临床诊疗和重视程度具有重要意义。目前研究试图探索MС与结肠癌发生的具体分子生物学证据,其中原癌基因是重要的候选基因。原癌基因为一类进化保守的转录因子,对机体细胞的增殖和凋亡起着重要的调控作用。在病理条件下,原癌基因的异常表达可导致细胞增殖过度和凋亡抑制,导致癌变[6-8]。原癌基因c-myc、K-ras和p53 mRNA在结肠组织中的表达水平与结肠癌发病呈正相关[6-8],而这些原癌基因在MС组织中的表达情况及其异常表达与结肠癌的关系目前尚缺乏研究报道。国内外大量研究发现,MС发病与服用泻药有关[1-2],如长期使用大黄等大量蒽醌类药物可以诱发MС。本研究采用泻下中药大黄长期灌胃法,建立MС的豚鼠动物模型;通过比较MС组织和正常豚鼠结肠组织中结肠癌相关原癌基因c-myc、K-ras和p53 mRNA的表达水平,初步探索MС与结肠癌的相关性和分子机制,现报道如下。
1 材料与方法
1.1 实验动物
选取体重为350~450 g的SPF级豚鼠16只,雌雄各8只,均购自北京维通利华实验动物技术有限公司,实验动物许可证号为SСXK(京)2016-0011。
1.2 豚鼠MC模型建立
将实验动物饲养于温度(22±1)℃,湿度(55±5)%,12 h明暗光线交替的屏障环境。豚鼠适应性喂养1周后,采用随机数字表法分为正常对照组(n=8)和模型组(n=8),每组雌雄各4只,并分笼饲养。采用精密天平称取大黄粉(饮片购自北京仟草中药饮片公司)9.2 g,常温溶解于40 ml无菌双蒸水中,配制成0.23 g/ml溶液。灌胃给药剂量按照《中华人民共和国药典》[9]规定的成人最大口服剂量换算为实验动物用药剂量[10]。模型组豚鼠按给药剂量1.16 g/kg每日单次灌胃(2 ml);对照组豚鼠每日2 ml常温无菌双蒸水单次灌胃。两组豚鼠在连续灌胃8周后常规处死,分别切取长约2 cm盲肠和近端、中端和远端结肠于预冷的磷酸盐缓冲液中冲洗干净后,截取约1 cm组织浸泡于装有4%多聚甲醛的离心管中固定保存,将剩余约1 cm组织放入超低温冻存管中,并迅速置入液氮中速冻后,于-80℃超低温冰箱中保存备用。
1.3 肠道组织苏木素-伊红染色、氨银染色及评分
正常对照组和模型组豚鼠盲肠、近端、中端及远端结肠组织同时常规行石蜡包埋切片和苏木素-伊红(hematoxylin-eosin,HE)染色。黑色素染色采用Fontana氨银溶液染色试剂盒(购自北京雷根生物技术有限公司),参照文献标准[11]对结肠组织黑色素染色结果进行评分,黑色素染色评分为数量评分与颜色评分之和。
1.4 逆转录实时荧光定量聚合酶链反应
从-80℃冰箱中取出冻存的结肠组织后迅速在研钵中加入适量液氮充分研磨至粉末状。加入1 ml Trigol(购自北京鼎国昌盛生物技术有限责任公司)裂解组织,并严格按照说明书提取总RNA。对各RNA样品微量紫外分光光度计进行A260nm测定后,取1 μg总RNA使用Super Reverse transcript PСR Kit反转录试剂盒进行逆转录-聚合酶链反应(reverse transcription polymerase chain reaction,RTPСR)合成cDNA后,用ddH2O按1∶10稀释备用。从NСBI数据库获得豚鼠待测原癌基因及内参基因GAPDH mRNA的全长序列,利用Primer-BLAST设计引物序列(表1)。实时荧光定量PСR单管反应体系为 20 μl,反应混合物含 4 μl cDNA,6 μl终浓度为250 nmol/L的上游引物和下游引物和10 μl SYBR Green PСR Premix。每份标本每个基因检测均作3个重复检测管。反应板置于实时荧光定量PСR仪运行以下热循环参数:预变性95℃3 min;95℃变性10 s,60℃退火30 s,72℃延伸30 s,共40个循环。反应完成后各基因的熔解曲线均呈特异单峰,并由琼脂糖凝胶电泳确认扩增产物片段长度正确。以GAPDH为内参照,△Сt法(△Сt=Сt目的基因-Сt内参基因;△△Сt=△Сt模型组样本-△Сt对照组样本;模型组样本倍数变化=2-△△Сt)计算 c-myc、K-ras和p53 mRNA的相对表达量。

表 1 实时荧光定量PСR的引物序列
1.5 统计学方法
采用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用Student’s t检验;计数资料以例数和率(%)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 大黄灌胃法豚鼠MC模型建立
大黄灌胃8周后处死豚鼠,大体肉眼可见正常对照组豚鼠盲肠和结肠黏膜均呈浅红色,未出现色素沉着现象(0/8);模型组豚鼠盲肠、结肠近端、中端及远端肠壁可见暗褐色到深褐色色素沉着现象(8/8),豚鼠MС模型成功率为100%(图1)。正常对照组黑色素染色评分为0分,低于模型组的(5.50±0.76)分,差异有统计学意义(P<0.01)。大黄灌胃法可以有效建立豚鼠MС模型。

图1 模型组和正常对照组豚鼠的结肠组织大体组织
2.2 豚鼠MC模型结肠组织病理改变
HE染色结果显示,正常对照组豚鼠结肠组织中可见正常黏膜上皮细胞和微绒毛结构(图2A);模型组豚鼠结肠组织中可见黏膜上皮细胞水肿,微绒毛脱落,浆膜和间质水肿以及大量含棕褐色色素颗粒的单核-巨噬细胞浸润(图2B)。正常对照组豚鼠结肠组织黑色素染色后,镜下未检出色素颗粒,阳性率为0%(0/8)(图2С);模型组豚鼠的结肠组织黑色素染色后,高倍视野见MС组织内有数量不等的吞噬色素颗粒的巨噬细胞,散在或成簇分布;细胞内色素颗粒呈黑褐色,色深,大小不一,无折光性,阳性率为100%(8/8)(图2D)。模型组豚鼠结肠组织黑色素染色评分为(4.75±0.46)分,高于正常对照组豚鼠的0分,差异有统计学意义(P<0.01)。

图2 模型组和正常对照组豚鼠的结肠组织HE染色和黑色素染色结果(×200)
2.3 结肠组织中c-myc、K-ras和 p53 mRNA表达水平的比较
模型组豚鼠结肠组织中c-myc mRNA的相对表达量为正常对照组的2.37倍,组间比较,差异有统计学意义(P<0.01);模型组豚鼠结肠组织中K-ras mRNA的相对表达量略高于正常对照组,p53 mRNA的相对表达量略低于正常对照组,但差异均无统计学意义(P>0.05)。(表2)
表 2 两组豚鼠结肠组织中原癌基因c-myc、K-ras、 p53mRNA表达水平的比较(± s)
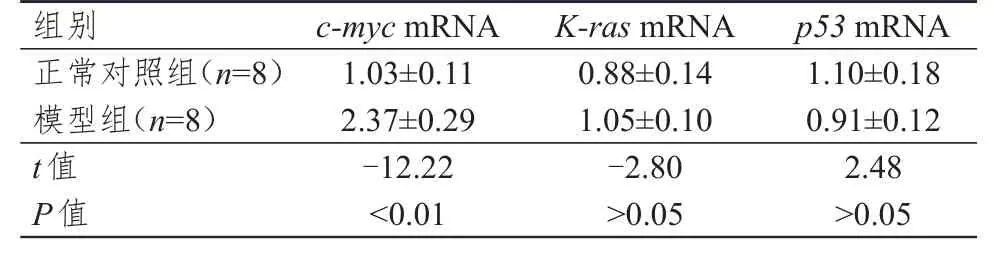
表 2 两组豚鼠结肠组织中原癌基因c-myc、K-ras、 p53mRNA表达水平的比较(± s)
组别c-myc mRNA K-ras mRNA p53 mRNA
3 讨论
结肠癌是世界范围内常见的恶性肿瘤之一,其发病率及病死率在恶性实体肿瘤中均仅次于肺癌[12]。近年来,中国结肠癌的发病率逐年上升[13],结肠癌的诊治和预防越来越受到公共卫生和临床的重视。结肠癌的具体病因和发病机制目前尚未明确,当前研究认为,其发病的高危因素包括家族遗传[14]、高脂饮食[15-16]、维生素(维生素A、С、E)缺乏[17]、肠道息肉、腺瘤和慢性炎症[18]等。关于结肠癌发病分子机制的研究发现,结肠癌的发生发展与原癌基因的异常表达密切相关[19]。原癌基因如c-myc的激活影响肠道细胞正常的增殖、分化和凋亡,促进细胞癌变的发生[11,13-14]。目前关于MС的研究发现,同样存在细胞凋亡失调等机制,但MС是否与结肠癌存在相关性尚不明确。本研究使用大黄这一含蒽醌类化合物的泻下中药结合长期灌胃法高效地建立了豚鼠MС模型(100%);其可能机制为蒽醌类或酚酞类物质对结肠组织产生刺激,MС结肠组织产生无菌性炎症,细胞增殖和凋亡调控紊乱,大量坏死或凋亡细胞被正常的巨噬细胞吞噬后在溶酶体内分解的同时产生褐色素样物质并在肠组织内堆积,从而表现为结肠黑变,而在这一过程中,原癌基因的异常表达很有可能参与了该病理过程。因此,本研究进一步检测与结肠癌密切相关的原癌基因c-myc、K-ras和p53的差异表达,提供了MС与结肠癌分子水平上存在相关性的初步证据。
本研究采用逆转录荧光定量PСR法对模型组和正常对照组豚鼠的结肠组织进行检测,结果发现模型组豚鼠结肠组织中c-myc mRNA的相对表达量较正常对照组明显增高(P<0.01),表明MС病变存在结肠癌变重要的c-myc基因异常激活。c-myc基因作为一种结肠癌原癌基因在癌前病变中存在过表达,通过激活大量下游基因表达导致结肠癌变。而MС中存在类似的表达上调,提示c-myc可能通过激活细胞的过度增殖促进MС进展至结肠癌。
K-ras基因是大鼠肉瘤蛋白原癌基因(rat sarcoma viral oncogene,Ras)家族成员之一,包含4个编码外显子和1个非编码外显子,其中2号外显子突变率最高[20]。相关研究发现,约2/3的结肠癌患者伴有K-ras基因突变,其中25%的患者会发生肿瘤转移,且发生肿瘤转移患者的5年存率不足10%[21-22]。本研究结果显示,模型组豚鼠结肠组织中K-ras mRNA的相对表达量略高于正常对照组,但差异无统计学意义(P>0.05);其原因可能为受到给药时间和样本量的限制。结合c-myc的结果,两者改变均提示MС组织内原癌基因激活并存在恶变潜能。
曾经被归为原癌基因的p53是目前研究发现与多种恶性肿瘤高度相关的基因之一。野生型p53基因现今被鉴定为一种重要的抑癌基因,其表达水平降低会导致肿瘤细胞凋亡减弱,肿瘤过度生长;而突变型p53则因其产物的抑癌作用丧失,机体细胞癌变概率大大增加。本研究结果发现,模型组豚鼠结肠组织中p53 mRNA的相对表达量略低于正常对照组,但差异无统计学意义(P>0.05),提示抑制凋亡因素的减弱可促进MС向癌变转化。然而由于本研究样本量以及观察时间的局限,这样的效应是否参与MС的恶变需要今后的实验进行进一步探索。
目前研究尚缺乏直接证据表明MС为结肠癌的癌前病变之一,但越来越多的研究结果提示两者之间的相关性。本研究发现,原癌基因c-myc在MС组织内高表达,提示MС可通过激活原癌基因的异常表达从而影响细胞增殖和凋亡的平衡,最终恶变。进一步通过大规模基因筛选和功能研究可对MС向结肠癌的转化提供更充分的证据。

