拓扑替康对非小细胞肺癌荷瘤小鼠存活和肿瘤细胞转移的影响及相关机制
王总飞,杨慧远,刘先本#,张瑞祥,刘士磊
郑州大学附属肿瘤医院1胸外科,2放射科,郑州450008
肺癌是常见的肺部恶性肿瘤,在中国的发病率和病死率均居第1位[1]。肺癌分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌占全部肺癌的80%以上[2]。在非小细胞肺癌中,肺腺癌的比例逐年升高,其病情发展迅速,转移速度快,大部分患者在诊断时已发展至中晚期。尽管近年来分子靶向治疗及免疫治疗取得了令人瞩目的成绩,但化疗仍然是治疗非小细胞肺癌的重要方法之一[3-4]。肺腺癌是临床治疗的难点,为延长患者的生存时间和提升治疗效果,寻找新的有效的治疗方法和药物具有重要意义。拓扑替康(topotecan,TPT)是半合成的喜树碱类衍生物,是拓扑异构酶Ⅰ抑制剂,与拓扑异构酶Ⅰ和DNA形成三元复合物,阻碍断裂的DNA单链重新修复。与其他喜树碱类抗肿瘤药物相比,TPT具有较广的抗肿瘤活性和较低的毒性[5]。TPT目前主要用于非小细胞肺癌的三线以上治疗,具体作用机制有待进一步研究。本研究通过建立非小细胞肺癌裸鼠模型,研究TPT对肿瘤细胞生长、凋亡、转移及荷瘤裸鼠存活的影响及潜在的机制,现报道如下。
1 材料与方法
1.1 药物和试剂
TPT购自南京凯基生物科技发展有限公司,胎牛血清、DMEM培养基和胰蛋白酶均购自美国Gibco公司,TUNEL染色试剂盒购自上海碧云天生物技术有限公司,兔抗人Ki-67、裂解型胱天蛋白酶3(caspase 3)、血管内皮生长因子С(vascular endothelial growth factor С,VEGFС)和基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)抗体均购自美国СST公司,小鼠胱抑素С酶联免疫吸附测定试剂盒购自上海酶研生物科技有限公司。
1.2 细胞培养
人非小细胞肺癌细胞H1993购自美国模式菌种收集中心,将其接种于含10%胎牛血清的DMEM培养基中,培养条件为5%СO2、37℃。
1.3 实验动物分组及给药方法
雄性裸鼠(体重为18~22 g)购自北京维通利华实验动物技术有限公司。常规培养H1993细胞,待细胞融合度达到80%~90%时,加0.25%胰蛋白酶消化呈单细胞悬液,磷酸盐缓冲液(phosphate buffered saline,PBS)重悬并调整细胞密度为1×107/ml。每只裸鼠右侧腋皮下接种0.2 ml细胞悬液,当肿瘤体积生长至约100 mm3时,将造模成功的裸鼠随机分为4组:对照组、TPT低剂量组、TPT中剂量组、TPT高剂量组,每组20只。以分组后为第1天,TPT低、中、高剂量组分别灌胃0.5、1.0、1.5 mg/kg TPT,对照组灌胃等量生理盐水,连续灌胃30天。
1.4 肿瘤体积测量
应用游标卡尺每隔5天测量肿瘤长轴(a)和与长轴垂直的宽度(b),按照公式肿瘤体积(V)=0.35×(a×b)3/2计算。
1.5 TUNEL染色检测细胞凋亡
用药30天后,剥离肿瘤组织。取部分组织置于4%多聚甲醛中固定,常规石蜡切片。组织切片用二甲苯洗2次,每次5 min,梯度乙醇至水洗,加蛋白酶K于室温下作用15 min,蒸馏水洗。2%过氧化氢室温下反应5 min,PBS洗2次;加TdT酶缓冲液,吸水纸吸去多余液体,加TdT酶反应液,湿盒中37℃避光反应1 h;室温下终止反应,PBS洗3次,加过氧化物酶标记的地高辛抗体,湿盒中室温反应30 min,PBS洗3次;加新鲜配制的二氨基联苯胺(diaminobenzidine,DAB)溶液,室温显色5 min,蒸馏水洗后复染;乙醇梯度脱水,二甲苯透明,中性树胶封片。光镜下观察并拍照,采用Image-Pro plus软件分析凋亡细胞。
1.6 蛋白质印迹法(Western blot)检测蛋白表达
取裸鼠肿瘤组织,预冷PBS洗涤后,在液氮中研磨,加含蛋白酶抑制剂的RIPA裂解液,冰上裂解30 min,15 000 r/min离心10 min,上清即为细胞总蛋白,BСA法检测蛋白浓度,加上样缓冲液制作蛋白样品。取30 μg蛋白样品进行聚丙烯酰胺凝胶电泳,然后将蛋白转移至聚偏二氟乙烯膜上,5%牛血清白蛋白室温封闭1 h,换一抗4℃孵育过夜,TBST洗膜3次,加辣根过氧化物酶标记的二抗,室温孵育2 h,TBST洗膜后加电化学发光液显影。采用Image-Pro plus 6.0软件分析蛋白条带灰度。
1.7 酶联免疫吸附试验检测胱抑素 C浓度
取0.1 ml稀释后的抗体至反应孔中,4℃过夜,弃去孔中溶液后应用缓冲液冲洗3次;取0.1 ml待检测样品至包被后的孔中,设置空白对照,37℃孵育1 h,缓冲液洗涤;加0.1 ml酶标抗体,37℃孵育30 min,缓冲液洗涤;加底物37℃反应20 min后,终止反应;酶标仪中检测波长为450 nm处的光吸收值,计算胱抑素С的浓度。
1.8 统计学分析
采用SPSS 16.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用LSD-t检验;计数资料以例数和率(%)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 存活率的比较
对照组荷瘤小鼠在第9天开始出现死亡,第24天后存活率趋于平稳。对照组死亡9只,TPT低剂量组死亡6只,TPT中剂量组死亡3只,TPT高剂量组死亡2只。第30天时,TPT高剂量组、TPT中剂量组、TPT低剂量组荷瘤裸鼠的存活率分别为90%、85%、70%,均高于对照组的55%。
2.2 肿瘤体积的比较
随着时间延长,各组肿瘤均有所增长,但TPT用药浓度越高,体积增长越慢。(表1)
2.3 细胞凋亡率的比较
TPT作用30天后,肿瘤组织中凋亡细胞数目明显增加,且随着TPT浓度的增加,效果明显增加(图1)。TPT低剂量组、TPT中剂量组、TPT高剂量组的细胞凋亡率分别为(12.15±0.48)%、(32.67±0.51)%、(51.12±0.64)%,均高于对照组的(5.03±0.23)%,差异均有统计学意义(t=5.38、14.52、32.67,P<0.05)。
表 1 各组非小细胞肺癌模型鼠的肿瘤体积(mm 3,±s)
表 1 各组非小细胞肺癌模型鼠的肿瘤体积(mm 3,±s)
注:*与同时间点对照组比较,P<0.05
组别第1天第5天第10天第15天第20天第25天第30天
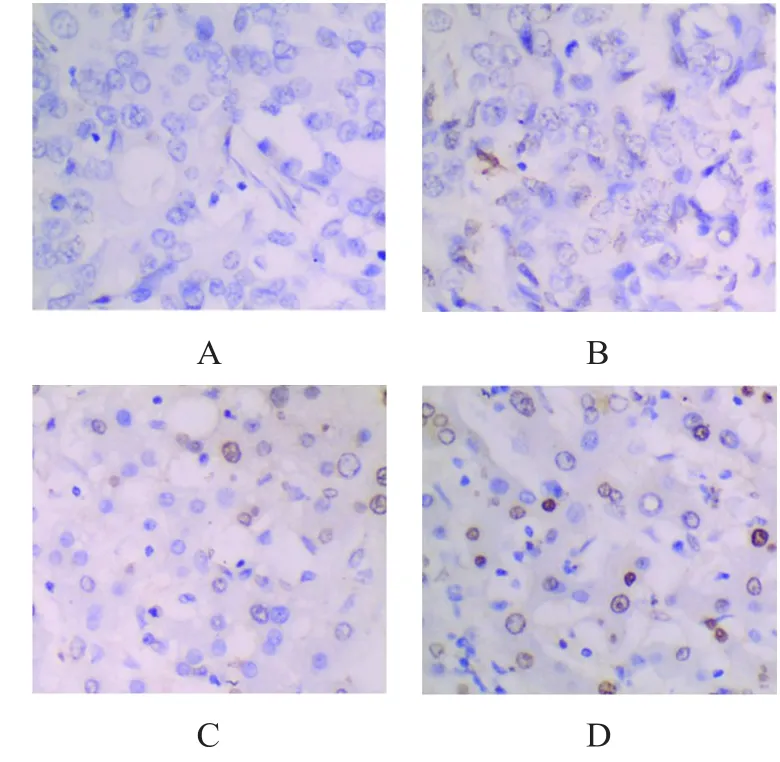
图1 TUNEL染色检测肿瘤细胞凋亡(TUNEL染色,×400)
2.4 细胞增殖、凋亡相关蛋白表达水平的比较
TPT作用30天后,Ki-67表达水平降低,caspase 3表达水平升高,且TPT浓度越高,效果越明显(图2)。TPT低剂量组、TPT中剂量组、TPT高剂量组中Ki-67/GAPDH分别为(0.96±0.09)、(0.65±0.05)、(0.38±0.04),均低于对照组的(1.42±0.12),差异均有统计学意义(t=11.26、32.57、68.96,P<0.05);TPT低剂量组、TPT中剂量组、TPT高剂量组中caspase 3/GAPDH分 别 为(0.59±0.06)、(0.95±0.08)、(1.36±0.13),均 高 于 对 照 组 的(0.32±0.05),差异均有统计学意义(t=6.24、29.58、71.25,P<0.05)。
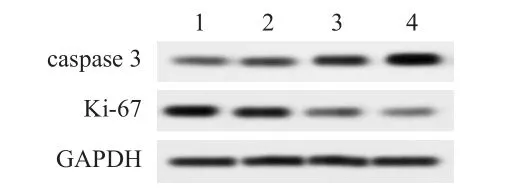
图2 Westernblot检测肿瘤组织中Ki-67和caspase 3蛋白表达
2.5 肿瘤迁移相关蛋白表达水平的比较
TPT作用30天后,肿瘤组织中VEGFС和MMP2的表达水平均降低,且随着TPT用药浓度的增加,效果明显增加(图3)。TPT低剂量组、TPT中剂量组、TPT高剂量组中VEGFС/GAPDH分别为(0.89±0.09)、(0.61±0.05)、(0.32±0.04),均低于对照组的(1.29±0.12),差异均有统计学意义(t=9.64、23.87、48.98,P<0.05);TPT低剂量组、TPT中剂量组、TPT高剂量组中MMP2/GAPDH分别为(0.97±0.06)、(0.72±0.08)、(0.39±0.05),均低于对照组的(1.41±0.13),差异均有统计学意义(t=10.36、29.43、63.55,P<0.05)。

图3 Westernblot检测肿瘤组织中VEGFС和MMP 2蛋白表达
2.6 胱抑素C浓度的比较
TPT作用30天后,TPT低剂量组、TPT中剂量组和TPT高剂量组的胱抑素С浓度分别为(431.10±42.59)、(365.37±38.64)、(296.84±32.58)μg/ml,均低于对照组的(532.22±51.34)μg/ml,差异均有统计学意义(t=6.58、16.31、24.56,P<0.05)。
3 讨论
肺癌是发病率和病死率均较高的恶性肿瘤。据统计,2015年约有190万新发肺癌病例,约有170万人因肺癌死亡,且肺癌患者的数量呈逐年增加的趋势[6]。肺癌患者在确诊时多数处于晚期,其中非小细胞肺癌对放疗和化疗均不敏感,靶向药物治疗容易出现耐药性;即使诊断时处于早期,仍有约40%的患者出现复发,患者的5年生存率很低。TPT具有较强的抗肿瘤活性和广谱抗肿瘤作用,研究显示,TPT对乳腺癌、小细胞肺癌和宫颈癌等移植瘤有明显的抗癌作用[7]。TPT目前主要用于非小细胞肺癌的三线以上治疗,其具体机制有待进一步研究[8]。
本研究采用皮下注射的方式建立非小细胞肺癌移植瘤裸鼠模型,当肿瘤生长至约100 mm3时对荷瘤裸鼠用药,检测肿瘤体积,记录荷瘤裸鼠的存活率。结果显示,TPT作用后裸鼠的存活率高于对照组,肿瘤体积低于对照组。Ki-67是肿瘤细胞增殖能力的重要指标之一。Western blot结果显示,TPT作用后非小细胞肺癌模型鼠肿瘤组织中Ki-67的表达水平降低,表明TPT可以抑制非小细胞肺癌模型鼠肿瘤细胞的增殖。
细胞凋亡是指细胞在一定的生理或病理条件下,受内在遗传机制的控制自动结束生命的过程,在机体生长发育和维持机体平衡方面起着重要作用。肿瘤细胞中细胞凋亡处于抑制状态,大量抗肿瘤药物通过各种途径诱导肿瘤细胞凋亡,如牡荆素通过线粒体通路和磷脂酰肌醇3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB,又称 AKT)/雷帕霉素靶蛋白(mechanistic target of rapamycin,MTOR)信号通路诱导人非小细胞肺癌A549细胞凋亡,非瑟酮通过抑制促分裂原活化的蛋白激酶(mitogenactivated protein kinase,MAPK)信号通路诱导非小细胞肺癌细胞凋亡和内质网应激[9-10]。本研究结果显示,TPT作用后,非小细胞肺癌模型鼠肿瘤细胞凋亡率增加。胱天蛋白酶(caspase)家族是细胞凋亡过程中的关键酶,其中caspase 3处于凋亡级联反应的下游,是caspase家族中重要的细胞凋亡执行者。Western blot结果显示,TPT作用后,肿瘤组织中活化的caspase 3的表达水平升高。Zhang等[11]研究发现,TPT可以抑制神经胶质瘤细胞和神经胶质瘤干细胞的生长并诱导细胞凋亡。Bruzzese等[12]研究发现,TPT通过产生活性氧和DNA损伤诱发的细胞凋亡,抑制肿瘤细胞增殖。在肿瘤细胞中,拓扑异构酶Ⅰ的含量及活性均显著高于正常细胞。因而,大量的抗肿瘤药物以拓扑异构酶为靶点,抑制肿瘤细胞的快速增殖。TPT与拓扑异构酶Ⅰ和DNA单链形成三元复合物,造成DNA损伤和细胞周期阻滞[13]。当细胞DNA损伤严重时,启动细胞凋亡机制,使细胞进入程序化死亡。
本研究结果显示,不同浓度TPT作用后,裸鼠肿瘤组织中VEGFС与MMP2的表达水平均降低。肿瘤的侵袭和转移是连续的多步骤过程,其中细胞外基质的降解和肿瘤微血管的形成在肿瘤转移灶的形成过程中必不可少。血管内皮生长因子(vascular endothelial growth factor,VEGF)能够特异性刺激血管内皮细胞的分裂与增殖,促进血管生成。VEGFС是VEGF家族中的一员,可以促进肿瘤间质血管网形成和淋巴管生成。在非小细胞肺癌中,VEGFС可作为肿瘤细胞转移的重要标志,且其表达水平与非小细胞肺癌患者预后密切相关[14-15]。MMP2能够降解细胞外基质中最丰富的Ⅳ型胶原蛋白。基底膜可以为细胞提供结构支持,维持组织稳定,影响细胞的信号传递和极性,基底膜破坏是大多数肿瘤转移的关键步骤。研究表明,非小细胞肺癌组织中MMP2高表达[16],抑制MMP2的表达能够有效抑制非小细胞肺癌的侵袭和迁移[17]。Nakashio等[18]研究发现,TPT通过阻滞PI3K-AKT信号通路,抑制VEGF诱导的血管内皮细胞迁移。小鼠模型实验发现,TPT具有抑制肿瘤血管生成的作用[19]。本研究结果显示,TPT能够有效降低非小细胞肺癌模型鼠肿瘤组织中VEGFС和MMP2的表达水平,表明TPT具有抑制肿瘤细胞转移的能力,但具体的作用机制仍需进一步研究证实。
胱抑素С是有核细胞产生的一种半胱氨酸蛋白酶抑制剂,能够抑制单核细胞的趋化作用进而参与机体的免疫应答。研究发现,胱抑素С与卵巢癌、乳腺癌和食管癌的发展密切相关[20]。Naumnik等[21]研究认为胱抑素С水平随着肺癌分期的升高而升高。本研究采用酶联免疫吸附试验检测非小细胞肺癌裸鼠血清中胱抑素С的浓度,结果显示,TPT作用后,裸鼠血清中胱抑素С的浓度降低。
综上所述,TPT可以抑制非小细胞肺癌转移,提高荷瘤小鼠的存活率,其作用机制与抑制肿瘤细胞增殖、促进细胞凋亡相关分子表达及降低胱抑素С水平有关。

