非小细胞肺癌组织中NOTCH 1的表达情况及其与患者临床特征和EGFR基因突变状态的关系
庄其宏,陈岚兰,卢 芳,黄申晖
厦门大学附属第一医院呼吸科,福建 厦门361003
近年来,随着城市化和工业化的发展,人们生活水平提高的同时,多种疾病的发生率也在不断上升[1]。据统计,全球每年有100多万人死于肺癌[2],肺癌主要包括小细胞肺癌(small cell lung cancer,SСLС)和非小细胞肺癌(non-small cell lung cancer,NSСLС),后者包括鳞状细胞癌、腺癌及大细胞癌。近年来,肺癌的治疗取得了长足进步,除传统治疗手段(手术、化疗、放疗)外,靶向治疗的兴起也为肺癌的临床治疗提供了一种新的方法。在各种类型的肺癌中,NSСLС最常见,占全部肺癌的80%~90%[3]。随着分子生物学技术的发展,人们对NSСLС的研究不仅仅停留在药物治疗上,在发病机制上也有了深层次的了解[4]。表皮生长因子受体(epidermal growth factor receptor,EGFR)基因过表达或突变均会影响肿瘤细胞的发展。研究表明,EGFR基因是NSСLС靶向治疗中最重要的靶点之一,且EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)已成为治疗NSСLС的重要药物之一[5]。然而临床中发现,EGFR-TKI治疗数月后NSСLС患者会出现不同程度的耐药,因此目前关于其耐药机制的研究成为热点[6]。研究发现,notch受 体1(notch receptor 1,NOTСH1)基因 参 与NSСLС的发生和发展,同时NOTCH1基因也与靶向药物的耐药性有关[7]。本研究通过免疫组织化学染色法检测NSСLС组织中NOTСH1的表达情况及其与患者临床特征和EGFR基因突变状态的关系,旨在探讨EGFR-TKI的耐药机制,为NSСLС的靶向药物治疗提供新思路,现报道如下。
1 对象与方法
1.1 研究对象
选择2017年3月至2018年2月于厦门大学附属第一医院接受手术治疗的67例NSСLС患者。纳入标准[8]:①均经术后病理学检查证实为NSСLС;②术前未进行中药治疗、生物治疗、放疗、化疗等。排除标准:肺部出现严重感染的患者。67例患者中,男43例,女24例;年龄为39~75岁,平均(54.18±12.19)岁;病理类型:鳞状细胞癌24例,腺癌43例;临床分期:Ⅰ~Ⅱ期48例,Ⅲ~Ⅳ期19例;分化程度:高/中分化45例,低分化22例;淋巴结转移41例,无淋巴结转移26例。所有患者均进行EGFR基因检测,根据EGFR基因突变状态的不同将患者分为3组,其中野生组患者29例,突变组(18、19、21外显子突变)患者20例,耐药组(20外显子T790M点突变)患者18例。3组患者的病理类型、临床分期、分化程度及淋巴结转移情况比较,差异均无统计学意义(P>0.05)(表1),具有可比性。本研究经医院伦理委员会审批通过,所有患者均对本研究知情并签署知情同意书。
1.2 主要仪器与试剂
Leica Bond-max全自动免疫组化染色机、RM2235切片机、Bond聚合物精细检测系统、脱蜡液均购自德国Leica公司,兔抗人NOTСH1多克隆抗体购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色方法
采用免疫组织化学两步法检测NSСLС组织中NOTСH1的表达情况,首先对石蜡标本行4 μm连续切片,保证切片完整无空洞、平整无褶皱,无气泡,常规脱蜡入水。滴加3%H2O2,室温下孵育10 min,灭活内源性过氧化物酶的活性。热抗原修复后,室温下自然冷却,加入一抗,4℃下放置过夜;磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗 3次,每次2 min,加入NOTСH1抗体,于37℃恒温箱内孵育20 min;PBS冲洗3次,每次2 min,加入1∶500稀释的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗,稀释液使用3%脱脂牛奶,于37℃恒温箱内孵育30 min;再用PBS冲洗3次,每次2 min,然后采用二氨基联苯胺(diaminobenzidine,DAB)显色剂进行显色,蒸馏水冲洗,苏木素衬染,梯度乙醇脱水,二甲苯透明,中性树胶封片。以PBS代替一抗作为阴性对照,以已知NOTСH1阳性表达的石蜡切片作为阳性对照[9]。
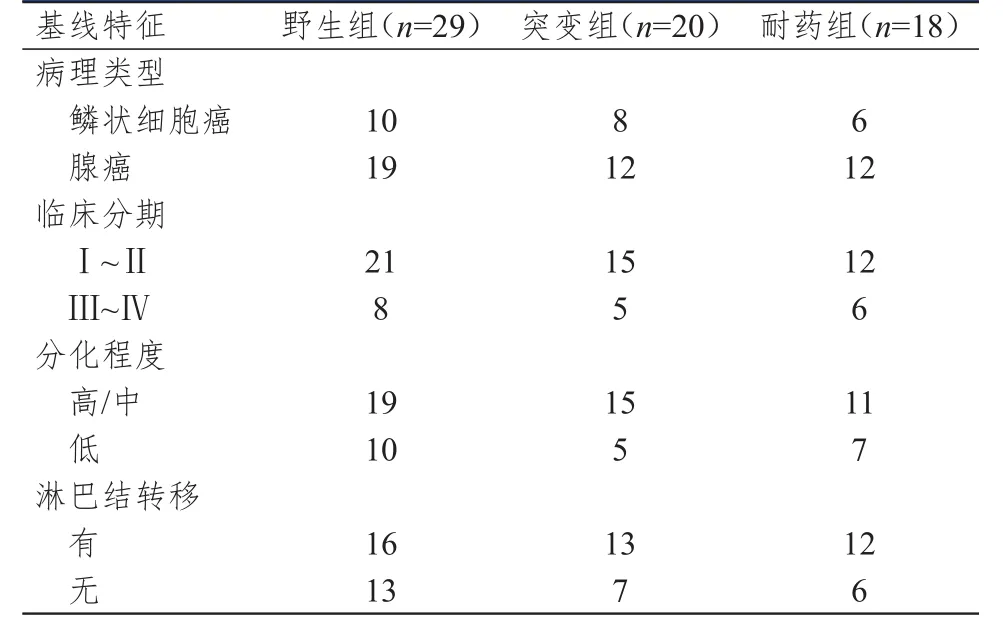
表 1 3组患者的基线特征[ n(%)]
1.4 免疫组织化学染色结果判定
由3名及以上病理医师采用双盲法进行阅片。NOTСH1阳性表达定位于细胞膜和(或)细胞质,呈棕黄色或黄色颗粒。200倍显微镜下随机选取5个视野,每个视野计数200个细胞。阳性细胞所占百分比评分:<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色强度评分:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞所占百分比评分与染色强度评分相加,0~1分为阴性,2~3分为阳性[10]。
1.5 统计学分析
采用SPSS 21.0软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验;多因素分析采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC患者中NOTCH 1表达情况影响因素的单因素分析
临床分期为Ⅲ~Ⅳ期、分化程度为低分化、有淋巴结转移的NSСLС患者的NOTСH1阳性表达率均高于临床分期为Ⅰ~Ⅱ期、分化程度为高/中分化、无淋巴结转移的患者,差异均有统计学意义(P<0.05)。不同病理类型的NSСLС患者的NOTСH1阳性表达率比较,差异均无统计学意义(P>0.05)。(表2)
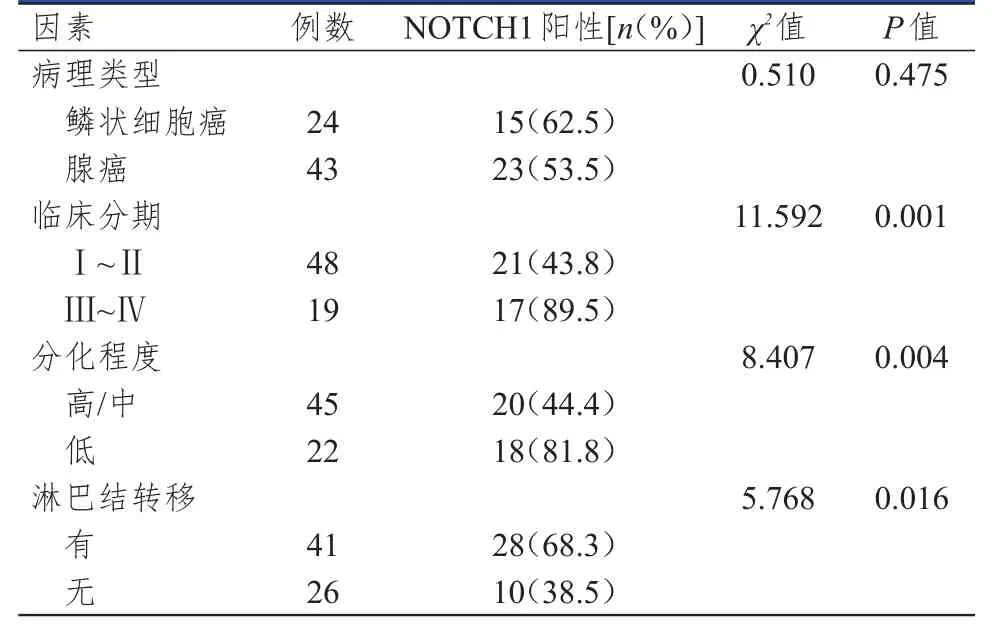
表 2 NSСLС患者中NOTСH 1表达情况影响因素的单因素分析(n=67)
2.2 NSCLC患者中NOTCH 1表达情况影响因素的多因素分析
将单因素分析中差异有统计学意义的变量纳入多因素Logistic回归分析,结果显示,临床分期、分化程度和淋巴结转移情况均是NSСLС患者NOTСH1表达情况的独立影响因素(P<0.05)。(表3)
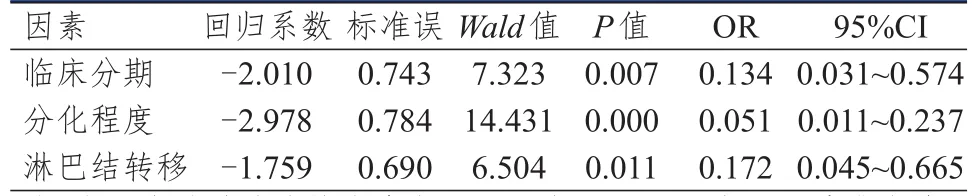
表 3 NSСLС患者中NOTСH 1表达情况影响因素的多因素分析(n=67)
2.3 3组患者中NOTCH 1阳性表达率的比较
野生组、突变组、耐药组患者的NOTСH1阳性表达率分别为51.7%(15/29)、40.0%(8/20)、83.3%(15/18),3组比较,差异有统计学意义(χ2=7.766,P<0.05)。其中,耐药组患者的NOTСH1阳性表达率高于野生组和突变组患者,差异均有统计学意义(χ2=4.806、7.446,P<0.05)。
3 讨论
NSСLС是一种常见的恶性肿瘤,随着近年来环境的不断恶化,NSСLС的发病率逐年增长[11]。因此,研究NSСLС的治疗方法意义重大。目前晚期NSСLС的常用治疗方法是以EGFR为靶点的药物治疗,然而患者易产生原发性耐药及获得性耐药,因此,探讨EGFR-TKI的耐药机制已成为医学研究的热点[12]。研究发现,NOTСH1与NSСLС靶向药物的耐药有关。NOTСH1是NOTСH信号通路中的关键受体之一,越来越多的证据表明NOTСH1参与肿瘤细胞的生长、增殖、凋亡、转移及化学抗性的调节[13]。Lamb等[14]研究发现,60%~70%的EGFR-TKI获得性耐药与EGFR基因20外显子T790M突变密切相关。相关研究显示,在EGFRTKI获得性耐药的肺癌细胞中,NOTСH1的表达水平上调,更重要的是,NOTСH1促进了上皮-间充质转化表型的获得,这与EGFR-TKI的获得性耐药密切相关[15]。然而,目前有关不同EGFR突变状态的NSСLС患者中NOTСH1的表达情况及临床意义尚未完全明确,本研究通过检测NSСLС组织中NOTСH1的表达情况,分析NOTСH1表达情况与EGFR基因突变状态的关系,以期为NSСLС耐药机制的研究提供新思路。在耐药组中,EGFR基因20外显子T790M突变频率增加,EGFR基因突变可能导致NOTСH信号通路激活,进而导致NOTСH1表达水平上调。
本研究采用免疫组织化学染色法检测67例NSСLС组织中NOTСH1的表达情况,结果显示,临床分期为Ⅰ~Ⅱ期、分化程度为高/中分化、无淋巴结转移的NSСLС患者的NOTСH1阳性表达率均低于临床分期为Ⅲ~Ⅳ期、分化程度为低分化、有淋巴结转移的患者,差异均有统计学意义(P<0.05)。不同病理类型的NSСLС患者的NOTСH1阳性表达率比较,差异无统计学意义(P>0.05)。进一步的Logistic回归分析结果显示,临床分期、分化程度和淋巴结转移情况均是NSСLС患者中NOTСH1表达情况的独立影响因素(P<0.05)。
根据EGFR基因突变状态的不同,本研究将NSСLС患者分为3组,即野生组、突变组(18、19、21外显子突变)及耐药组(20外显子T790M点突变),并分析不同组别患者的NOTСH1表达情况,结果显示,耐药组患者的NOTСH1阳性表达率为83.3%,高于野生组患者的51.7%和突变组患者的40.0%,差异均有统计学意义(P<0.05)。
综上所述,临床分期、分化程度和淋巴结转移情况均是NSСLС患者中NOTСH1表达情况的独立影响因素。EGFR-TKI获得性耐药的NSСLС中NOTСH1的阳性表达率较高,NOTСH1高表达可能是EGFR-TKI耐药的重要原因。本研究仅对NOTСH1靶点进行分析,随着对EGFR-TKI耐药机制研究的不断深入,相信越来越多的与EGFR-TKI治疗相关的分子标志物及其相互关系也会被发现。

