S1pr1沉默对弥漫大B细胞淋巴瘤OCI-LY1细胞增殖和迁移的影响
周颖 罗婷 袁韵 龚玉萍
弥漫性大B细胞淋巴瘤(DLBCL)是成人最常见的非霍奇金淋巴瘤(NHL),约占NHL的30%~40%[1]。目前,R-CHOP是DLBCL的标准治疗方案,治愈率可达到60%[2]。尽管R-CHOP的成功治疗效果有所改善,但复发和难治性疾病的患者仍是该疾病治疗的一大挑战。近年来,高通量技术揭示了DLBCL基因改变的更复杂特征,并发现了新的治疗途径。DLBCL靶向治疗的候选通路之一是STAT3通路[3]。STAT3在包括血淋巴样恶性肿瘤在内的许多癌症中被活化[4]。STAT3激活, 活化的STAT3(phospho-STAT3,p-STAT3)进入细胞核,导致细胞凋亡、增殖[5]。免疫组化检测到的STAT3或p-STAT3单独表达是所有DLBCL患者的不良预后因子[6]。S1pr1是鞘氨醇-1-磷酸(S1P)G蛋白偶联受体的成员,通过调控ERK、Akt和Rac通路分别引起细胞增殖和迁移等多种生物学效应[7]。最近有据报道显示,S1pr1也转录p-STAT3和增强S1pr1随后地激活STAT3,建立一个积极的反馈回路,包括S1pr1/p-STAT3途径,这对于小鼠和人实体瘤以及肿瘤相关骨髓细胞STAT3的持续激活至关重要[8]。霍奇金淋巴瘤(HL)和NHL在细胞系或组织中均有S1pr1的表达,提示S1pr1在这种情况下具有潜在的生物学作用[9]。然而,S1pr1在DLBCL患者中的预后研究鲜有报道。本研究通过沉默OCI-LY1细胞中S1pr1基因的表达,观察OCI-LY1细胞增殖和迁移情况,并初步探讨其可能的机制,为 DLBCL 的治疗提供一个新的思路。
1 材料与方法
1.1 实验材料、试剂及仪器 人DLBCL OCI-LY1细胞 (中国科学院典型培养物保藏中心昆明细胞库);S1pr1特异性siRNA和阴性对照(negative control,NC)(上海吉玛生物科技有限公司);DMEM 培养基、胰酶、胎牛血清(美国Gibco公司);细胞计数试剂盒8(CCK-8)(美国Amresco公司);人淋巴细胞分离液(上海博升生物科技有限公司);Trizol(美国Invitrogen公司)、PrimeScript RT reagent Kit Perfect Real Time RNA反转录试剂盒(大连TaKaRa公司)、UltraSYBR One Step RNA PCR Kit荧光定量PCR试剂盒(宝生物工程大连有限公司);PCR引物序列设计和合成(大连TaKaRa公司),引物编号:S1pr1(002215-PN4426784)、β-actin(001973-PN4427975);细胞蛋白抽提试剂(碧云天生物技术研究所);鼠抗S1pr1、STAT3、p-STAT3(美国Santa Cruz公司);鼠抗GADPH单克隆抗体和辣根过氧化物酶HRP标记山羊抗鼠IgG(北京中杉金桥生物技术有限公司);Westen blot试剂盒(上海碧云天生物科技有限公司);CO2培养箱(美国Ther-mo Revco);HBS-1096B 酶标仪(南京德铁实验设备有限公司);Transwell小室(CORNING科技有限公司,美国);基质胶、凝胶成像仪(美国UVP 公司);实时荧光定量PCR仪(BIO-RAD公司);BIO-RAD垂直电泳仪(美国BD公司);NanoDrop2000c 型蛋白核酸检测仪(美国Thermo公司)。
1.2 标本来源 收集我院确诊为DLBCL的患者10例,同时选择10例健康者外周血,利用淋巴细胞分离液提取外周血单个核细胞,加入1 ml Trizol,-80℃保存备用。本研究经我院伦理委员会批准,受试对象均签署知情同意书,严格按照《赫尔辛基宣言》执行。
1.3 细胞培养及转染 用含胎牛血清的DMEM培养液培养OCI-LY1细胞,隔天换液,当细胞处于对数生长期时进行实验。实验分为空白对照组、阴性对照组和S1pr1沉默组。空白对照组在铺板后72 h收获细胞,阴性对照组和S1pr1沉默组分别用Lipofectamine法将阴性对照(negative control,NC)和S1pr1特异性siRNA转染到OCI-LY1细胞,继续培养72 h后进行相关检测。
1.4 细胞增殖实验 按照1.3方法处理细胞,消化后以5×103/孔接种于96孔板中,200 μl/孔,继续培养72 h,向培养板中加入10 μl CCK-8试剂,继续培养,用酶标仪在630 nm处测定吸光度值,计算细胞增殖率,每组设3个平行孔。
1.5 细胞迁移能力实验 按照1.3方法处理细胞,继续培养72 h,用不含血清培养基的重悬,调整浓度为2×105后接种在24孔Transwell小室中,每孔100 μl,下室加入10%胎牛血清的DMEM培养液,弃上室培养基,用无菌棉签擦拭去除上室内的细胞,进行固定,用结晶紫染色30 min,冲洗干净后显微镜下观察细胞,拍照。计数紫色染色的穿膜细胞,即细胞迁移能力,每组设3个平行孔。
1.6 RT-PCR检测S1pr1 mRNA表达 取保存的外周血标本和按照1.3方法处理细胞,根据Trizol提取试剂盒操作说明书进行总RNA提取,反转录合成cDNA,制备20 μl反应体系进行扩增。PCR 扩增反应条件为 95℃ 30 s,93℃ 10 s,60℃ 3 s,40个循环,60℃时采集荧光,以β-actin作为内参,采用 2-ΔΔCt法计算S1pr1表达量。
1.7 Western Blot法检测S1pr1、STAT3和p-STAT3蛋白表达水平 按照1.3方法处理细胞,消化后5 000 r/min、5 min离心,洗涤2次,加入1 μl PMSF,根据细胞量加入胞蛋白抽提试液,冰浴2 h;4℃、10 000 r/min、15 min,取上清,进行蛋白定量;进行电泳、切胶;孵育一抗、孵育二抗,用凝胶成像系统采集图像并进行分析,计算目的蛋白与内参蛋白条带的灰度值比值。

2 结果
2.1 DLBCL患者及健康者外周血单个核细胞中S1pr1 mRNA的表达 DLBCL患者外周血单个核细胞中S1pr1 mRNA相对中位表达水平为13.02(0.54~31.28),高于健康者的0.74(0.07~5.67),差异有统计学意义(P<0.05)。见表1。
2.2 S1pr1沉默对OCI-LY1细胞S1pr1 mRNA和蛋白表达的影响 与空白对照组比较,阴性对照组OCI-LY1细胞中S1pr1 mRNA和蛋白表达变化不显著,差异无统计学意义(P>0.05);S1pr1沉默组OCI-LY1细胞中S1pr1 mRNA和蛋白表达较空白对照组和阴性对照组显著降低,差异有统计学意义(P<0.05)。见表2,图1。

表1 DLBCL患者及健康者外周血单个核细胞中S1pr1 mRNA的表达 n=10
注:与健康者比较,*P<0.05
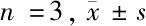
表2 S1pr1沉默对OCI-LY1细胞S1pr1 mRNA和蛋白表达的影响
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05
图1 S1pr1沉默对OCI-LY1细胞S1pr1蛋白表达的影响;A.空白对照组;B.阴性对照组;C.S1pr1沉默组
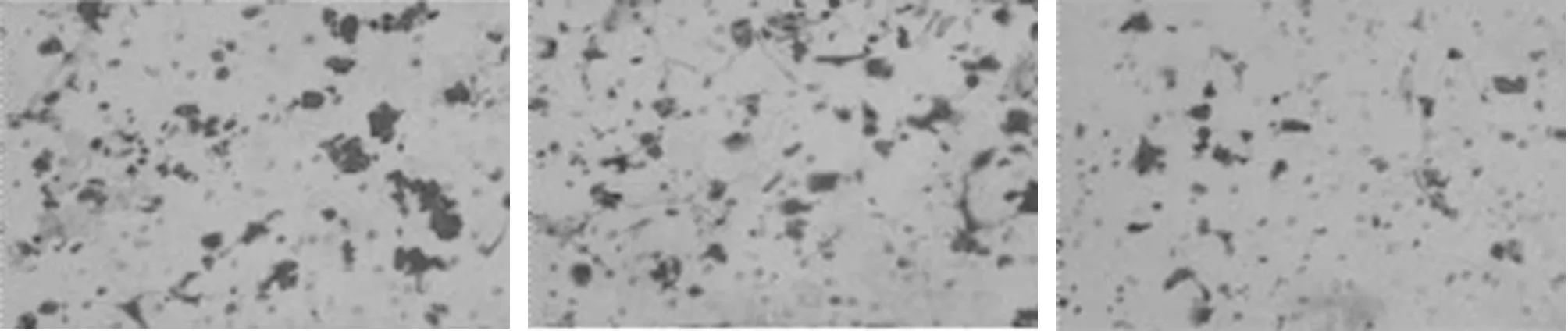
2.3 S1pr1沉默对OCI-LY1细胞增殖和迁移的影响 与空白对照组比较,阴性对照组OCI-LY1细胞增殖率和迁移细胞数变化不显著,差异无统计学意义(P>0.05);S1pr1沉默组OCI-LY1细胞增殖率和迁移细胞数较空白对照组和阴性对照组显著降低,差异有统计学意义(P<0.05)。见表3,图2。
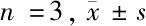
表3 S1pr1沉默对OCI-LY1细胞增殖和迁移的影响
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05

ABC
图2 S1pr1沉默对OCI-LY1细胞迁移的影响(×200);A.空白对照组;B.阴性对照组;C.S1pr1沉默组
2.4 S1pr1沉默对OCI-LY1细胞STAT3和p-STAT3蛋白表达的影响 与空白对照组比较,阴性对照组OCI-LY1细胞STAT3和p-STAT3蛋白表达变化不显著,差异无统计学意义(P>0.05);S1pr1沉默组OCI-LY1细胞STAT3和p-STAT3蛋白表达较空白对照组和阴性对照组显著降低,差异有统计学意义(P<0.05)。见表4,图3。
表4 S1pr1沉默对OCI-LY1细胞STAT3和p-STAT3蛋白表达的影响
注:与空白对照组比较,*P<0.05;与阴性对照组比较,#P<0.05


图3 S1pr1沉默对OCI-LY1细胞STAT3和p-STAT3蛋白表达的影响;A.空白对照组;B.阴性对照组;C.S1pr1沉默组
3 讨论
近十年来,基因干预已成为癌症生物学研究的热点分子,许多目标基因在肿瘤发生和肿瘤发展中发挥着重要作用。科学家们开始主张通过基因靶向干预,以此作为治疗各种恶性肿瘤的新靶点。STAT3在不同的肿瘤中被活化,但其在DLBCL中的作用尚不清楚。尽管STAT3是一个很有前景的癌症治疗靶点,但由于其细胞内定位和缺乏酶活性,有效抑制转录因子的活性仍然是一个挑战[10]。
最近,一种G蛋白偶联受体S1pr1被发现对某些小鼠肿瘤和人类肿瘤细胞中STAT3的持续激活非常重要。S1pr1可与JAK2发生物理作用,导致STAT3磷酸化增加,p-STAT3可在转录水平上调S1pr1的表达,形成前馈循环[11]。STAT3的活化也受白细胞介素6(IL-6)等因素的影响,进一步导致S1pr1过表达[12]。与STAT3相比,S1pr1具有更有利的细胞定位和酶标靶能力。然而,S1pr1在癌症生物学中的重要性才刚刚开始被认识,其作为人类癌症治疗靶点的潜在重要性还有待进一步评估。在本研究中,我们关注的是S1pr1在DLBCL中的表达和功能。
S1pr1对T淋巴细胞和B淋巴细胞保留在次生淋巴器官中起着至关重要的作用。S1pr1在内皮细胞中也有高表达,这些细胞中S1pr1的表达对肿瘤血管生成和转移具有重要意义[13]。另一方面,阻断S1pr1可使淋巴瘤细胞保留在淋巴器官中,这是由于S1pr1存在功能缺陷,这可能会限制淋巴瘤细胞的侵袭潜能[14]。S1pr1信号可以被一种有效的抑制剂FTY720阻断,FTY720是一种免疫抑制剂,目前正被用于治疗多发性硬化症[15]。除了靶向该通路的药物FTY720外,S1P配体抗体也被证明可以有效抑制多种小鼠模型的原发性肿瘤生长,近期已进入其他适应症的临床试验[16]。由于已知S1P/S1pr1信号通路与多个重要通路相关,包括T细胞中的mTOR通路和非淋巴细胞中的Akt通路,因此,S1pr1通过STAT3信号通路以外的机制在DLBCLs生物学中的可能作用尚待阐明[17]。另一种可能是使用一种新的体内siRNA干扰技术,利用S1pr1 siRNA不仅可以靶向抑制肿瘤细胞中的S1pr1/STAT3信号,还可以通过激活肿瘤相关的树突状细胞、巨噬细胞和B细胞,同时增强抗肿瘤免疫应答[18]。将STAT3与S1pr1共定位于ABC DLBCL组织的肿瘤细胞中,通过S1pr1 siRNA抑制S1pr1成功抑制了STAT3的活性和肿瘤细胞的生长。在目前DLBCL患者的临床的研究中发现,S1P/S1pr1通路的激活导致DLBCL病情的恶化,因此,除了STAT3,S1P被认为是一个有前途的目的蛋白[19]。有趣的是,最近的一项研究显示,S1pr1/STAT3信号通路是慢性肠道炎性和结肠炎相关癌症之间的重要联系。考虑到S1pr1/STAT3通路在炎性反应和炎性相关癌变中的重要作用,提示S1pr1/STAT3通路可能参与炎性易发区域的淋巴生成[20]。本研究结果显示,通过沉默S1pr1基因,降低了STAT3和p-STAT3的水平,同时导致OCI-LY1细胞增殖和迁移能力被抑制。
综上所述,沉默OCI-LY3细胞S1pr1基因可调节STAT3的活性水平,抑制OCI-LY3细胞增殖能力,降低OCI-LY3细胞的迁移能力,为DLBCL的治疗提供了一个新的靶标。然而,我们还需要进一步阐明S1pr1功能在DLBCL治疗中的具体机制,以验证我们的发现。

