温敏凝胶增强地塞米松纳米粒跨角膜屏障渗透性的研究
夏红雷,刘立中,,鲍玲红,李繁,郑康钰,莫镇杰,刘青,陈佛华,谢清春,班俊峰,吕竹芬
(1.宁波市镇海区人民医院药剂科,浙江 宁波 315202; 2.广东药科大学广东省药物新剂型重点实验室,广东 广州 510006)
角膜房水屏障(corneal aqueous barrier,CAB)是阻碍药物向眼内递送的重要生理屏障。Musaed等[1]研究阿昔洛韦混悬液与PLGA纳米粒对角膜渗透性的作用发现后者的角膜透过量是前者的1.43倍;Roberto等[2]也证明氟米龙PLGA纳米粒的角膜渗透量是市售制剂Isopotoflucon®的2.27倍;MO等[3]制备了基于脂质纳米粒的凝胶滴眼液,与市售TobraDex®对比,所制备滴眼液的角膜透过量是市售制剂的2.56倍,由此可见,纳米药物递送系统能显著增加滴眼给药后药物角膜透过量,但针对滴眼给药后纳米粒药物渗透性的研究国内鲜有报道。
目前,评价药物跨角膜渗透性的方法主要有以离体家兔角膜为屏障模型考察PLGA纳米粒渗透特性[4],以细胞屏障模型研究重组蛋白滴眼液穿透眼球屏障能力[6]及以角膜穿刺术研究在体测定凝胶药物渗透性[5]等方法,其中,在体实时检测药物浓度的方法可为评价递送系统跨角膜渗透能力提供最可靠的信息。本文采用离体角膜及在体房水微透析方法,比较地塞米松纳米粒温敏凝胶、地塞米松纳米粒和市售制剂(TobraDex®)的离体角膜渗透性及跨角膜进入房水中的渗透量,为进一步研究地塞米松跨CAB向眼内递药及开发地塞米松眼用凝胶提供实验基础与技术参考。
1 仪器与材料
1.1 药品与试剂
1.2 仪器
Delsa Nano C粒度/ζ电位分析仪(美国Beckman Coulter公司);DSC 4000差示量热扫描仪(美国PerkinElmer公司);Spectrum100红外光谱仪(美国PerkinElmer公司);BS224S及CP225D电子分析天平(德国Sartorius公司);NS 1001L高压均质机(意大利NiroSoavi公司);RE 52-05旋转蒸发器(上海亚荣生化仪器厂);Ultimate 3000高效液相色谱仪(美国Dionex公司);TK-12B透皮扩散试验仪(上海锴凯科技贸易有限公司);mini G小型离心机(德国IKA公司);ESP-32微透析注射泵(日本Eicom公司);EFC-96微透析自动采样系统(日本Eicom公司);JY88IIN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.3 动物
体质量1.8~2.2 kg日龄80~90 d健康的新西兰兔,由广东省医学动物实验中心三水基地提供,标准动物实验证号:NO.44411600004435,SCXK(粤)证号:2014-0035。
2 方法与结果
2.1 HPLC法测定地塞米松的质量分数
2.1.1 色谱条件 Ultimate®XB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水(体积比40∶60);检测波长:240 nm;流速:1.0 mL/min;进样量:20 μL(微透析样品进样5 μL)。
2.1.2 对照品溶液的制备 精密称取地塞米松约10.05 mg,置于100 mL量瓶中,适量甲醇超声溶解后,用甲醇稀释并定容,得质量浓度0.100 5 mg/mL对照品储备液。
2.1.3 供试品溶液的制备 分别精密称取纳米粒温敏凝胶1.00 g,置于10 mL量瓶,适量甲醇溶解,超声 5 min 后,放至室温,甲醇定容,转移至离心管,10 000 r/min离心5 min,取上清液经0.22 μm滤膜滤过,即得供试品溶液;其他供试品相同操作。
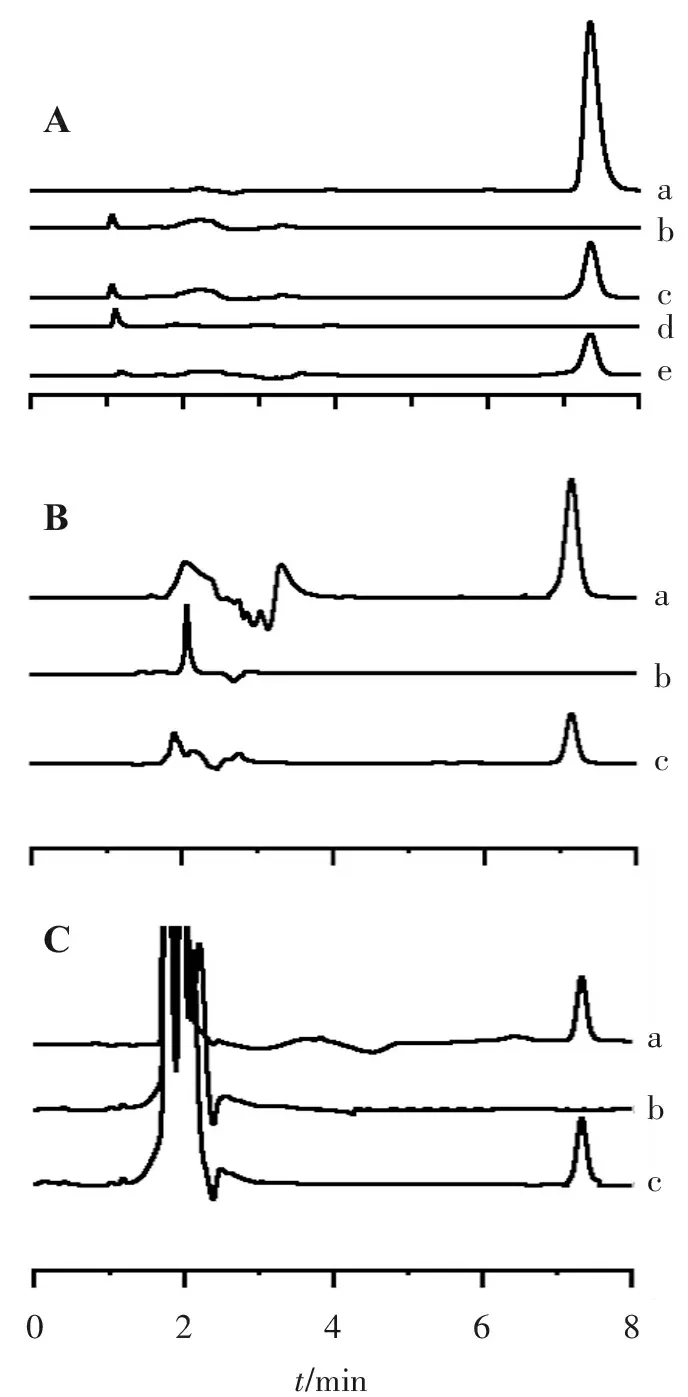
2.1.4 专属性考察 分别取地塞米松对照品、空白纳米粒供试品、纳米粒供试品、空白温敏凝胶供试品、温敏凝胶供试品、空白角膜渗透液、角膜渗透样品、体内空白透析液、体内透析液样品,按上述色谱条件进样,色谱图见图1,结果表明分析方法具有良好的专属性。
abcdeabcabc02468t/minACB
A-a.地塞米松对照品; A-b.空白纳米粒供试品; A-c.纳米粒供试品; A-d.空白温敏凝胶供试品; A-e.温敏凝胶供试品; B-a.地塞米松对照品; B-b.空白角膜渗透液; B-c.角膜渗透样品; C-a.地塞米松对照品; C-b.体内空白透析液; C-c.体内透析液样品。
图1不同样品中地塞米松的HPLC色谱图
Figure1HPLC chromatograms of Dexamethasone in different samples
2.1.5 线性关系的考察 取对照品储备溶液适量,分别用甲醇定量稀释成质量浓度为1.005~100.5 μg/mL的系列溶液,供温敏凝胶中药物质量分数测定使用;用人工房水稀释成质量浓度为0.1005~10.05 μg/mL的系列溶液,供离体角膜渗透性检测使用;用空白灌流液定量稀释成质量浓度为0.0502~10.05 μg/mL的系列溶液,供在体房水药物浓度检测使用;分别以药物峰面积(A,mAU)对药物质量浓度(ρ,μg/mL)进行线性回归,得回归方程:A=0.767 4ρ+ 0.066 8(R2=0.999 9),A= 0.768 8ρ+ 0.066 2(R2=0.999 8),A= 63.357ρ+ 2.9(R2=0.999 6),表明线性关系良好。
在进行产品测试时测试软件主要完成测试环境确认,测试资源的检查和复位;产品供电及工作时序的控制;产品输出信息的接收、存储和实时显示;产品测试项目的检测和判读。测试仪对产品参数进行动态检测的过程中,能够实时显示系统测试状态、测试数据和测试曲线,并直观显示测试的最终结果。
2.1.6 精密度试验 分别取“2.1.5”项下3种溶剂的10.05、5.025、1.005 μg/mL 对照品溶液,同日内重复测定6次考察日内精密度;连续测定3 d考察日间精密度。结果表明日内与日间RSD值均小于2%,符合测定要求。
2.1.7 稳定性试验 取离体角膜渗透与眼内微透析样品,分别在0、2、4、8、16、24 h按“2.1.1”项色谱条件进样测定质量分数并计算RSD值,结果RSD值分别为2.23%和3.51%,表明样品在24 h内稳定性良好。
2.1.8 回收率试验 取“2.1.5”项下对照品储备溶液适量,分别用甲醇、人工房水和空白灌流液定量稀释成高、中、低(10.05、5.025、1.005 μg/mL)3种质量浓度,HPLC进样测定,计算回收率。结果显示3种质量浓度的回收率分别在100.18%~104.10%、95.77%~100.48%和93.67%~102.01%之间,符合样品分析测定的要求。
2.2 地塞米松纳米粒温敏凝胶的制备
地塞米松纳米粒(DEX-NPS)的制备:参照文献[7]方法,取处方量的普郎尼克F68、丙三醇与处方量的去离子水,混合溶解,即得水相;另将处方量的大豆卵磷脂、地塞米松,溶于适量无水乙醇中,60 ℃减压旋蒸挥去乙醇,再加入处方量的注射用大豆油,即得油相;保持水相和油相温度在65 ℃,将油相加至水相中,6 000 r/min高速分散10 min即得初乳,调节高压均质二级阀压力约20 000 kPa,一级阀调至60 000 kPa,高压均质10 min,即得地塞米松质量浓度为1 mg/mL的DEX-NPS纳米粒。
地塞米松纳米粒温敏凝胶的制备:采用冷凝法[8],取DEX-NPS纳米粒用去离子水适当稀释,加入处方量的凝胶材料,搅拌润湿后充分溶胀,pH值调至6.5~7.8,4 ℃冷藏,得到均一、澄清透明的无团块溶液,即纳米粒温敏凝胶(地塞米松质量浓度为0.5 mg/mL,在29~34 ℃之间具有温度响应性)。
2.3 地塞米松纳米粒温敏凝胶的评价
采用激光粒度仪、透射电镜对纳米粒温敏凝胶粒径、电位及形貌进行分析,结果见图2。可见,纳米粒温敏凝胶中位粒径为(184.03±1.60)nm,PDI为0.178±0.03,Zeta电位为-(38.52±1.50)mV;地塞米松纳米粒中位粒径为(173.57±2.95)nm,PDI为0.187±0.06,Zeta电位为-(35.88±0.62)mV;两者相比,差异并不显著,但纳米粒温敏凝胶D90较大,体系均一性相对于纳米粒较差一些。在透射电镜下,两者颗粒大小基本在200 nm内,呈类球形,颗粒均一并且之间基本无黏连,与激光粒径仪测得的粒径大小相近。
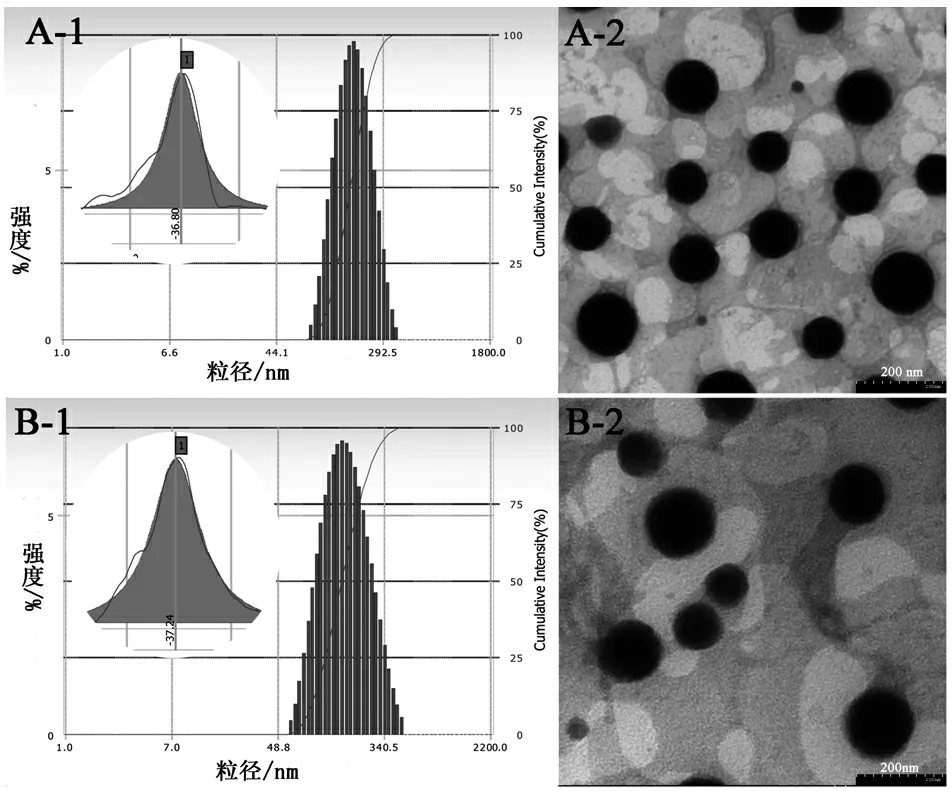
图2地塞米松纳米粒(A)与纳米粒温敏凝胶(B)的粒径、电位及TEM形貌图
Figure2Particle size distributions,Zeta potential distribution and TEM micrographs of Dexamethasone nanoparticles (A) and temperature-sensitive gel (B)
2.4 离体角膜渗透性的评价
参考文献[8]方法对离体角膜进行预处理,将处理后的离体角膜置于接受池与供给池之间,以人工泪液(STF)作为接受介质,供给池内加入等量的不同制剂。将扩散池置于(34±0.5)℃的恒温扩散仪中,分别于不同时间点从接受池中取样2 mL,同时补加等体积同温度的接受介质,样品采用HPLC法进样测定,按公式(1)计算累积透过量(Qn)。
(1)
式中:V0为接受池中介质的体积5 mL;Cn为t时间时的药物浓度(μg/mL);Ci为前一个t时间点的药物浓度(μg/mL);V为取样体积2 mL。
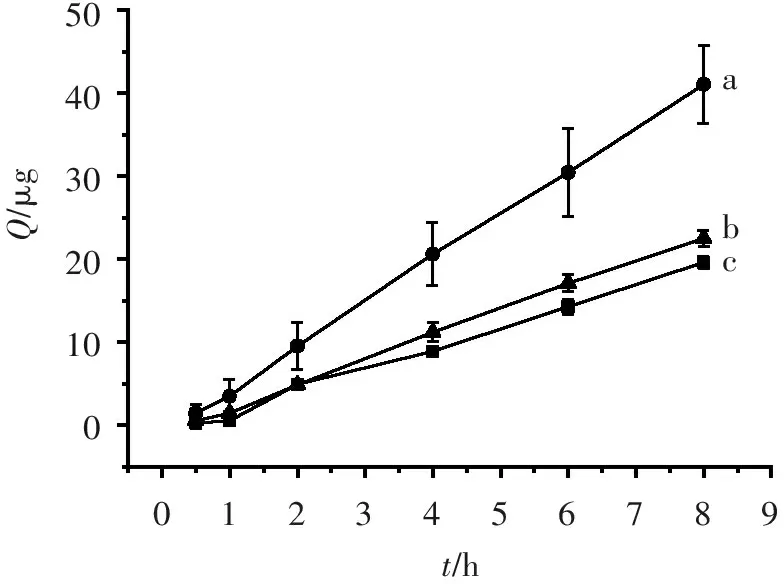
药物的累积渗透量与时间的曲线结果见图3。可见,地塞米松纳米粒温敏凝胶和地塞米松纳米粒的8 h累积渗透量分别是市售制剂(TobraDex®)的1.15和2.09倍,差异均有统计学意义(P<0.05),表明地塞米松纳米粒具较强的渗透性,而温敏凝胶延缓了纳米粒的渗透。
bca50403020100Q/μg0123456789t/h
a.纳米粒; b.纳米粒温敏凝胶; c.市售TobraDex。
图3离体角膜累积透过量
Figure3The result of corneal cumulative permeabilityinvitro(n=6)
2.5 房水渗透性的评价
2.5.1 体外回收率测定 参考文献[9]采用正透析法(式2,RR)和反透析法(式3,RL)测定体外回收率,浴槽温度(34±1)℃,转速200 r/min。正透析法中,微透析探针外液为地塞米松生理盐水(DEX-NS);反透析法中,微透析探针内液为DEX-NS,分别考察含不同组分的透析溶液[牛血清白蛋白(BSA)、羟丙基β环糊精(HP-β-CD)、或异丙醇(IPA)]、灌流液速度(0.2、0.5、0.8、1、2、3 μL/min)和药物浓度(1、5、10 μg/mL)等因素对探针回收率的影响。
(2)
(3)
式中:RR为正透析回收率,RL为反透析回收率,Cperfusion、Cdialysis、Csolution分别为灌流液、透析液和外置溶液中地塞米松的质量浓度(μg/mL)。
2.5.1.1 透析液成分对回收率的影响 从图4可见,3种成分透析回收率大小依次为NSBSA-NS>IPA-NS>HP-NS,其中,BSA-NS组和HP-NS组随质量浓度增加,RR和RL均降低;IPA-NS组随着IPA浓度增加,RR和RL回收率略为增加,而NS组的RR和RL基本无差异。因此,选择NS为透析液较为合适。
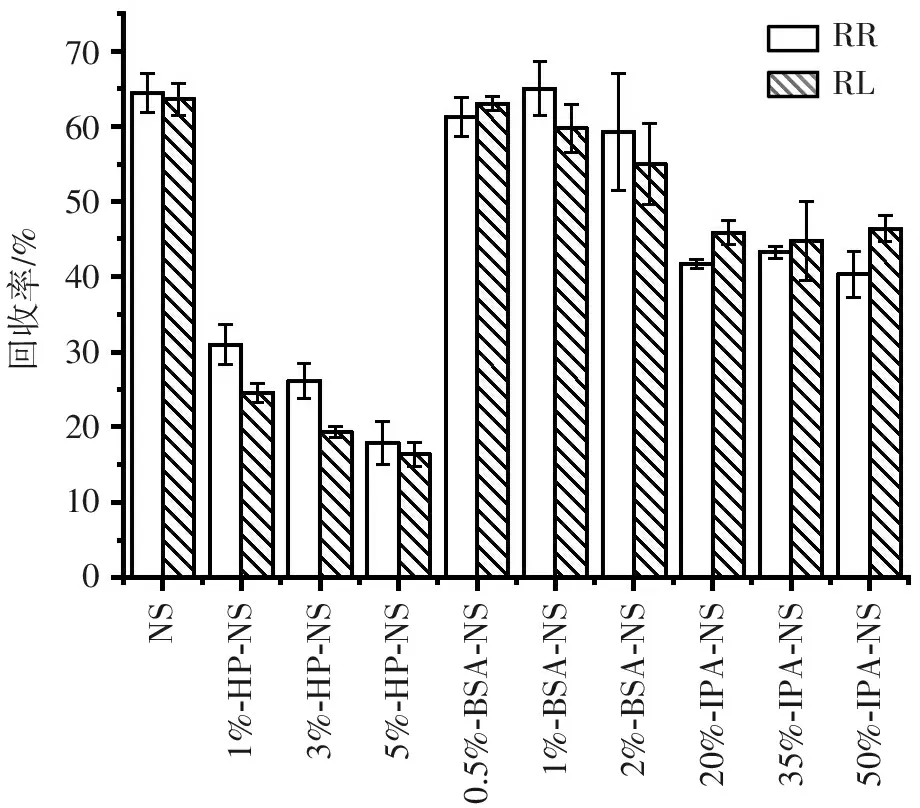
NS1%-HP-NS3%-HP-NS5%-HP-NS0.5%-BSA-NS1%-BSA-NS2%-BSA-NS20%-IPA-NS35%-IPA-NS50%-IPA-NS回收率/%706050403020100RRRL
图4灌流液成分对探针回收率的影响
2.5.1.2 灌流液流速对回收率的影响 从图5可见,回收率均随流速的增加而逐渐降低;在各流速下,RR与RL的值近乎一致,符合进行体内回收率试验的条件。综合取样时间,为保证体内回收率在50%以上,选择流速应不大于0.5 μL/min进行灌注。
100806040200回收率/%RRRL0.00.51.01.52.02.53.0流速/(μL?min-1)
图5灌流液流速对回收率的影响
2.5.1.3 药物质量浓度对回收率的影响 以流速为0.5 μL/min进行灌注,考察不同药物质量浓度对回收率的影响,结果见图6。可见, RR与RL基本不随浓度变化而变化,范围在60%~68%之间。
100806040200回收率/%RRRL0246810ρ/(μg?mL-1)
图6灌流液中药物质量浓度对回收率的影响
2.5.2 体内回收率的测定 微透析探针植入后,约2 h待前房房水恢复,以零净通量法,分别以0.25、0.5、1、2、5、10、20 μg/mL地塞米松溶液进行灌注,流速设定为0.5 μL/min更换灌注液后至少平衡1 h后再取样。每一样品收集15 μL,HPLC法测定透析液中药物浓度,按下式计算回收率,地塞米松体内回收率Rin-vivo为(62.06±2.23)%。
(4)
式中:Cdialysis、Cperfusion、Cm分别为透析液、灌流液和组织中的药物质量浓度(μg/mL)。
2.5.3 房水渗透性试验
2.5.3.1 动物处置 为预防创伤性手术后的炎症反应,实验前2 d给予家兔滴眼(盐酸左氧氟沙星滴眼液,每天3次,每次2滴)。试验时将兔子固定于兔笼内,耳缘静脉注射20%乌拉坦(5 mL/kg)溶液进行麻醉,将线性微透析探针的渗析窗植入至眼前房室中。
2.5.3.2 房水中药物质量浓度的测定 将灌流液换成NS,并分别在兔眼滴加地塞米松纳米粒温敏凝胶、地塞米松纳米粒和市售TobraDex各0.15 mL,其他步骤相同,根据公式(5)计算房水中地塞米松的浓度;式中,Caqueous为房水中药物的质量浓度(μg/mL)。
(5)
2.5.3.3 药动学参数 绘制房水内药物浓度-时间曲线,采用DAS3.0软件计算药动学参数,结果见图7及表1。可见,纳米粒温敏凝胶可有效提高地塞米松的角膜渗透性,有效提高房水中药物浓度,纳米粒温敏凝胶的Cmax、AUC0→8、MRT、T1/2和Tmax与纳米粒和市售制剂组相比,差异均具有统计学意义(P<0.05),纳米粒温敏凝胶和纳米粒的Cmax分别是市售制剂的2.89和0.69倍,AUC0→8分别是3.01和0.98倍,表明纳米粒温敏凝胶可显著提高地塞米松在眼部的生物利用度。
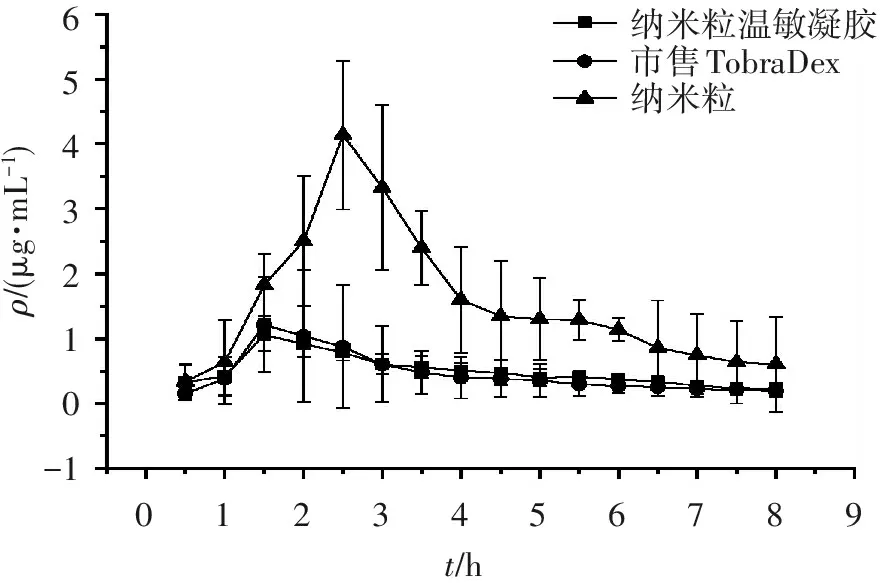
ρ/(μg?mL-1)6543210-10123456789t/h纳米粒温敏凝胶市售TobraDex纳米粒
图7房水中的药物浓度-时间曲线
Figure7Drug concentration-time curves in aqueous humor (n=6)
表1 地塞米松在房水中的药动学参数Table 1 Pharmacokinetic parameters of dexamethasone in aqueous humor
与纳米粒比较:*P< 0.05;与市售TobraDex制剂比较:#P< 0.05。
3 讨论
角膜房水屏障由上皮细胞、前弹力层、基质层和感觉神经等结构共同构成,在保护眼内免受外界化学物质伤害的同时,也将药物等隔离在眼球之外,成为限制药物向眼内递送的第一道防线。本研究为证实纳米粒载入温敏型凝胶后药物跨角膜屏障的能力,应用线性微透析探针实时取样技术,通过建立离体角膜及实时在体房水微透析技术对不同制剂渗透性进行评价,并采用DAS 3.0分析房水内地塞米松药动学参数。结果表明,纳米粒可有效提高药物的渗透性,温敏凝胶可以延长纳米粒在角膜的滞留时间,温敏凝胶与纳米粒两者结合既增加了角膜渗透性,又减缓因泪液冲刷导致的纳米粒流失,为有效提高药物眼部生物利用度跨角膜屏障提供可能。本研究采用在体微透析技术与HPLC检测技术联合,可降低不同动物样本间的个体差异,且与高灵敏度的分析检测技术结合,达到了连续监测动态变化的目的。但实验中对地塞米松如何透过角膜到达房水,目前的研究还不能阐述清楚,有待进一步研究。

