叶酸代谢通路常见基因多态位点及其检测方法
何震宇
(广东药科大学生物化学与分子生物学系,广东 广州 510006)
叶酸是一种人体必需的B族维生素,它在人体中经过两步还原反应转变为四氢叶酸(FH4)。FH4能够携带一碳单位参与(脱氧)核苷酸的合成,从而间接参与核酸的合成。FH4可以转变为N5,N10-亚甲四氢叶酸,N5,N10-亚甲四氢叶酸能被5,10-亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)进一步转变为N5-甲基四氢叶酸(N5-CH3-FH4)。N5-CH3-FH4在甲硫氨酸合成酶的催化下提供甲基使同型半胱氨酸(Homocysteine,Hcy)转变成甲硫氨酸,同时释放出游离的FH4,这步反应具有如下意义:(1)降低血液中同型半胱氨酸水平,而同型半胱氨酸为动脉粥样硬化和冠心病发生的独立危险因素;(2)促进FH4的再生;(3)甲硫氨酸可进一步转变为S-腺苷甲硫氨酸(SAM),SAM为体内重要的甲基供体,很多重要的生理活性物质比如肾上腺素、肉碱、胆碱及肌酸等的合成需要它提供甲基,DNA、蛋白质等的甲基化也有赖于它[1]。甲硫氨酸合成酶发挥活性需要辅助因子维生素B12,但维生素B12容易氧化失活从而导致甲硫氨酸合成酶失活。甲硫氨酸合成酶还原酶(methionine synthase reductase,MSR)又叫5-甲基四氢叶酸-同型半胱氨酸甲基转移酶还原酶(5-methyltetrahydrofolate-homocysteine methyltransferase reductase,MTRR),它能使氧化型维生素B12发生甲基化还原生成有活性的维生素B12从而恢复甲硫氨酸合成酶的活性[2]。综上所述,不难看出,叶酸代谢通路对维持人体健康至关重要,该代谢通路的关键酶MTHFR、MTRR如果存在遗传缺陷的话,势必会不同程度地影响人体健康。目前,对人体健康影响最大、受关注度最高的基因多态位点为MTHFR基因C677T、A1298C位点及MTRR基因A66G位点。
1 叶酸代谢常见基因多态位点及临床意义
1.1 MTHFR基因C677T位点和A1298C位点
5,10-亚甲基四氢叶酸还原酶的编码基因MTHFR基因定位于1p36.3[3],包含11个外显子[4]。MTHFR基因错义突变是引起酶活性缺乏和降低的主要机制,最常见的一个多态位点是C677T,它会导致多肽链相应的丙氨酸(Ala)被缬氨酸(Val)取代,从而降低MTHFR的热稳定性和活性,在46 ℃加热5 min的情况下,CC、CT、TT基因型样品残余的酶活性分别为67%、56%、22%;正常情况下,TT型样品的活性约为CC型样品的50%[5-6]。另一个常见的多态位点是A1298C,它由Viel A等[7]最先发现,该突变可导致多肽链中相应的谷氨酸(Glu)被丙氨酸(Ala)取代,使用淋巴细胞提取液测定酶活性时发现,CC型突变纯合子的酶活性大约只有正常野生型纯合子酶活性的60%,A1298C和C677T双杂合子的酶活性为野生型的50%~60%[8];使用体外表达的酶进行研究表明,相较于野生型酶,1298C单位点突变、677T单位点突变、1298C和677T双位点突变酶的活性分别为68%、45%、41%[9]。
1.2 MTRR基因A66G位点
甲硫氨酸合成酶还原酶的编码基因MTRR基因定位于5p15.2-15.3[10],大约34 kb,包含15个外显子[11]。
MTRR基因最常见的一个多态位点是A66G,它会导致多肽链第22位的异亮氨酸被甲硫氨酸取代(I22M),体外研究表明,要想使甲硫氨酸合成酶达到最大反应速度,M22变异体相对于I22野生型酶而言,反应体系中使用甲硫氨酸合成酶还原酶与甲硫氨酸合成酶的比率要高3~4倍[2],意味着该位点对甲硫氨酸合成酶还原酶的活性影响非常之大。
显然,上述3个位点都会对其相应的酶活性造成较大影响,从而引起血浆同型半胱氨酸水平上升、一碳单位代谢障碍,与唐氏综合征[12-13]、唇腭裂[14-15]、神经管缺陷[16-17]、心脑血管疾病[18-22]、自闭症[23]、精神分裂症[24]、肿瘤[25-26]、反复自然性流产[27]、男性不育[28]等多种疾病的发病风险增加相关。
中国人群C677T、A1298C和A66G多态位点基因型和等位基因频率存在显著的地理和种族差异[29],见表1。因此,加强这3个位点的基因分型研究,对临床疾病诊断及风险性预测具有重要意义。
2 针对叶酸代谢通路常见多态位点的检测方法
2.1 聚合酶链反应-限制性片段长度多态性分析(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)
该法先用PCR扩增包含多态位点的DNA片段,然后用相应的限制性核酸内切酶消化PCR产物,酶切产物再通过电泳予以分离,根据电泳图谱中酶切片段的数目和大小判断基因型。 其中MTHFR基因C677T位点关联碱基序列GAGYC(Y=C或T),突变型等位基因T的相应序列GAGTC能够被限制性核酸内切酶HinfⅠ识别,反之,野生型等位基因C的相应序列GAGCC不能被HinfⅠ识别,从而可用HinfⅠ甄别该位点;MTHFR基因A1298C位点关联碱基序列GAAGM(M=A或C),野生型等位基因A的相应序列GAAGA能够被限制性核酸内切酶MboⅡ识别,反之,突变型等位基因C的相应序列GAAGC不能被MboⅡ识别,从而可用MboⅡ鉴定该位点;MTRR基因A66G位点关联碱基序列AATRTG(R=A或G),本来没有合适的限制性核酸内切酶甄别该序列,但通过错配引物PCR将其变为CATRTG后,野生等位基因A的相应序列为CATATG,能被限制性核酸内切酶NdeⅠ识别,反之,突变型等位基因G的相应序列为CATGTG,不能被限制性核酸内切酶NdeⅠ识别,从而可以用NdeⅠ来鉴定该位点,这个位点采用了所谓的引物介导的限制性分析 PCR (PCR-primer introduced restriction analysis,PCR-PIRA)。Nasri等[30]在研究MTHFR基因C677T位点、A1298C位点及MTRR基因A66G 位点与神经管缺陷的关系时,基因分型采用的正是PCR-RFLP法。尽管PCR-RFLP法是一种经典的基因分型方法,操作简单,对仪器设备要求低,但由于涉及酶切反应,酶切不完全容易导致基因型误判,不过在PCR产物中引入内对照酶切位点可以克服这一缺点[31]。此外,目前针对3个位点的检测需要使用3种不同的内切酶,难以在同一反应体系进行3个位点的酶切反应,若能实现3个位点的同管酶切检测,必将大幅提高检测效率。
表1 中国不同地区叶酸代谢基因主要多态位点突变等位基因及基因型频率
Table1Mutant alleles and genotypes frequencies of major polymorphisms of folate metabolism genes in different regions of China
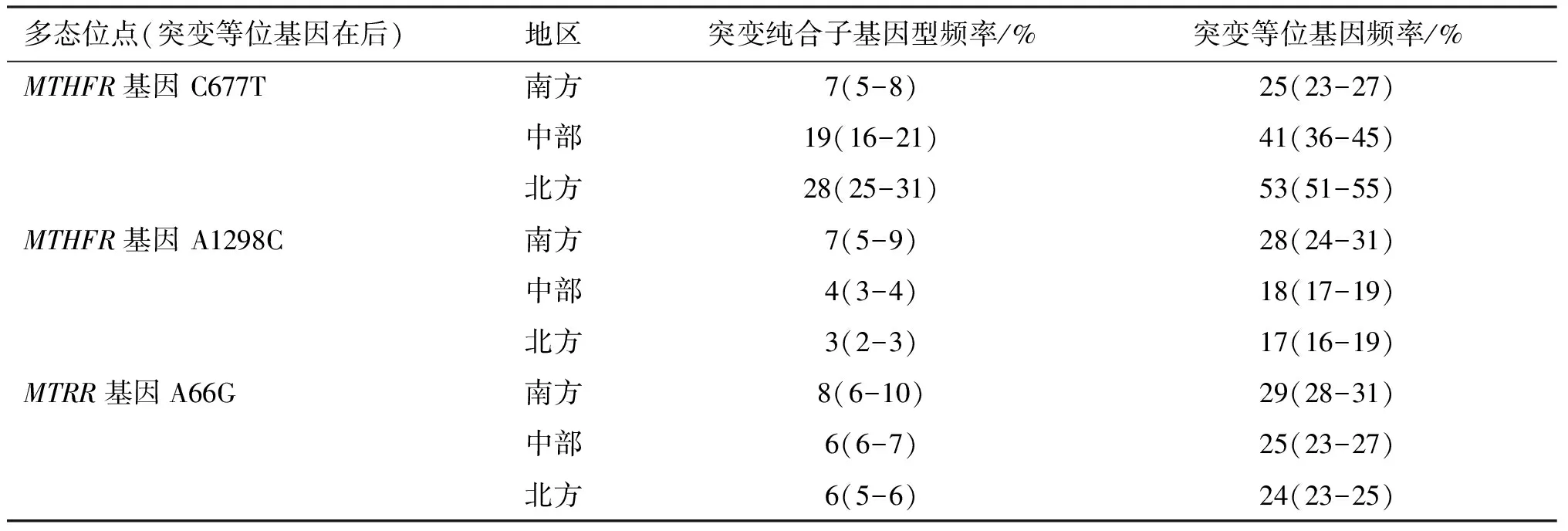
多态位点(突变等位基因在后)地区突变纯合子基因型频率/%突变等位基因频率/%MTHFR基因 C677T南方7(5-8)25(23-27)中部19(16-21)41(36-45)北方28(25-31)53(51-55)MTHFR基因 A1298C南方7(5-9)28(24-31)中部4(3-4)18(17-19)北方3(2-3)17(16-19)MTRR基因A66G南方8(6-10)29(28-31)中部6(6-7)25(23-27)北方6(5-6)24(23-25)
2.2 扩增阻滞突变系统聚合酶链反应(amplication refractory mutation system-PCR,ARMS-PCR)
该法又叫等位基因特异性PCR(allele specific PCR,AS-PCR),它使用针对每个位点的2种等位基因特异性引物即野生型引物PW和突变型引物PM配合常规引物进行PCR,通过电泳检测PCR产物是否出现PW、PM特异的目的条带来分辨基因型[32-33]。Lajin B等[34]使用该技术成功地建立了一种同管检测MTHFR基因C677T位点、A1298C位点及MTRR基因A66G 位点3个位点的方法,并检测了126例样本。该方法只需PCR反应和常规的电泳就可检测样本基因型,简便、快速、成本低,但影响特异性扩增的因素较多,PCR条件优化不当时容易造成基因分型错误。
2.3 测序(Sequencing)
Sanger测序(双脱氧链终止法)是基因检测的金标准,但需要昂贵的测序仪器和专业操作人员。Guo QN等[35]在一项研究中检测了212名个体MTHFR基因C677T位点、A1298C位点及MTRR基因A66G 位点的基因型,它们均由专业测序公司采用Sanger测序法完成。
焦磷酸测序(Pyrosequencing)是可与Sanger测序媲美的另一种测序技术。其原理是:引物与模板DNA退火后,在4种酶的协同作用下,将引物上每一个dNTP的聚合与一次荧光信号的释放偶联起来,通过检测荧光的释放和强度达到实时测定DNA序列的目的。该方法不仅需要昂贵的焦磷酸测序仪,而且测序反应体系中每种成分和参数的优化都比较麻烦。Roberto M等[36]在研究参与氟嘧啶代谢和5-氟尿嘧啶(5-FU)降解的基因的多态性时,使用该法检测了142例胃肠道肿瘤患者的MTHFR基因C677T位点、A1298C位点的基因型。
2.4 实时荧光PCR (real-time PCR,RT-PCR)
该法是在PCR扩增过程中,通过荧光信号对PCR进程进行实时检测的一种方法。在进行SNP分型时,PCR反应体系里除了引物外,还有探针,最常见的为Taqman探针,每个多态位点的2个等位基因各有其标记不同颜色荧光基团的特异性探针,未发生PCR扩增时,探针上一侧的荧光会被探针上另一侧的淬灭基团吸收,反应体系无法检测到荧光,一旦发生PCR扩增,探针上的淬灭基团会被水解,荧光基团发出荧光随即被检测,最后根据检测到的累积荧光就可判断样品的基因型。墨西哥学者在研究类风湿性关节炎的严重程度与相关单核苷酸多态性之间的潜在联系时,就采用基于Taqman探针的实时荧光PCR检测了MTHFR基因C677T位点、A1298C位点及MTRR基因A66G 位点的基因型[37]。王苏梅等[ 38]使用该法检测了100例样本,与PCR-RFLP法比较,符合率96%。该法操作简单、快速,但探针成本较高,且反应体系中引物、探针的浓度乃至DNA聚合酶的用量均需优化,给实验增加了一定的难度。
2.5 高分辨熔解曲线技术( high-resolution melting,HRM)
该法在PCR反应体系中加入一种饱和荧光染料,该荧光染料能结合到双链的DNA分子上,在PCR反应结束后,不断升温,使PCR产物上的荧光染料不断脱落导致荧光信号下降,从而绘制出相应的熔解曲线,并根据熔解曲线的变化判断样本的基因型,因为不同基因型样本PCR产物的碱基序列存在差异,解链行为不同导致熔解曲线存在差异。潘登等[39]使用该法检测了96例样本MTHFR基因C677T位点、A1298C位点及MTRR基因A66G 位点的基因型,分型结果与测序结果完全一致。李玲使用该法检测了1 000份样品,其中只有2例与测序结果不符,准确率99.8%[40]。HRM法操作简便、快速,不需要探针,但对仪器温度的均一性要求非常高,反应条件极为苛刻,必须反复摸索。
2.6 变性高效液相色谱(denaturing high performance liquid chromatography,DHPLC)
该方法是先通过PCR获得靶DNA分子,然后将DNA分子进行变性和复性,杂合子样品在复性的过程中会形成同源双链和异源双链,在部分变性温度条件下,异源双链因有错配区的存在而更易变性,在色谱柱中的保留时间少于同源双链,故先被洗脱下来,出现2个峰或多个峰。李才明等[41]用此法检测了334例南方汉族人的MTHFR基因C677T位点,CT基因型显示为2个峰,而CC和TT基因型标本在单独进样时仅出现单峰,而将CC和TT基因型的PCR产物混合后再进样,可出现与CT基因型标本类似的双峰,经酶切和测序验证,准确率99%以上。DHPLC检测高效快速,但对所用试剂和环境要求较高,否则容易产生误差。
2.7 基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/Ionization time-of-flight mass spectrometry,MALDI-TOFMS)
它是将PCR产物变性为单链后使用引物延伸单个碱基(多态位点碱基),根据引物在延伸反应中所结合的不同碱基的不同质量在质谱仪上显示不同峰而检测SNP。该法分析速度快、准确度高,但需要昂贵的质谱仪,且对操作人员要求高。Suthandiram S等[42]使用Sequenom-MassARRAY平台对372名非霍奇金淋巴瘤患者和722名对照者进行基因分型以研究MTHFR基因 C677T和A1298C单核苷酸多态性与非霍奇金淋巴瘤的患病风险。
2.8 DNA微阵列(DNA Microarray)
该技术在芯片上固定不同基因位点的特异性探针,然后与荧光标记的单链PCR产物进行杂交,通过杂交信号来判断基因型。Gra O等[43]采用一种名叫“Pharmagen biochip”的DNA微阵列检测了352名健康志愿者的MTHFR基因C677T位点、A1298C位点及MTRR基因A66G 位点的基因型。这类方法可一次性检测出多个SNP位点,但特异性较差,样品的制备和标记较为繁琐,检测成本高。
2.9 探针介导的重组酶扩增(probe-directed recombinase amplification,PDRA)
该方法虽然也涉及核酸的扩增,但属于恒温扩增,不需像PCR那样设置温度循环。它针对每个位点设立2个实时反应体系,每个反应体系包含一条序列一致的引物和一条等位基因特异的探针,此外,还含有单链结合蛋白SSB、重组酶UvsX、DNA 聚合酶、核酸外切酶Ⅲ等主要成分。当探针与靶DNA特异性杂交结合后,能够被核酸外切酶Ⅲ在 多态位点3′端附近的一个人为引进的四氢呋喃位点发生切割,切割产生的5′端片段能充当引物,在SSB、UvsX、DNA 聚合酶的协同作用下完成靶序列的扩增,切下的3′端片段上的荧光基团则能发出荧光,通过相关仪器收集累积的荧光信号就能判断基因型。Duan S等[44]使用该法检测了150例先天性心脏病患者的MTHFR基因A1298C位点的基因型,扩增反应在39 ℃下35 min内便可完成,分型结果与直接测序完全吻合。本法操作简便、快速,但引物的设计非常受限,引物的修饰标记比较麻烦,只能用于部分多态位点的基因分型。
2.10 PCR-金磁微粒层析法(PCR-gold magnetic nanoparticles-based lateral flow assay)
该法先利用AMRS-PCR对样品进行扩增,PCR产物两端分别带有地高辛及生物素标记,它们经过金磁微粒层析系统时,与层析体系中的偶联地高辛单抗的金磁微粒及链亲和素结合形成复合物,在层析试纸条的检测线处聚集大量磁粒,进而呈现红色条带,无扩增结果则在检测线上无条带呈现。Hui W等[45]使用该法检测了1 721例标本,分型结果与测序结果吻合率高达99.6%。本法操作简单,无需大型贵重仪器,PCR结束后10 min内可得到目视化结果,但引物标记、金磁微粒层析系统成本不菲,而且也难以避免AMRS-PCR本身的弊端。
综上所述,目前对叶酸代谢通路3个主要单核苷酸多态位点的检测方法较多,各有其优缺点,在各种科学研究及临床检测中,应综合考虑实验成本、实验周期、结果的准确性及相应的仪器、设备条件,选择合适的分型方法。

