基于Box-Behnken Design设计优化白藜芦醇纳米混悬剂的制备工艺
王鸿森,贾晓凡,徐彦浩,常晟,李丽,赵静,郝吉福
[1.山东第一医科大学(山东省医学科学院)药学院,山东 泰安 271016; 2.山东省泰山疗养院(山东省泰山医院),山东 泰安 271016]
根据生物药剂学分类系统,超过40%的已上市产品和约90%的新候选化合物属于水溶性较差的难溶性化合物[1],而药物溶出是吸收的必要前提,如何改善难溶性药物溶解度成为药剂学研究领域亟待解决的问题。近年来,应用纳米技术提高难溶性药物溶解度和改善生物利用度受到广泛关注[2-3]。纳米混悬剂是通过分散法或凝聚法将难溶性药物粒径控制在10~1 000 nm范围,药物以结晶型或无定型状态存在的分散体系[4],具有高载药量、制备方便、溶解速度增加等优点[5-6]。白藜芦醇为非黄酮的酚类物质,难溶于水,易溶于三氯甲烷、乙醇、丙酮等有机溶剂。白藜芦醇具有抗感染、抗氧化、抗癌、心血管保护等多种药理作用[7-9],但较低的水溶性限制了其应用。因此,本研究以白藜芦醇为模型药物,采用反溶剂沉淀法制备白藜芦醇纳米混悬剂,以聚乙烯吡咯烷酮PVPK 17 PF为助悬剂,泊洛沙姆F188为表面活性剂,以粒径及多分散指数(polydispersion index,PDI)为响应值,应用Box-Behnken Design响应面实验设计优化白藜芦醇纳米混悬剂的最佳处方,以期改善白藜芦醇的溶解度和溶出速度,提高白藜芦醇的生物利用度,为白藜芦醇的开发提供基础。
1 仪器与材料
1.1 仪器
LC-10A高效液相色谱仪(苏州岛津分析仪器有限公司);ME235P电子分析天平(德国Sartorius公司);Nano-S90激光粒度分析仪(英国Malvern公司);HZQ-C空气浴振荡器(哈尔滨市东明医疗仪器厂);3K30超速离心机(德国Sigma公司);KQ-100DE数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 药品与试剂
白藜芦醇(质量分数99%,批号20170709,陕西慈缘生物有限公司);白藜芦醇对照品(批号111535-201703,中国食品药品检定研究院);聚乙烯吡咯烷酮(PVP K17PF)及泊洛沙姆188(F188)由北京凤礼精求有限公司提供;其余试剂为分析纯。
2 方法与结果
2.1 白藜芦醇纳米混悬剂的制备
采用反溶剂沉淀法制备白藜芦醇纳米结晶混悬剂[10]。将助悬剂PVP K17PF及表面活性剂F188溶解于蒸馏水中作为水相,白藜芦醇溶解于无水乙醇中作为有机相,在1 500 r/min搅拌状态下将白藜芦醇无水乙醇溶液加至上述水相中形成均一混悬体系,即得白藜芦醇纳米混悬剂。在纳米混悬剂中加入质量浓度3%甘露醇,搅拌溶解后分装至西林瓶中,置于超低温冰箱中以-80 ℃冷冻24 h,置冷冻干燥机中,在10 Pa、-40 ℃条件下冷冻干燥48 h,得到白藜芦醇纳米混悬剂冻干品,备用。
2.2 处方优化
2.2.1 Box-Behnken设计 在单因素考察试验基础上,选择对纳米混悬剂制备工艺影响显著的3个因素,即药物质量浓度(mg/mL,X1)、助悬剂质量分数(%,X2)与表面活性剂的质量浓度(mg/mL,X3),分别用代码-1、0、+1标识所选择的每个因素的低、中、高3个水平。以纳米混悬剂的粒径大小和多分散指数(polydispersion index,PDI)为响应值,采用三因素三水平的Box-Behnken设计安排试验,因素与水平安排见表1。
表1 Box-Behnken design试验设计因素与水平
Table1The factors and levels of Box-Behnken design experimental design
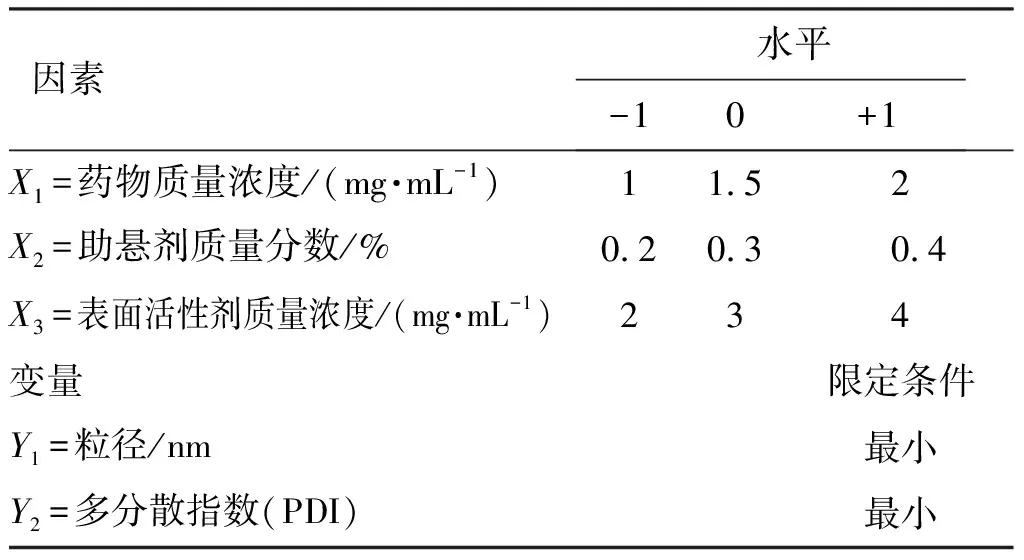
因素水平-10+1X1=药物质量浓度/(mg·mL-1)11.52X2=助悬剂质量分数/%0.20.30.4X3=表面活性剂质量浓度/(mg·mL-1)234变量限定条件Y1=粒径/nm最小Y2=多分散指数(PDI)最小
2.2.2 数据处理 根据Box-Behnken试验设计安排采用反溶剂沉淀法制备白藜芦醇纳米混悬剂,并测定粒径及PDI等2个响应值,结果见表2。可见,白藜芦醇纳米混悬剂的粒径变化范围为141~277.6 nm,PDI为0.086~0.234,提示纳米混悬剂粒径大小分布相对比较均匀。
以粒径大小及PDI作为响应值,利用Design expert实验设计软件对各变量与响应值之间进行数学模型的拟合,根据独立变量与响应值之间的相互关系,分别进行线性方程(Linear)、两因素交叉方程(2F)及二项式指数方程(Quadratic)的拟合,分析各变量之间的相关系数、调整参数及预测参数以确定拟合方程的归属,结果见表3。
可见,当选择粒径及PDI为响应值时,与线性方程、2F交叉方程相比较,二项式方程模型各参数值较大,故选择该数学模型来描述各变量对响应值的作用。
由方差分析及各参数的P值大小可知,白藜芦醇的质量浓度(X1)、PVP K 17质量分数(X2)、交互项(X1X2,X1X3)及白藜芦醇质量浓度的二项式模型(X12)为影响粒径的显著性因素,所拟合的方程为:Y1= 172.54 + 27.72X1+ 23.66X2- 33.48X1X2+ 33.59X1X3+ 31.57X12,经F值检验显示模型方程显著(r2=0.914 9),可选择该方程预测白藜芦醇纳米混悬剂的最优处方。
在纳米混悬剂递送体系中,PDI为评价体系分散均匀程度的重要参数,当PDI<0.3时认为体系呈均一分散状态。影响PDI的主要因素包括白藜芦醇的质量浓度(X1)、PVP K 17(X2)及表面活性剂F188质量浓度(X3),交互项(X1X2,X1X3)及表面活性剂的二项式模型(X32)。所拟合的方程用公式表述为:Y2= 0.11 + 0.03X1- 0.031X2- 0.023X3- 0.036X1X2- 0.022X1X3+ 0.013X32,经F值检验表明模型方程显著(r2=0.971 0),可选择该方程预测白藜芦醇纳米混悬剂的最优处方。
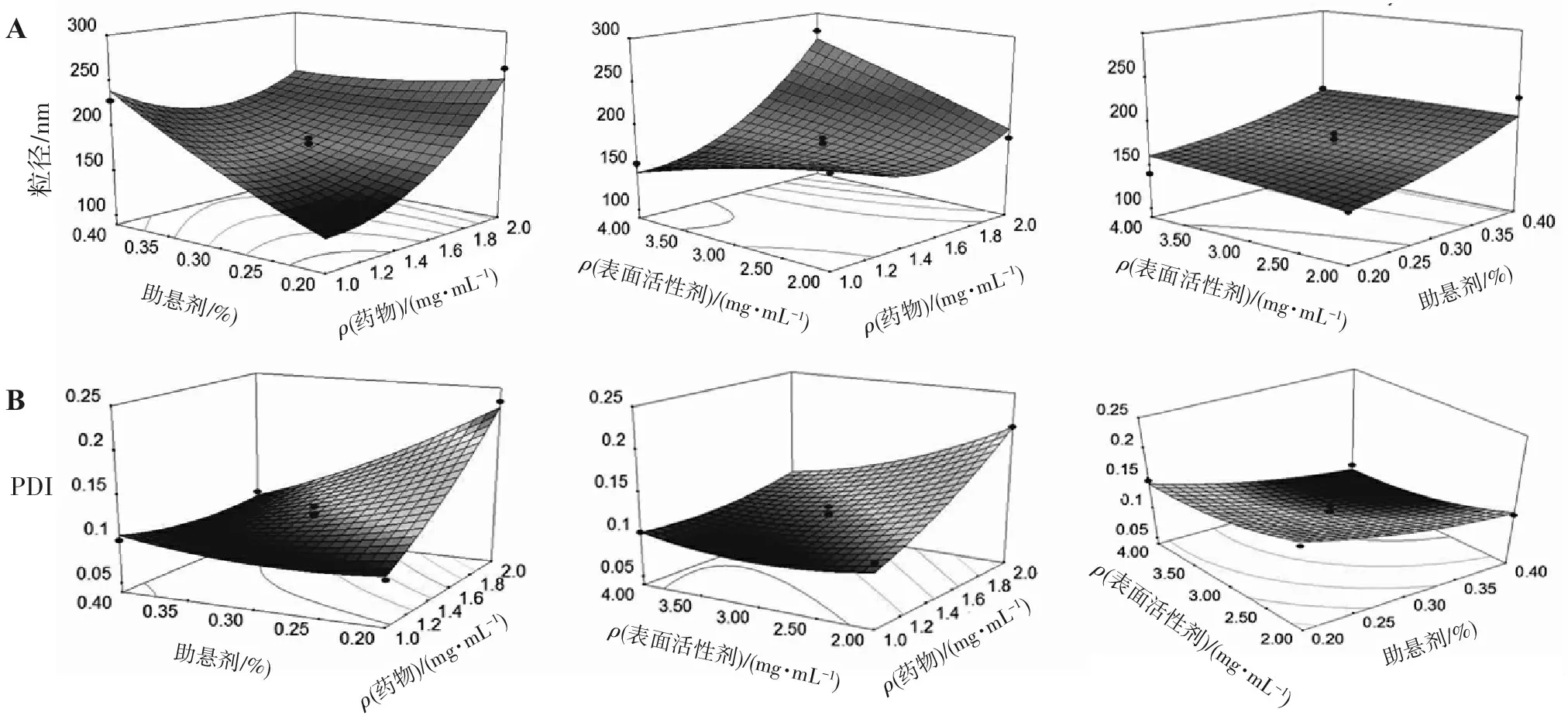
2.2.3 效应面分析预测与处方优化 根据纳米混悬剂的要求,目标希望获得较小的粒径及PDI的处方,应用Design expert试验设计软件绘制不同变量对响应值影响的三维曲面图,探讨各因素对粒径及PDI的影响,结果见图1。
由图1 A 可知,纳米混悬剂的粒径随药物质量浓度的增加以非线性模式增加,高浓度的药物会产生较大的粒径;随表面活性剂F188质量浓度的增加,粒径呈减少趋势;随助悬剂比例的增加,粒径呈增加趋势。
由图1 B可知,随药物质量浓度的增加,纳米混悬剂的PDI呈增加趋势,提示药物质量浓度会影响到纳米混悬剂的分布情况;助悬剂PVP K17的质量分数的增加,对PDI的影响呈递减趋势;而表面活性剂F188质量浓度的变化,对PDI的影响不明显。
按设计的限定目标对纳米混悬剂进行处方优化,期望使纳米混悬剂的粒径与PDI处于最小值,根据Design expert试验设计软件确定所设定因素X1、X2、X3的代码值,并制备了4批白藜芦醇纳米混悬剂,测定其粒径大小及PDI,结果见表4。
由表4可知,处方1与处方3所得实测值和模型预测值之间的偏差较小,表明模型在该条件下具有良好的预测性,与实际值接近。另考虑到为提高处方中的药物含量,故选择处方1作为最终优化处方。
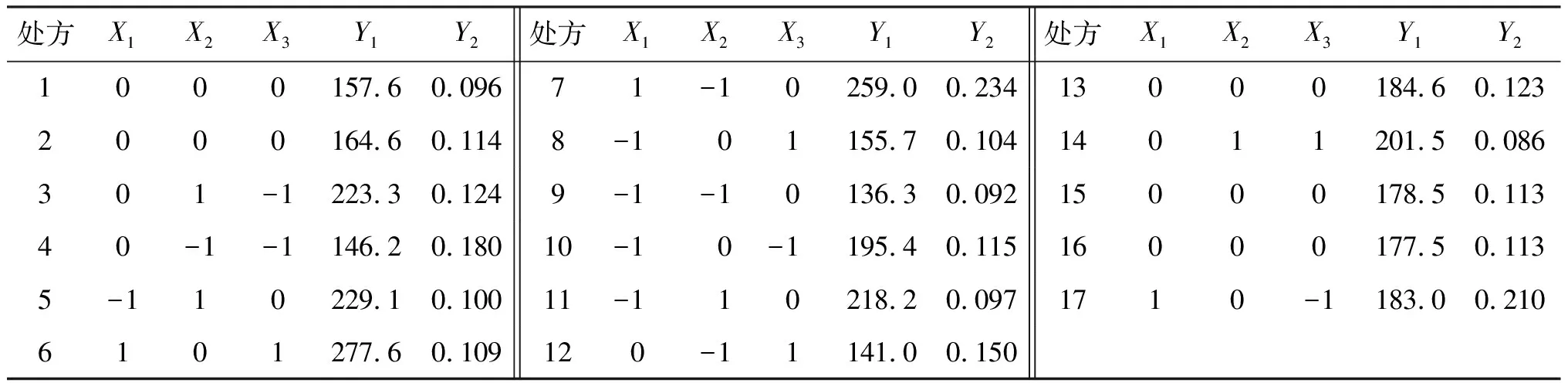
表2 Box-Behnken试验设计及结果Table 2 The Box-Behnken design experimental design and results (n=3)
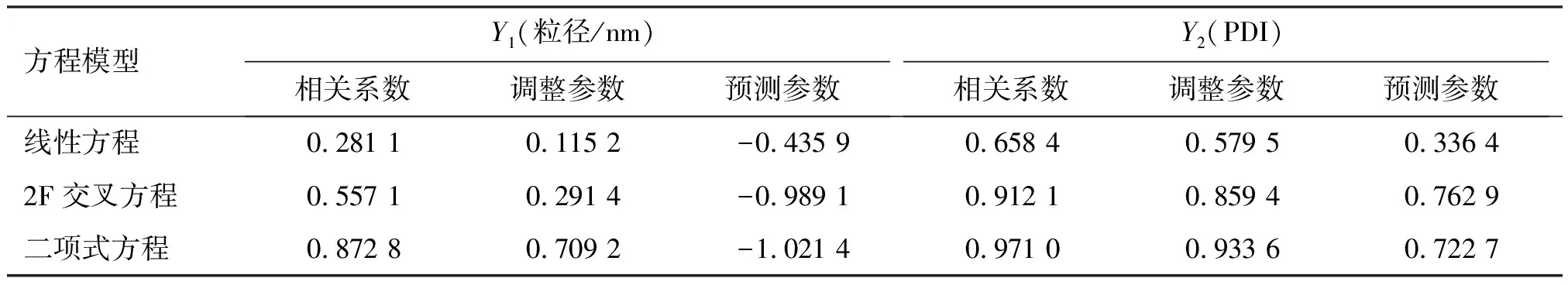
表3 响应值模型方程拟合结果Table 3 The results of response value model equation fitting
粒径/nmPDIρ(表面活性剂)/(mg?mL-1)ρ(表面活性剂)/(mg?mL-1)ρ(药物)/(mg?mL-1)ρ(药物)/(mg?mL-1)助悬剂/%)助悬剂/%)ρ(药物)/(mg?mL-1)ρ(药物)/(mg?mL-1)ρ(表面活性剂)/(mg?mL-1)ρ(表面活性剂)/(mg?mL-1)助悬剂/%)助悬剂/%)AB
图1各因素变量对粒径(A)及PDI(B)影响的效应面图
Figure1Response surface model (RSM) presenting the influence of the independent variables on the particle size (A) and PDI (B)
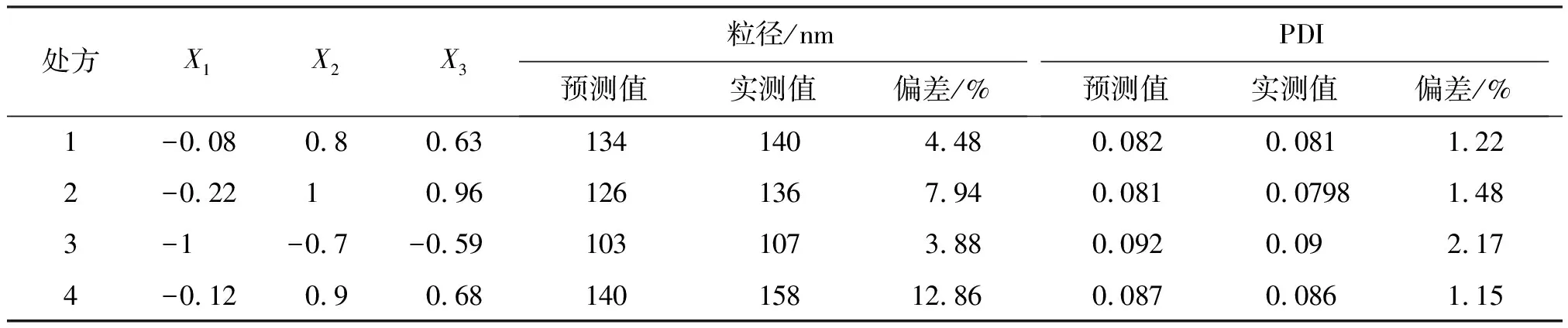
表4 白藜芦醇纳米混悬剂模型验证实验中的实测值和预测值Table 4 Predicted values and actual values of resveratrol nanosuspension formulation
注:偏差=(预测值-实测值)/预测值。
将代码优化数值通过下列公式转化成优化的实际数值,所以对于每一个变量,优化后的实际值为:
选择从2016年1月—2017年12月收治的100例肺部真菌感染患者纳入此次研究工作。100例肺部真菌感染患者中,有男性患者53例,有女性患者47例;患者年龄最小20岁,年龄最大78岁,平均年龄为(38.50±10.35)岁;患者病程时间最短1年,病程时间最长25年,平均病程时间为(7.50±5.45)年。此次研究工作征得患者本人的知情同意,签署知情同意书。
代码值=(实际值-实际值的平均值)/实际值的差值,
药物的量(mg/mL) = 10(X1)+ 30,
稳定剂用量(%) = 0.1(X2)+ 0.3,
表面活性剂量(mg/mL) = 1(X3)+ 3,
即优化后的处方为:白藜芦醇的质量浓度为29.2 mg/mL,PVP K17 的质量分数为0.38%,Poloxmer 188质量浓度为3.63 mg/mL。采用“2.1”项下方法制备白藜芦醇纳米混悬剂3批,测得3批制剂的平均粒径为(145.7 ± 7.07) nm,平均PDI为0.0826± 0.0015。
2.3 白藜芦醇纳米混悬剂粒径测定及形貌观察
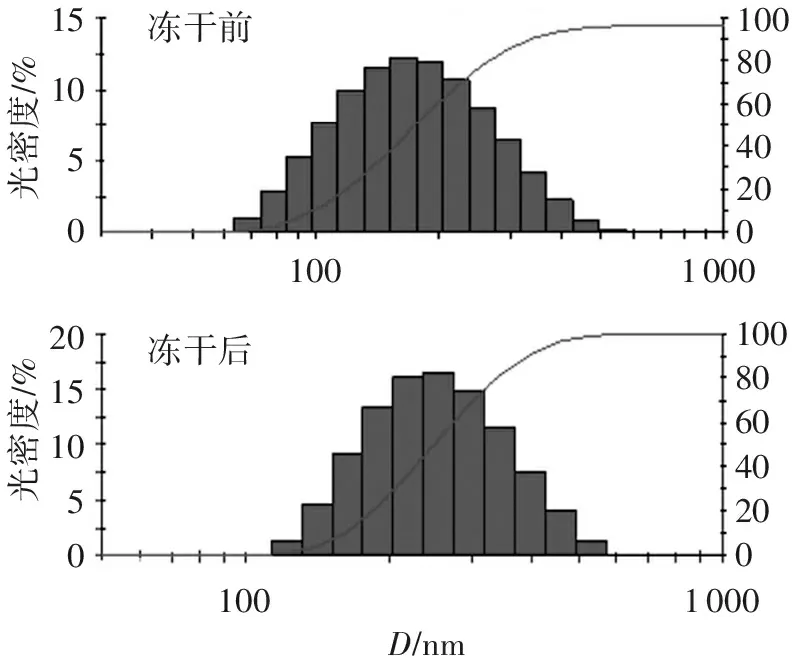
将所制备的白藜芦醇纳米混悬剂加入适量蒸馏水稀释及纳米混悬剂冻干品复溶后,置于激光粒度分析仪中测定粒径分布,结果见图2。粒径测定结果显示,白藜芦醇纳米混悬剂在冻干前、冻干后的粒径分别为(145±6.56) nm和(241± 3.01) nm,粒径有所增加,这与冻干过程中纳米粒子发生聚集有关。
采用透射电镜观察白藜芦醇纳米混悬剂的形态。将白藜芦醇纳米混悬剂滴于铜网上,滴加1%磷钨钼酸负染,用滤纸吸去多余的液体,室温自然晾干后,将铜网置于透射电镜下进行观察,结果见图3。可见,白藜芦醇纳米混悬剂呈不规则颗粒状。
2.4 白藜芦醇纳米混悬剂稳定性考察
光密度/%151050光密度/%20151050100806040200100806040200冻干前冻干后10010001001000D/nm
图2白藜芦醇纳米混悬剂冻干前与冻干后的粒径分布
Figure2Particle size distribution of resveratrol nanosuspension before and after lyophilization

图3白藜芦醇纳米混悬剂透射电镜图
Figure3TEM image of resveratrol nanosuspension
表5 白藜芦醇纳米混悬剂稳定性试验结果
Table5The stability results of resveratrol nanosuspension (n=3)
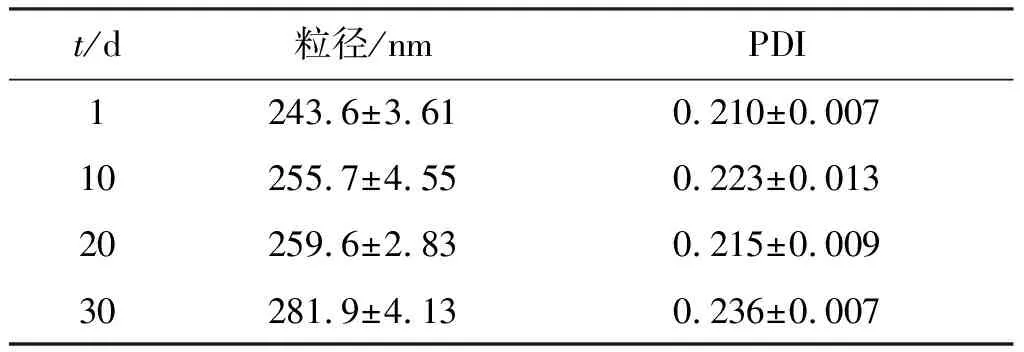
t/d粒径/nmPDI1243.6±3.610.210±0.00710255.7±4.550.223±0.01320259.6±2.830.215±0.00930281.9±4.130.236±0.007
2.5 体外释药性能研究
参照2015年版《中国药典》第四部通则中0931项下溶出度与释放度测定法中的桨法进行体外溶出实验。分别取白藜芦醇纳米混悬剂、白藜芦醇原料药和物理混合物(按纳米混悬剂处方将其余辅料与白藜芦醇混合均匀)3组样品,每组3份,每份均含有等量的10 mg白藜芦醇。将样品分别加入至(37±0.5) ℃的200 mL PBS溶液(pH 7.4,0.1%吐温80)中,调整搅拌速度为100 r/min,在5、15、30、45 min和1、2、3、4、5 h等时间点取样2 mL,经0.22 μm微孔滤膜过滤后,采用HPLC测定白藜芦醇的含量,计算不同时间药物的累积释放量,以时间为横坐标,累积释放量为纵坐标,绘制白藜芦醇体外释放曲线,结果见图4。
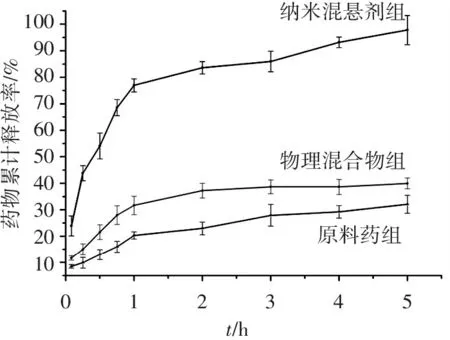
药物累计释放率/%100908070605040302010012345t/h纳米混悬剂组原料药组物理混合物组
图4白藜芦醇体外释放速率曲线
Figure4The cumulative release profiles of resveratrol nanosuspensioninvitro
可见,纳米混悬剂可显著提高白藜芦醇的溶出速率。在pH7.4的PBS中,纳米混悬剂在30 min内累积溶出接近50%,并在1 h累积溶出接近80%;而原料药在30 min内累积溶出不到15%,1 h内的累积溶出仅为20%。此外,与原料药相比,物理混合物组的溶出速率比原料组稍快,提示处方中的辅料具有一定的助溶作用,但溶出速率改善不明显。
分别以零级动力学方程、一级动力学方程、Higuchi方程、Weibull方程、Peppas方程和Niebergull方程对体外释药数据进行拟合,判断描述药物释放的最佳模型,所得到拟合方程见表6。相关系数(r)越接近1,表明拟合效果越好。
由拟合方程的相关系数可知,pH7.4的溶出介质中白藜芦醇纳米混悬剂的体外释药符合一级速率方程,白藜芦醇原料药符合Higuchi模型,物理混合物组的释药方程符合Weibull方程。根据Peppas方程,可以探讨药物的释放机理,当0.45
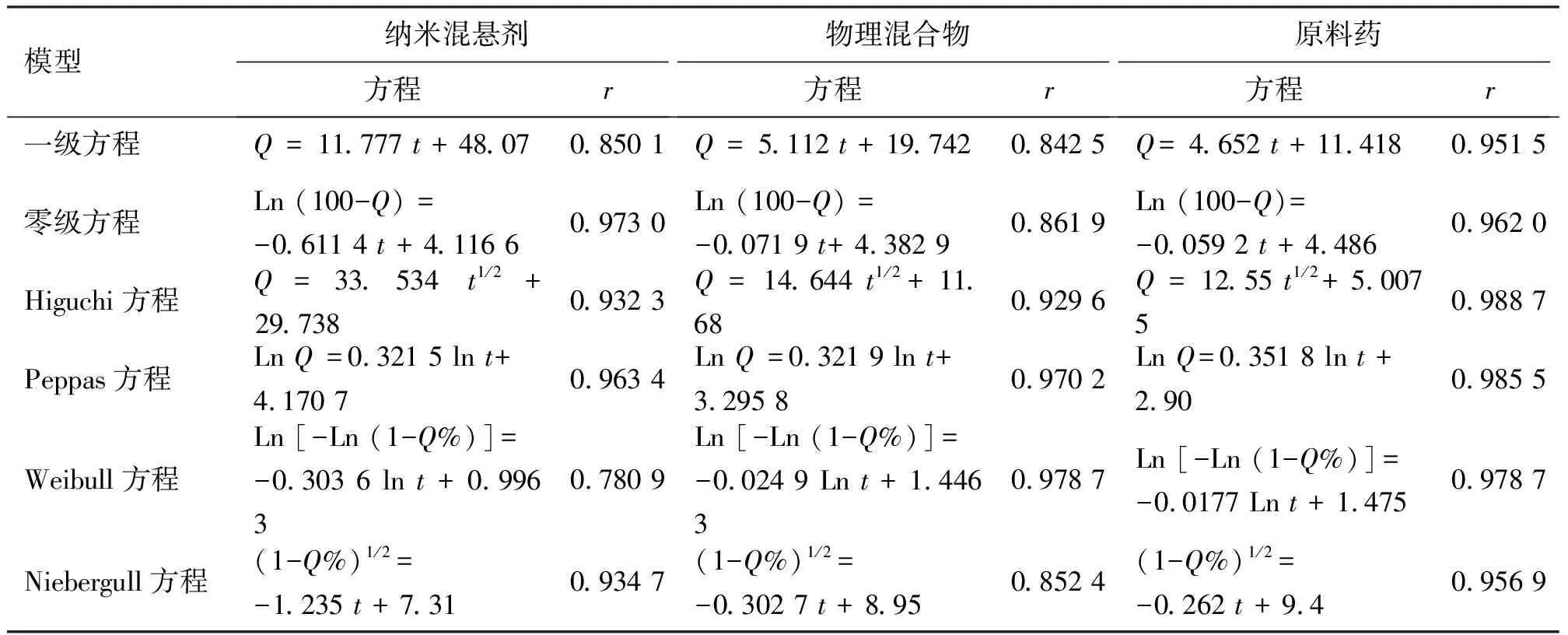
表6 白藜芦醇体外溶出不同释药模型拟合方程Table 6 The release regression equations of resveratrol in vitro
3 讨论
纳米混悬剂与传统高分子材料的纳米载体不同,它不需要载体材料,仅通过表面活性剂与助悬剂的稳定作用,是采用分散技术(Top-down)或者凝聚技术(Bottom-up)将药物颗粒分散在水中形成的稳定的纳米分散体系[11-12]。《欧洲药典》中根据溶解度的定义认为白藜芦醇属于“几乎不溶性”药物[13],白藜芦醇具有较好的脂溶性,按照溶解性与透膜性将白藜芦醇归属于生物药剂学分类系统中的Ⅱ类药物[14]。因此,本课题组拟将白藜芦醇制备成纳米混悬剂,以增加其溶解度从而提高生物利用度。
本研究重点在于应用Box-Behnken Design响应面试验设计优化白藜芦醇纳米混悬剂的最佳处方。在试验中,以粒径大小及粒径PDI为响应值,采用三因素三水平的Box-Behnken Design响应面试验设计,通过建立数学二项式模型及数理统计分析考察药物质量浓度、助悬剂聚维酮PVP K17质量分数及表面活性剂F188质量浓度对响应值的影响,以优化最佳处方。结果表明优化后最佳的处方组成为:白藜芦醇的质量浓度为29.2 mg/mL、PVP K17质量分数为0.38%及乳化剂Poloxmer 188的质量浓度为3.63 mg/mL。
在采用反溶剂沉淀法制备纳米混悬剂的过程中,乙醇扩散到水相中,白藜芦醇由于在水中的溶解度小会析出结晶,形成药物的微小晶核,而助悬剂PVPK17PF可以增加体系的黏度,表面活性剂F188可以降低药物与溶剂之间的表面张力,两者可以吸附在白藜芦醇晶核的表面,防止晶核之间的聚集,阻碍药物结晶发生沉降,从而形成稳定的纳米混悬剂。
从体外释药测定结果来看,白藜芦醇溶出速率的加快与粒径减少有关。 纳米混悬剂之所以能增加难溶性药物的溶解度和提高溶出速度,可以用经典的Noyes-Whitney及Ostwald-Freundlich方程说明。纳米颗粒比表面积和溶解度与颗粒的粒径大小成反比,溶出速率与颗粒的粒径成反比,即药物的溶出速率和溶解度随着药物颗粒粒径的减小而提高。当将白藜芦醇制备成纳米混悬剂后,可以提供比较大的分散面积与较小的药物粒径,两者共同改善药物的溶出度[15]。体外溶出结果说明将白藜芦醇制备成纳米混悬剂可以提高白藜芦醇的溶出度,为难溶性药物白藜芦醇的进一步开发奠定了基础。
综上所述,本研究采用反溶剂沉淀法制备白藜芦醇纳米混悬剂,制备过程简单,可以获得粒径在150 nm左右的纳米混悬剂,后续工作将进行白藜芦醇纳米混悬剂体内药动学的研究。

