药代动力学实验室液相色谱串联质谱仪期间核查方法的建立
金冠钦,孙黎,王玉洪,夏玲红,林厚文
(上海交通大学医学院附属仁济医院药学部,上海 200127)
随着检测技术的迅速发展,高效液相色谱串联质谱技术(LC–MS/MS)以其分析时间迅速、分离能力强、操作相对便捷的优势在国内外药代动力学实验室中备受青睐。然而,使用者虽能准确熟练操作,但对于如何自行对液相色谱质谱联用仪进行性能考察,以验证其检测结果的质量,尚无统一、系统的方法可供参考。2010 年,福建省率先出台首部《JJF( 闽)1032–2010 液相色谱–质谱联用仪校准规范》[1],首次细化液相色谱–质谱联用仪的校准要求,并形成规定;2011年,颁布了全国性校准规范指导文件《JJF1317–2011 液 相 色 谱– 质 谱 联 用 仪 校 准 规 范》[2], 明确了液相色谱–质谱联用仪进行性能考察的参数指标,为其开展期间核查奠定了基础。
作为国内较早通过ISO/IEC 17025 认可的实验室,上海交通大学医学院附属仁济医院临床药理实验室自2010 年起运行体系,分别从质量手册、程序文件以及标准操作规程三个层次对实验室仪器进行有效管理。新版指导性文件CNAS CL–01: 2018对仪器设备的期间核查内容进行了更新,其中6.4.4和6.4.10 条款对设备的验证和核查提出了明确要 求[3]。开展期间核查的目的是为了保证设备的可信度,在两次的检定或校准期间,验证仪器的运行状态,确定其状态的保持情况,防止因仪器设备出现意外偏离而影响检测结果的准确性[4]。LC–MS/MS既是药物浓度检测最重要且常用的工具,也是准确度要求较高的关键设备[5]。液相色谱–质谱联用仪作为CNAS 资质认定的检测能力要求之一,对其状态考察更是实验室仪器管理的重中之重[6]。本实验室制定相关标准操作规程,结合国内外经验[7–8],从状态及性能核查、仪器比对、全国实验室间质评等多角度,建立对液相色谱–质谱联用仪的期间核查方法,以确保其检测结果的有效性及准确性。笔者以API 3200 QTrap 三重四级杆液相色谱–质谱联用仪为例,详细介绍其期间核查的方法。
1 实验方法
实验室根据仪器检定规程、厂家提供的使用说明及国家计量检定规范,并结合自身的实际情况,制定了针对液相色谱质谱联用仪期间核查的标准操作规程。期间核查包括:状态及性能核查、仪器比对、室间质评三方面。
1.1 状态及性能核查
状态及性能核查使用公式(1)~(5)。
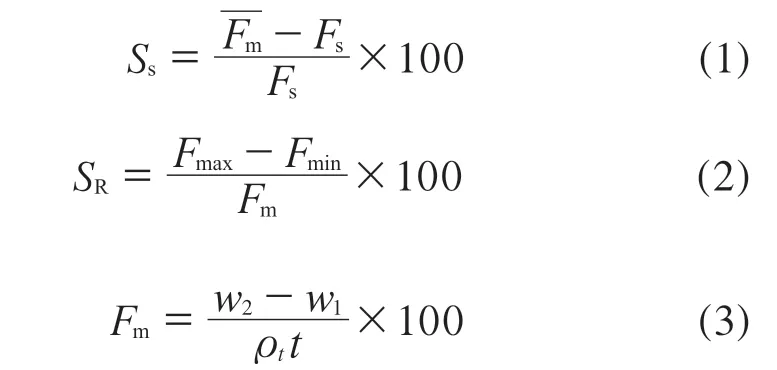
式中:SS——泵流量准确性,%;
SR——泵流量稳定性,%;
Fs——流量设定值,mL/min;
Fmax——同一设定流量3 次测量值的最大值, mL/min;
Fmin——同一设定流量3 次测量值的最小值, mL/min;
Fm——流量实测值,mL/min;
w2——容量瓶与流动相的质量之和,g;
w1——容量瓶的质量,g;
ρt——实验温度下流动相的密度,g/cm3;
t——收集流动相的时间,min。

式中:ΔM——质量准确性,u;
Mia——第i 个离子的测量值,u;
Mib——第i 个离子的理论值,u。

式中:RSD——测定结果的相对标准偏差;%;
xi——第i 次测量保留时间(min)或色谱峰面积;
i——测量序号。
1.1.1 泵流量稳定性(SR)及泵流量准确性(SS)
液相色谱–质谱联用仪由高效液相色谱仪及三重四级杆质谱仪串联组成,高效液相色谱仪的流量对于样品出峰时间,峰型以及峰面积均有影响。由于该高效液相色谱仪与质谱配套使用,液相部分常规的流量设置均小于1 mL/min,故只需考察0.5 mL/min 及1 mL/min 两个流量点,取消对大于1 mL/min 流量的核查。在测试开始前连接输液系统、进样器,流动相为纯化水,打开阀门,于废液出口用10 mL 容量瓶(容量瓶已称定空瓶重量,且经华东国家计量测试中心检定合格)收集流动相。用秒表计时,其中0.5 mL/min 流量的收集时间为10 min,1.0 mL/min 流量的收集时间为5 min,收集结束后于经检定合格的电子天平上称定重量,每个流量分别重复测量3 次。测定过程中用经检定的温度计对水温进行实时测定,以计算纯化水重量。按公式(3)计算流量实测值Fm,按公式(1)和公式(2)计算SS和SR。要求流量为0.5 mL/min 的泵流量设定值误差不大于5%,泵流量准确性误差不大于3%;流量为1.0 mL/min 的泵流量设定值误差不大于3%,泵流量准确性误差不大于2%。
1.1.2 质量范围、质量数准确性、分辨力
(1) 依 据《JJF1317–2011 液 相 色 谱– 质 谱 联用仪校准规范》中关于标准物质或试剂的要求,实验选择聚醚多元醇(PPG)作为仪器调谐液,利用PPG425,PPG1000,PPG2000 混合溶液对质量数应用范围大于1 000 的质谱仪进行校准调谐。实验室常用的电离模式为ESI 模式,故期间核查针对ESI正离子及负离子进行考察。正离子模式下,分别于Q1 及Q3 采 用59.050,175.133,616.464,906.673,1 254.925,1 545.134 六个离子进行测试;负离子模式 下 则 采 用44.998,585.385,933.636,1 223.845,1 572.097 进行测试,根据测试结果记录可使用的质量范围。
(2)质量准确性判定时,将PPG 混合液直接针泵注入液相色谱质谱联用仪离子源,分别使用上述离子理论值±5 的范围进行扫描,根据公式(4)计算ΔM,以ΔM 的最大值作为质量准确性的结果,要求液相色谱质谱联用仪的质量准确性ΔM ≤0.5 u。
(3)分辨力测试需等待仪器运行稳定后,仍使用针泵将PPG 混合液注入离子源,直接考察6 个离子的半峰宽(W1/2),作为分辨力的结果。要求本实验室液相色谱质谱联用仪的分辨力不大于1 u。
以上三个参数均可通过PPG 混合液进行测试。在测试过程中,分辨力可通过改变offset 值进行调整,整体响应值的大小可通过改变IE 值调整。当各参数调整至满意结果后,则更新数据完成仪器的自校准。正、负离子模式下PPG 溶液全扫描10 次叠加质谱图见图1。
1.1.3 信噪比
在ESI 正离子模式下,使用50 pg/μL 利血平标准溶液,经WATERS XBridge C18色谱柱(100 mm×2.1 mm,3.5 μm)注入液相色谱质谱联用仪,观察色谱图,记录色谱峰高Hs以及信号峰后1~3 min的基线输出信号Hn,并计算信噪比S/N,连续测量6次,以6 次测量S/N 的平均值作为信噪比结果。要求信噪比不小于50∶1;ESI 负离子模式下,采用100 pg/μL 氯霉素标准液,按上述方法测定信噪比,要求信噪比不小于20∶1。
1.1.4 色谱峰面积重复性与保留时间重复性
在ESI 正 离 子 模 式 下,使 用50 pg/μL 利血平标准液,经WATERS XBridge C18色谱柱(100 mm×2.1 mm,3.5 μm)注入1 μL 进入液相色谱质谱联用仪,记录其色谱峰面积和保留时间,连续测量6 次。由公式(5)分别计算色谱峰面积与保留时间的相对标准偏差(RSD),作为色谱峰面积重复性与保留时间重复性的结果。ESI 负离子模式下,采用100 pg/uL 氯霉素标准液,按上述操作方法测定。要求ESI 正负离子模式下的色谱峰面积重复性RSD ≤6%,保留时间重复性RSD ≤2%。正、负离子模式下,利血平(m/z=609.3 →195.1)及氯霉素(m/z=321.0 →152.0)的典型色谱图见图2。

图1 PPG 溶液全扫描质谱图

图2 利血平及氯霉素典型色谱图
1.2 仪器比对
仪器比对是与相同准确度等级的另一个仪器的量值进行比较,利用比较结果完成核查[9]。通过对实验室各仪器间的相互比对,可考察同一待测物在不同仪器下测试结果的准确性及可靠性[10]。
1.2.1 比对仪器
仪器1:API 3200Trap 型串联四级杆质谱系统,岛津LC–20ADXR 色谱系统;
仪器2:API 4000 型串联四级杆质谱系统,岛津LC–20ADXR 色谱系统。
1.2.2 药品
氧氟沙星对照品:纯度为99.7%,批号为130454–201206,中国食品药品检定研究院;
内标物环丙沙星对照品:纯度为99.8%,批号为130451–201203,中国食品药品检定研究院。
1.2.3 测试条件、样品处理与溶液配制
(1)色谱条件。色谱柱:Waters BEH C18柱(50 mm×2.1 mm,1.7 μm);流动相比例:甲醇–0.5%甲酸水(体积比为20∶80)。
(2)质谱条件。电喷雾离子源(ESI);正离子多反应监测(MRM);离子喷射电压:5 500 V;离子源温度:600℃;去簇电压:50 V;碰撞电压:20 V;氧氟沙星、环丙沙星离子反应对分别为m/z 362.1 →m/z318.0,m/z 332.4 →m/z 288.2。
(3)血浆样品处理。精密吸取100 μL 血浆,转移至1.5 mL 的PEEK 管中,再加入300 μL 含内标环丙沙星浓度为100 ng/mL 的甲醇溶液,置于涡旋振荡器上振荡1 min,15 000 r/min 离心得沉淀蛋白,取100 μL 上清液转移至另一PEEK 管内,再加入300 μL 含0.5%甲酸的水溶液,涡旋混匀1 min后转移至自动进样小瓶待测。
(4)溶液配制。①体外标准溶液的制备:精密称取氧氟沙星标准品18.60 mg,用甲醇溶解并定容至25 mL,得741.8 μg/mL 的标准液作为储备液,然后用甲醇稀释得1,2,4,10,20,40,100 μg/mL 体外系列标准工作溶液。②体内标准溶液的制备:分别取上述体外系列标准工作溶液各10 μL,分别加入空白血浆190 μL,得到50,100,200,500,1 000,2 000,5 000 ng/mL 的体内系列标准工作溶液,再按1.2.3(3)方法处理即得。
1.3 实验室间质评
实验室间质评作为保证检测准确可靠的必要手段[11],已成为国内外衡量ISO17025 认可实验室检测能力的风向标[12–13]。本实验室自2015 年始,至今已参加4 次由国家临床检验中心发起的全国药代动力学实验室间质评活动(计划编码:NCCL–PH–01),成绩全部为“满意”。HPLC–MS/MS 法测定人血浆卡马西平的浓度系成熟稳定的测定方 法[14–15],适合作为室间质评方法对仪器进行考察。实验室将全国室间质评纳入仪器检测结果质量保证体系中,以期从实际出发,对液相色谱质谱联用仪的性能进行评价。
1.3.1 药品
卡马西平对照品:纯度为99.7%,批号为100142–201105,中国食品药品检定研究院;
内标物(IS)卡马西平–D10 对照品:纯度为100%,批号为FN06241603,美国西格玛奥德里奇公司。
1.3.2 测试条件、样品处理与溶液配制
(1)色谱条件。色谱柱:Waters XBridgeTMC18柱(3.5μm,2.1×100 mm);保护柱:Waters XBridgeTMC18柱(3.5μm,4.6×20 mm);流动相:0.2%甲酸水溶液–乙腈;流量:0.4 mL/min;梯度洗脱:0.10 min 为0.2%甲酸水溶液–乙腈(90∶10),0.40 min为0.2%甲酸水溶液–乙腈(5∶95),3.00 min 为0.2%甲酸水溶液–乙腈(5∶95),3.30 min 为0.2%甲酸水溶液–乙腈(90∶10),4.00 min 停止。
(2)质谱条件。电喷雾离子源(ESI),正离子多反应监测(MRM),离子喷射电压:5 000 V,离子源温度:650℃;去簇电压:66 V;碰撞电压:25 V;卡马西平及内标离子反应对分别为m/z 237.2 →m/
z 194.2,m/z 247.2 →m/z 204.2。
(3)血浆样品处理。取血浆40 μL 置于2 mL的PEEK 管中,加入乙腈溶液(含内标物卡马西平–D10 浓度为10 ng/mL)360 μL,用涡旋混合器振荡3 min,混匀后于13 000 r/min、15℃下离心5 min,取上清液40 μL 加入至360 μL 的10%乙腈水溶液中,涡旋振荡1 min,再于13 000 r/min、15℃离心5 min,取上清液300 μL转移至进样瓶中待测。
(4)溶液配制。①体外标准溶液的制备:精密称取卡马西平标准品20.66 mg,用甲醇溶解并定容至100 mL,得205.98 μg/mL 的卡马西平标准液作为储备液,取3 mL 储备液用50%甲醇水溶液稀释至50 mL,得12.359 μg/mL 卡马西平标准液,并逐级对半稀释,得6.179,3.09,1.545,0.772,0.386 μg/mL体外系列标准工作溶液。②体内标准溶液的制备:分别取上述体外系列标准工作溶液各40 μL,分别加入空白血浆360 μL,得到38.6,77.2,154.5,309,617.9,1235.9 ng/mL 的体内系列标准工作溶液,再按上述“1.3.2(3)”方法处理即得。
正离子模式下,卡马西平(m/z=237. 2 →194. 2)及内标物卡马西平–D10(m/z=247. 2 →204. 2)的典型色谱图见图3、图4。

图3 卡马西平色谱图(m/z=237.2 →194.2)

图4 卡马西平–D10 色谱图(m/z=247.2 →204.2)
2 结果与讨论
2.1 状态及性能核查结果
通过对API3200 QTrap 的各技术指标的核查,结果均合格,故2019 年度液相色谱质谱联用仪状态及性能核查通过,结果详见表2 及表3。

表2 2019 年度液相色谱质谱联用仪状态及性能核查结果(质谱)

表3 2019 年度液相色谱质谱联用仪状态及性能核查结果(液相)
2.2 仪器比对结果
两台仪器分别测定同一个未知浓度氧氟沙星血浆样品,测定10 次。统计方法依次采用格鲁布斯(Grubbs)检验剔除离群数值、F 检验判断两组数据精密度有无差异、t 检验判断两组数据均值有无差异。只有在F 检验和t 检验都显示两组数据无差异后,才能认定通过比对证明出具的检测结果准确、可靠,具有可比性。
结果表明,两台仪器的10 次检测数据经Grubbs检验后发现均无离群值需剔除,氧氟沙星的检测浓度分别为(680.7±6.57) ng/mL 和(684.7±12.41) ng/mL,均值和方差经t 检验和F 检验发现均无显著性差异,且两台仪器的精密度RSD <2%(小于15%为合格),且准确度分别为97.24%,97.81%(判定合格标准为85%~115%),结果见表4。
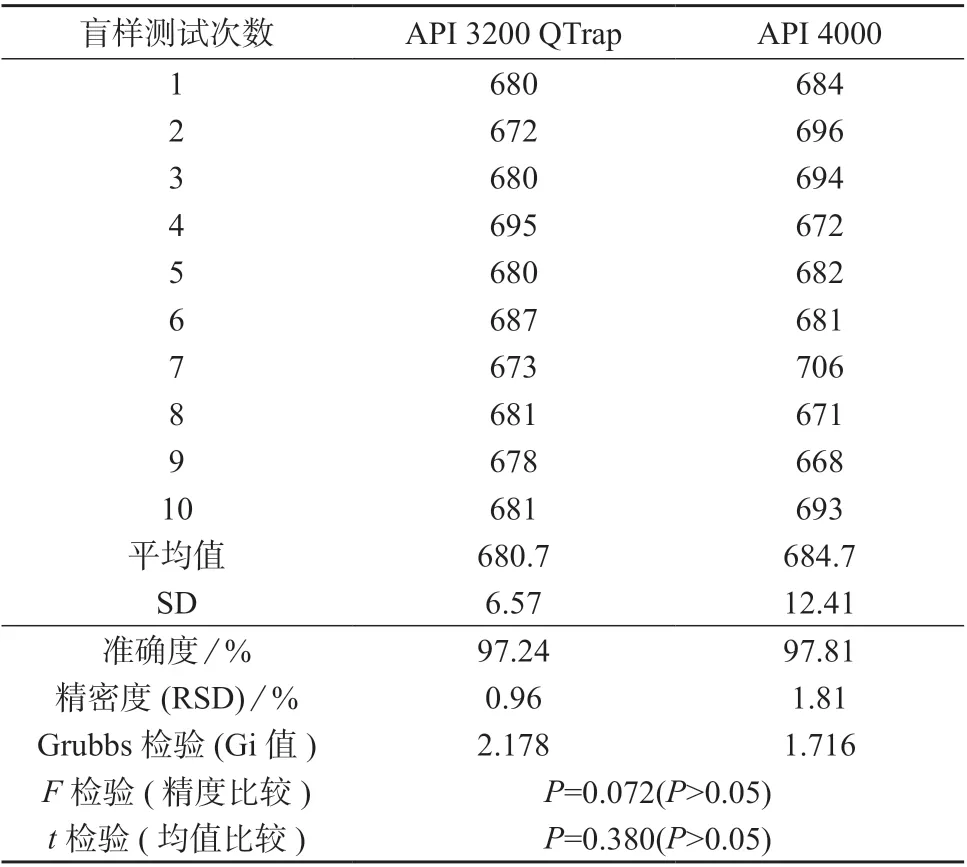
表4 2019 年度仪器比对数据统计结果 ng/mL
2.3 全国室间质评结果
使用API 3200QTrap 对5 个盲样进行检测,样品结果均为满意,实验室以满分100 分通过2019 年度全国药代动力学实验室间质评活动,结果见表5。

表5 2019 年度全国药代动力学实验室间质评盲样测试结果
3 结论
在液相色谱质谱联用仪期间核查的过程中,标准物质、相关仪器量具的检定校准情况、仪器日常维护等也是影响其准确度的重要因素。据此,实验室采取一系列措施,确保仪器期间核查数据的准确性。
(1)实验室对标准物质实行有效管理,首选购买可溯源至SI 单位[16]的生产单位,到目前为止均购自中国食品药品检定研究院;实验室制定标准物质档案,对每个标准物质的购买时间、规格、数量、厂家、批号、保存条件等进行登记;每季度开展标准物质期间核查,检查标准物质性状、标签及有效期限。
(2)ISO 17025 体系重视仪器设备的准确性和可溯源性[17–18],故实验室在年度校准操作规程的基础上,每年制定计量溯源性计划,对实验室仪器开展校准工作,包括对液相色谱–质谱联用仪期间核查时测量影响较大的玻璃器皿,建立合适的校准周期,并安排由华东国家计量测试中心完成校准检定。在经过检定校准后,判定其性能指标合格,贴标签进行标识。
(3)实验室专门制定《仪器设备的控制与管理程序》,以应对仪器的日常维护保养工作,对包括液相色谱质谱联用仪在内的重要仪器的维护保养,均作出具体要求。实验室每天两次监控检测室温湿度,检测室常年保持25℃温度和40%~70%湿度;每月更换液相色谱部分的滤头浸泡液,流动相每3 日更新;每两周定期检查更换清洗管路用的50%异丙醇,每6 个月更换质谱抽真空用的机械泵机油,使仪器保持合适的真空度;每2 个月清洗质谱仪空气过滤网;定期更换液相质谱连接塑料管路,清洗喷针以及interface Q1,Curtain Plate,Orifice 等离子源部件,以防系统污染,影响检测质量。
本实验室根据自身条件,结合液相色谱质谱联用仪的参考标准及相关规范,制定期间核查方法。本次期间核查由于检测器材的限制,未对柱温箱及色谱柱进行考察,今后将增加对柱温箱温度的准确度、以及使用不同色谱柱仪器的出峰情况等方面的核查。实验室严格按照期间核查的结果对液相色谱质谱联用仪进行判定,如果发现超出使用要求,均应立即停用,并对其进行隔离或加贴标签清晰标明以防止误用。对于发现的问题,依据CNAS 规定及时启动不符合项工作程序的管理[19]。液相色谱质谱联用仪是灵敏度高的精密仪器,定期开展对关键性仪器设备期间核查活动,已成为ISO 17025 认可实验室一项重要的日常工作之 一[20]。定期实施期间核查可显著提高检测质量,降低检测过程中差错发生率,持续保持设备校准状态的可信度[21]。

