基于网络药理学探究冰片改善冠心病的作用机制
樊亚梅,王 建,黄 维,黄 华,陈 念,董泰伟
(成都中医药大学药学院,四川 成都611137)
2015 年版《中国药典》 收载了冰片的3 个药品,分别为天然冰片[樟科植物樟Cinnamomum camphora(L.) Presl新鲜枝、叶经提取加工制成的结晶]、艾片[菊科植物艾纳香Blumea balsamifera(L.) DC 新鲜叶经提取加工制成的结晶]、合成冰片(合成龙脑)。三者性微寒或凉,味辛、苦,归心、脾、肺经,均具开窍醒神、清热止痛的功效[1],可用于热病神昏、惊厥、中风痰厥、气郁暴厥、中恶昏迷、胸痹心痛、目赤、口疮、咽喉肿痛、耳道流脓等。现代药理研究[2]表明,冰片具有抗炎、镇痛、促透、保护循环系统等作用。在循环系统方面,其对心肌缺血模型大鼠的保护作用与增加冠状动脉血流量、降低心肌耗氧量、抑制炎症反应等相关。
目前冠心病(coronary heart disease,CHD) 已成为全球的重要死因。世界卫生组织估计在2015 年约740 万人死于CHD,占全球死亡总数的13%[3]。CHD 属中医“胸痹”“心痛” 范畴,中医临床上常用冰片配伍他药进行防治。常用的中成药有冠心苏合丸、苏冰滴丸、速效救心丸等,其所含成分冰片在治疗心血管疾病方面发挥了重要作用。有研究[4]发现,冰片对异丙肾上腺素所致急性心肌缺血损伤模型大鼠的心肌保护作用机制可能与减轻细胞内钙超载、抑制细胞凋亡等相关。课题组前期研究发现冰片对心肌缺血模型大鼠有一定改善作用,可能与抗缺氧、抗自由基损伤、抑制炎症反应、改善能量代谢障碍等多个过程相关[5]。冰片在治疗心血管疾病方面的研究已取得一定成果,但是3 种冰片治疗CHD 的关键靶点及通路尚未完全清楚,故本研究采用分子对接技术结合网络药理学探讨3 种冰片调控CHD 的关键靶点及相关通路。
1 材料与方法
1.1 材料 中药台湾数据库 (TDT,http: / /tcm.cmu.edu.tw/),有机小 分子生 物活性 数据库 (PubChem,https: / /pubchem.ncbi.nlm.nih.gov/),反向药效团匹配数据库 (Pharmmapper,http: / / lilab.ecust.edu.cn/pharmmapper/),人类基因和基因表型综合数据库(OMIM,http: / / www.omim.org/),交互蛋 白数据 库 (DIP,http: / /dip.doe-mbi.ucla.edu),RCSB 数据库(http: / /www.rcsb.org/),David 6.8 (https: / /david.ncifcrf.gov/home.jsp),KOBAS 3.0 (http: / /kobas.cbi.pku.edu.cn/),Cytoscape 3.6.1,Discovery Studio 3.5。
1.2 配体准备 通过TDT 与PubChem 获得天然冰片、艾片、合成冰片主要成分(右旋龙脑、左旋龙脑、龙脑和异龙脑) 及硝酸甘油(阳性对照) 的化学结构,保存为∗.mol2 或SDF 格式。
1.3 靶点筛选 利用PharmMapper 预测3 种冰片主要成分的潜在靶点。借助OMIM 筛选与CHD 相关的基因靶点。通过DIP 数据库将以上成分、靶点连接成网络。使用Cytoscape 3.6.1 将构建的网络进行可视化分析,利用Network Analyzer 分析网络中每个点的拓扑参数,选择拓扑参数值Degree (度值),Betweenness Centrality (中介中心性) 与Closeness Centrality (接近中心性) 分别大于所有点中位数均值2、1、1 倍的靶点作为重要靶点,且将药物与疾病的共同重要靶点用于分子对接,基于RCSB 数据库下载共同重要靶点的晶体结构,保存其PDB 序号。
1.4 分子对接
1.4.1 准备配体 在Discovery Studio 3.5 软件的同一窗口导入3 种冰片及硝酸甘油的化学成分,通过Prepare Ligands对所有分子进行准备操作。
1.4.2 准备蛋白 将RCSB 数据库中下载的蛋白晶体结构导入Discovery Studio 3.5 软件,利用Clean Protein 对蛋白结构进行优化处理,去除配体分子、去水、加氢、补全残基等过程,然后定义蛋白、寻找蛋白结合位点。
1.4.3 分子对接过程 将准备好的配体依次与准备好的蛋白通过LigandFit 模式进行分子对接。在参数面板中,选择准备好的受体,指定活性位点;然后选择所有准备好的配体分子;默认其余设置,运行。
1.5 结果评价 通过Consensus Score 模块选择LigScore1、LigScore2、PLP1、PLP2、Jain、PMF、DOCK SCORE 7 种打分函数对结果进行一致性评价。记录各配体分子与靶点蛋白结合一致性打分最高的得分,并记录得分最高构象的氢键数,用于后续分析。
1.6 GO 与KEGG 富集分析 将分子对接结果较好的靶点通过David 6.8 中的基因ID 转换工具将共同重要靶点的Uniprot ID 转换为Entrez Gene ID,再导入KOBAS 3.0 进行KEGG 与GO 富集分析。
2 结果
2.1 筛选靶点 借助网络药理学方法,使用Network Analyzer分析所构建网络(图1) 中每个点的拓扑参数度值,中介中 心性与 接近中心性,结果分别 为1、0、0.271 707 03;选择拓扑参数度值>2,中介中心性>0,接近中心性>0.271 707 03 的靶点作为重要靶点。筛选出3 种冰片与CHD 的共同重要靶点6 个,分别为过氧化物酶体增殖体活化受体(PPARG)、一氧化氮合酶3 (NOS3)、基质金属蛋白酶3 (MMP3)、3-羟基-3-甲基戊二酰辅酶A 还原酶(HMGCR)、雌激素受体1 (ESR1)、细胞色素P450 家族第2 亚族C9 (CYP2C9),共同重要靶点的拓扑参数分析见表1。查阅文献发现PPARG 参与调控众多靶基因,在脂质代谢、胰岛素敏感性、肥胖和动脉粥样硬化中发挥重要作用;一项研究发现载脂蛋白与PPARG CT 基因型之间在影响CHD 的发生上存在显著的相互作用[6]。NOS3 诱导释放的NO 可促进血管舒张,参与血管生成环节;在心血管疾病发展过程中,NOS3 表达异常可导致NO 的不稳定,进而出现血管内皮功能紊乱,导致动脉粥样硬化等疾病发生[7]。细胞外基质的过度降解是动脉粥样易损斑块形成的重要原因之一,而MMP3 可以降解几乎所有细胞外基质成分,并激活其他基质金属蛋白酶类 (MMPs) 共同降解ECM,从而参与CHD 进程[8]。HMGCR 与CHD 和血脂代谢异常有关,并参与了血脂的调控[9]。雌激素对心血管的功能取决于ESR1 和ESR2,其分别编码ERα 和ERβ;其中ERα 参与了血管舒张、心肌细胞凋亡、刺激新血管的形成等,对心脏发挥了更重要的保护作用[10]。CYP2C9 在血管平滑肌细胞中参与了从花生四烯酸合成环氧花生酸(EET)的代谢过程,而EET 能够影响血压和血管内皮功能,因而提示CYP2C9 可能会影响CHD 的发病[11]。

图1 3 种冰片与CHD 重要靶点交互网络图

表1 3 种冰片对CHD 共同重要靶点的拓扑参数分析
2.2 分子对接 3 种冰片成分进行结构优化变构后,龙脑与右旋龙脑合并成为同一构象,左旋与异龙脑未改变构象。依据分子对接一致性评价结果与氢键数显示,与硝酸甘油(阳性对照) 相比,3 种冰片配体分子均与CHD 重要靶点MMP3、PPARG 结合较优,而左旋龙脑与CYP2C9,右旋龙脑、异龙脑与HMGCR、NOS3、ESR1 结合较好;提示ESR1、HMGCR、MMP3、PPARG、CYP2C9、NOS3 可能为3 种冰片作用于CHD 发挥疗效的差异靶点(用于GO 与KEGG 分析)。3 种冰片配体分子与CHD 重要靶点对接的一致性评价结果见表2,构象氢键数见表3,3 种冰片配体分子与MMP3、PPARG 晶体对接构象见图2~3。
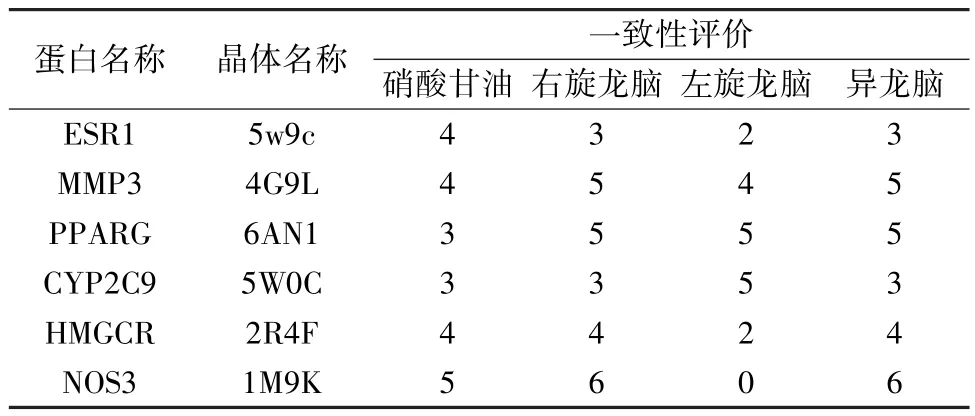
表2 3 种冰片配体分子与重要靶点的一致性的得分
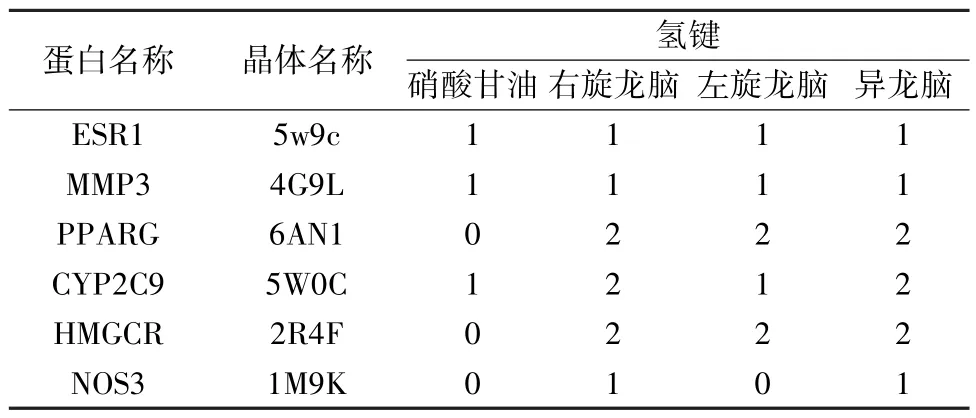
表3 3 种冰片配体分子与重要靶点对接构象的氢键数
2.3 GO 富集分析 对共同重要靶点进行GO 富集分析,前10 条分子功能(P<0.001) 主要与细胞对含氧化合物的反应、对化学刺激的反应、过渡金属离子的结合、调节平滑肌细胞的增殖、调节细胞死亡、单个有机体代谢过程、化学反应、活性氧代谢过程、氧化还原过程、对外界刺激的负调节相关。相关GO 分析结果如表4 所示。

图2 3 种冰片配体分子与MMP3 对接构象图
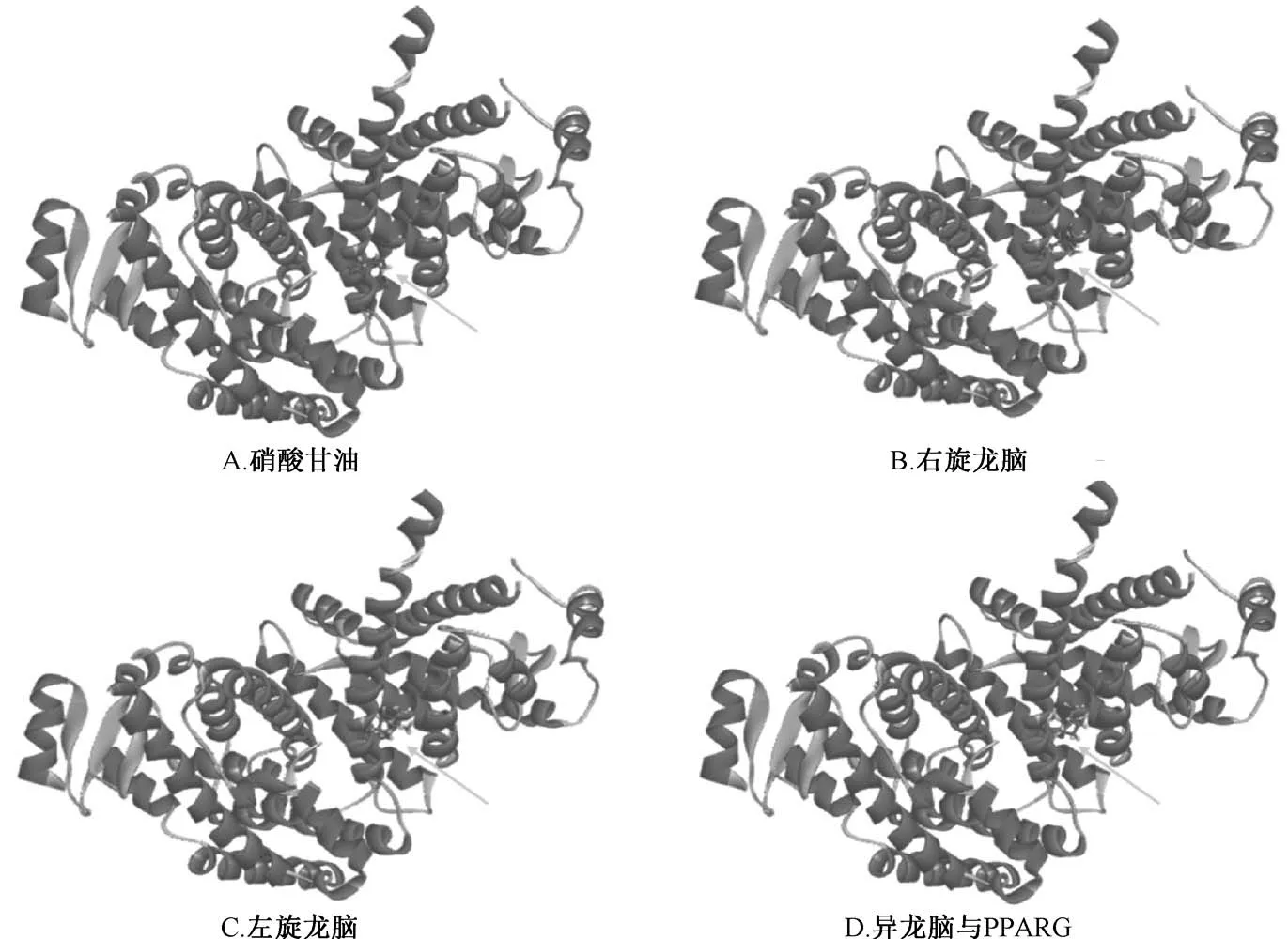
图3 3 种冰片配体分子与PPARG 对接构象图
2.4 KEGG 富集分析 通过David 6.8 与KOBAS 3.0 对共同重要靶点进行KEGG 富集分析,结果共筛选出38 条通路,其中13 条通路P<0.01,分别为雌激素信号通路、AMPK 信号通路、癌症转录失调、代谢途径、精氨酸生物合成、萜类化合物生物合成、亚油酸的新陈代谢、甲状腺癌、精氨酸和脯氨酸代谢、VEGF 信号通路、花生四烯酸代谢、视黄醇的新陈代谢、内分泌和其他因素调节钙的再吸收,其中前4 条信号通路P<0.001,提示其可能是3 种冰片调节CHD 最为重要的途径。KEGG 分析结果如表5。

表4 3 种冰片治疗CHD 重要靶点的GO 分析

表5 3 种冰片治疗CHD 重要靶点的KEGG 分析
3 讨论
网络药理学可从整体角度探索药物与疾病的关联性,该技术所具系统性、整体性,与中医药整体观理论,中药多组分、多靶点特点相似,已广泛用于中医药领域的相关研究[12-13]。而分子对接是一种计算机辅助药物设计技术,该技术按照几何互补、能量互补及化学环境互补原则评价配体与受体结合效果[14]。本研究所用工具LigandFit 是应用精确的经典分子对接方法进行虚拟筛选,其包含8 种不同算法的打分函数,还能对所有打分函数评分结果进行综合评价,使结果较为可靠。虽然网络药理学与分子对接技术已成为研究药物有效性和科学性的新方法,但其亦存在一些问题[15-16]。如相关数据库建设的完整性,网络分析方法的建立,靶点蛋白及其晶体结构、阳性化合物的选择,分子处理等过程能直接影响所预测的生物标志物及其作用机制的准确性,出现“假阳性” 结果。因此对研究结果还需进一步验证[17-18]。
网络药理学与分子对接结果提示ESR1、HMGCR、MMP3、PPARG、CYP2C9、NOS3 可能为3 种冰片作用于CHD 发挥疗效的差异靶点,其中3 种冰片配体分子均与MMP3、PPARG 结合较好,提示这2 个靶点可能均为3 种冰片治疗CHD 的重要潜在靶点。现代药理研究表明基质金属蛋白酶能降解细胞外基质几乎所有成分,引起血管平滑肌细胞迁移和增殖,对动脉粥样硬化(AS) 过程发挥重要作用[19]。其亦能降低斑块稳定性,导致急性心肌梗死、不稳定性心绞痛等急性冠状动脉综合征(ACS) 的发生[20]。对PPARG 的现代药理研究证明其在葡萄糖和脂质代谢中发挥重要调节作用,亦可对心血管系统产生影响[21]。杨海燕等[22]测定健康成年及老年人AS 患者血清PPARγ基因的表达,结果PPARγ基因表达与AS 严重程度呈正相关。综上,MMP3、PPARγ 与CHD 进程相关,可能为三种冰片调控CHD 的潜在重要靶点。
CHD 是一类严重危害人们生命健康,影响人们生活水平的疾病。其发病因素复杂,与吸烟、肥胖、高血压、高血脂、炎症、性别、年龄等因素密切相关[23]。本研究对与3 种冰片结合较好的共同重要靶点进行GO 与KEGG 富集分析发现,3 种冰片可通过调节细胞增殖、代谢、死亡等多个生物学过程及调控机体内分泌、物质代谢、信号转导等多条通路改善CHD 病理状态。所预测的潜在重要信号通路中雌激素信号通路、AMPK 信号通路、癌症转录失调、代谢途径可能为3 种冰片调节CHD 的最为重要的途径。
查阅文献发现,雌激素可通过“核启动类固醇信号”和“膜启动类固醇信号” 2 条通路调节细胞行为,相关受体被激活后,可迅速激活Ca2+、cAMP、PI3K-Akt、蛋白激酶级联等信号通路,发挥心血管保护作用,其作用机制与调节血管舒张、抗心肌细胞凋亡、刺激新血管形成等过程相关[24]。AMPK (磷酸腺苷活化蛋白激酶) 作为细胞能量代谢的关键因子,在缺血缺氧等能量缺乏情况下,可调节正反向相关因子调控细胞自噬、凋亡、炎症反应等过程发挥抗心血管损伤作用[25]。一氧化氮(NO) 具有扩张血管,增加血流量的作用,而精氨酸作为NO 的前体,可以协助舒张血管[26]。羟脯氨酸(HP) 可由脯氨酸羟化而来,在胶原蛋白中含有量最多;急性心肌梗塞后心肌细胞外基质的主要变化是胶原沉积和纤维化,有研究表明急性心肌梗塞后梗塞区HP 含有量明显增加,提示梗塞区有胶原纤维的沉积,HP 参与了心肌梗塞进程[27]。报道萜类化合物具有重要的生理活性,而冰片主要成分龙脑是一种双环单萜类成分,天然冰片又含律草烯、石竹烯等倍半萜,以及麦珠子酸、龙脑香醇、古柯二醇等三萜化合物[28];现代药理研究表明单味冰片能减轻犬急性心肌缺血引起的心肌损伤[29];亦有研究表明三萜类化合物可通过调节血糖浓度,降低血脂和血压等途径调节心血管疾病[30]。亚油酸能够降低血清胆固醇水平,抑制动脉血栓的形成,可用于临床预防、控制、治疗动脉粥样硬化以及心肌梗塞等心脑血管疾病[31]。视黄酸(RA) 是维生素A (视黄醇) 的衍生物,对心血管发育过程发挥着基本的调节作用[32]。花生四烯酸代谢是主要的炎症途径,当致炎因子入侵细胞时,磷脂酶A2 (PLA2) 催化磷脂,发生花生四烯酸(AA) 炎症级联代谢反应[33]。VEGF 为一种促内皮细胞分裂素,与血管新生血管密切相关,在体内外均能促进内皮细胞分裂、增殖和血管形成,在心血管疾病方面发挥重要调节作用[34]。综上,此研究结果体现了中药多靶点、多途径发挥疗效的特点,以期为3 种冰片调控CHD 的作用机制提供了参考。

