通迪胶囊对Ⅱ型胶原诱导性关节炎小鼠的影响
吴晓东,黄闰月,陈秀敏,王茂杰,赵 越,伍嘉琪
(1.广州中医药大学,广东 广州510006; 2.广州中医药大学第二附属医院,广东 广州510405)
类风湿关节炎(rheumatoid arthritis,RA) 是一种以关节软骨病变,滑膜细胞增生为特征的系统性、炎性自身免疫性疾病[1]。目前认为免疫细胞及其分泌的细胞因子的调节失衡是RA 发病过程的核心免疫机制[2],其中自身反应性T 细胞在RA 免疫紊乱中起着关键作用[3]。由于RA 的难治性和机制的复杂性,现有方案的治疗效果仍有待进一步改善[4],因此,RA 治疗药物的研发仍然迫切。中医药治疗RA 效果显著,但是很多有效药物的机制仍然不明,限制了其临床广泛应用。通迪胶囊是纯中药制剂,具有活血行气、散瘀止痛的功效,被广泛用于各种风湿关节病。本研究以Ⅱ型胶原诱导性关节炎小鼠为研究对象,探讨通迪胶囊对CIA 小鼠关节炎症与细胞免疫功能的影响。
1 材料
1.1 动物 SPF 级雌性BALB/c 小鼠29 只,6~8 周龄,体质量(20±2) g,购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK (京) 2016-0006。
1.2 药物与试剂 通迪胶囊(批号20170714,贵州景诚制药有限公司);鸡Ⅱ型胶原 (批 号120257,美 国Chondrex 公司);弗氏完全佐剂 (批号SLBT1714,美国Sigma 公司);PE 偶联小鼠CD4 抗体(批号7312859,美国BD 公 司);Mouse Th1/Th2/Th17 Phenotyping Kit (批 号8019831,美 国BD 公 司);Transcription Factor Buffer Set(批号7282590,美 国BD 公 司);甲氨蝶呤片 (批 号036170502,上海上药信谊药厂有限公司)。
2 方法
2.1 造模 选用BALB/c 小鼠作为实验对象,鸡Ⅱ型胶原溶解于0.1 mol/L 冰醋酸中,使其终质量浓度为2 mg/mL,4 ℃过夜,次日,将溶解的胶原与等体积弗氏完全佐剂充分乳化(冰上操作) 至油包水状,使胶原浓度为1 mg/mL;初次免疫时,于BALB/c 小鼠足底皮下和尾根部皮下2~3 cm 处注射100 μL 乳化胶原;2 周后,以相同剂量再次加强免疫,肉眼观察小鼠四肢,每隔3 d 采用游标卡尺测量小鼠左右后足踝关节下0.5 mm 处的直径值,作为关节肿胀度的指标。
2.2 分组、给药 根据动物的存活率和模型成功率,将以上造模成功Ⅱ型胶原诱导性关节炎小鼠随机分为模型组(5 只)、甲氨蝶呤组(8 只),通迪胶囊组(11 只),另设空白组5 只。各组动物于第1 次免疫第16 天后,通迪胶囊组灌胃给予通迪胶囊溶液0.55 g/kg,1 d/次;甲氨蝶呤组每周灌胃给予2 次甲氨蝶呤溶液2.055 mg/kg;空白组、模型组每天给予生理盐水;连续给药50 d。给药剂量按照实验动物与人临床用药量的换算公式计算得出。
2.3 肿胀度的测定 根据参考文献[5],每隔3 d采用游标卡尺测量小鼠左右后足踝关节下0.5 mm 处的直径值,作为关节肿胀度的指标。
2.4 细胞因子检测 给药50 d 后,采用毛细管眼球取血。离心收集血清(3 500 r/min、4 ℃、15 min),冻存于-80 ℃待测。以上样品均采用ELISA 法检测CRP、TNF-α 水平。
2.5 关节组织病理检查 根据参考文献[6],给药50 d后,颈椎脱臼处死小鼠,除去病变关节的皮毛和多余的组织,保留跖趾关节及趾间关节,4% 多聚甲醛固定,10%EDTA 脱钙,常规脱水,石蜡包埋,切片。HE 染色,加封玻片保存,显微镜下观察。
2.6 流式细胞术检测Th1、Th2、Th17、Treg 淋巴细胞 给药50 d 后,脱颈处死小鼠后置于75% 酒精中浸泡5 min杀菌,开腹,立即取出脾脏,研磨,分离脾淋巴细胞,加入1 mL 红细胞裂解液,轻弹,室温下静置5 min,1 000g离心5 min,将制备的脾脏单细胞悬浮于RPMI 1640 (含10%热灭活FBS),细胞计数,调节细胞浓度为1×106/mL。分别取200 μL 细胞加入到96 孔细胞培养板中。加入250×的PMA&离子霉素工作液0.8 μL,混匀。37 ℃孵育1 h,加入高尔基阻断剂0.13 μL,继续孵育6 h,期间混匀3 次。收集细胞于流式管中,加入相应抗体,上机检测。
2.7 统计学分析 采用SPSS 20.0 统计软件进行统计分析,数据以() 表示;多组间比较采用单因素方差分析,方差齐时两两比较采用LSD 法,方差不齐时两两比较采用Tamhane’s T2 法。以P≤0.05表示差异具有统计学意义。
3 结果
3.1 Ⅱ型胶原诱导性关节炎小鼠踝关节一般状态 经完全弗氏佐剂和鸡Ⅱ型胶原诱导后第3 天,造模小鼠开始出现关节及足趾轻微肿胀,食欲减退,精神差,体质量下降情况;在第15 天进行2 次免疫后关节肿胀程度加重,行动不便。
3.2 各组小鼠踝关节肿胀度 如图1 所示,与空白组相比,模型组、甲氨蝶呤组、通迪胶囊组小鼠自注射鸡Ⅱ型胶原蛋白后,左右足关节明显出现肿胀,并在第18 天达到高峰。经给药后,甲氨蝶呤组、通迪胶囊组的小鼠,左右足的肿胀度下降。

图1 各组小鼠踝关节肿胀度
3.3 各组小鼠细胞因子水平 如图2~3 所示,与空白组比较,模型组CRP、TNF-α 水平升高(P<0.05);与模型组比较,甲氨蝶呤组、通迪胶囊组的CRP、TNF-α 水平降低(P<0.05)。通迪胶囊与甲氨蝶呤组比较,差异无统计学意义(P>0.05)。
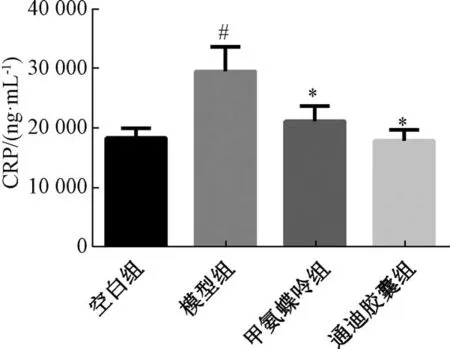
图2 各组小鼠CRP 水平
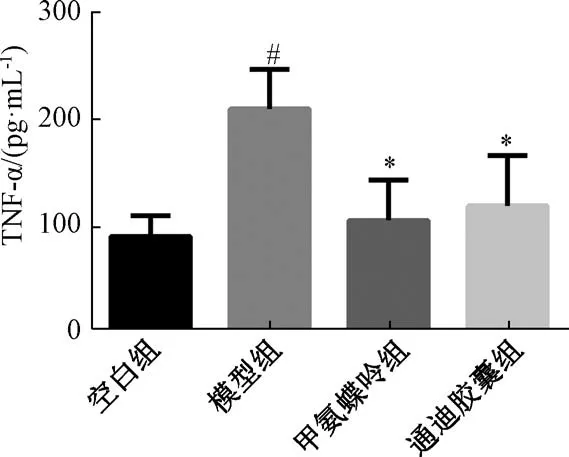
图3 各组小鼠血清因子TNF-α 水平
3.4 各组小鼠踝关节HE 染色 如图4 所示,空白组各关节结构较清晰正常,关节腔内干净,关节软骨结构正常,滑膜未见增生,组织未见明显炎症反应。模型组局部关节可见滑膜增生、骨膜增生,并伴有少量炎症细胞浸润;关节腔内可见较多细胞结构;组织中还可见多处大量结缔组织增生,并伴有少量炎症细胞浸润。甲氨蝶呤组组织中关节滑膜未见增生,关节软骨结构正常,关节腔内干净;组织中可见较多结缔组织增生,但未见明显炎症反应;通迪胶囊组的组织中关节滑膜未见增生,关节软骨结构正常,关节腔内干净;组织可见较多结缔组织增生(与甲氨蝶呤组相似),并伴有少量炎症细胞浸润。与空白组比较,模型组病变显著,主要病变为滑膜增生、结缔组织增生、炎症细胞浸润;与模型组比较,甲氨蝶呤组和通迪胶囊组关节软骨结构正常,关节腔内干净,未见滑膜增生,其中甲氨蝶呤组炎症反应较模型组轻,通迪胶囊组炎症反应较模型组差异不显著,但症状较模型组稍好转,提示通迪胶囊可减轻小鼠关节损伤。
3.5 各组小鼠Th1、Th2、Th17 和Treg 淋巴细胞比例 与空白组比较,模型组Th1、TH17 细胞比例升高(P<0.05);与模型组比较,甲氨蝶呤组、通迪胶囊组的Th1、TH17 细胞比例降低(P<0.05)。与空白组比较,模型组TH2、Treg 细胞比例减少(P<0.05);与模型组比较,甲氨蝶呤组和通迪胶囊组的Th2、Treg 细胞比例升高(P<0.05)。见图5~6。

图4 各组踝关节病理切片(200×)

图5 流式细胞图
与空白组比较,模型组的小鼠脾脏Th 细胞亚群相对数量Th1/Th2、Th17/Treg 比值均上升(P<0.05);与模型组比较,甲氨蝶呤组、通迪胶囊组的小鼠脾脏Th 细胞亚群相对数量Th1/Th2、Th17/Treg 比值均下降(P<0.05)。见图7。
4 讨论
RA 是由自身免疫耐受失衡引起的系统性自身免疫性疾病,以滑膜炎症、血管翳形成及关节破坏为主要病理特征。RA 确切发病机制不明,目前认为Th 亚型 (Th1、Th2、Th17、Treg) 间的相互作用及平衡在RA 的发生发展中起着重要作用[7]。当平衡向Th1 和Th17 型细胞倾斜时,导致Th1 和Th17 型细胞因子,如TNF-α、IL-17 等炎性细胞因子亢进,而Th2 和Treg 型抗炎细胞因子如IL-4 和TGF-β 产生不足,机体内稳定的免疫内环境遭到破坏,引起局部或全身免疫应答失常,导致RA 的疾病进展,由此可见RA 的转归依赖于Th 细胞亚型及其相关细胞因子的变化[8]。研究表明,Th17 细胞产生具有强大致炎效应的IL-17、TNF-α,通过诱导基质金属蛋白酶(MMPs) 和破骨细胞的生成,促进关节滑膜的炎症反应及软骨破坏[9];而Treg 细胞可以产生抑制性细胞因子IL-10、TGF-β、IL-35,并通过上调抑制性免疫细胞表面分子表达和下调活化T 细胞的相关基因,抑制靶细胞诱导的免疫应答[10]。Treg、Th17 细胞在特定的细胞因子微环境下可以相互转换,初始CD4+T 细胞在TGF-β单独作用下分化为Treg 细胞,而当TGF-β 和IL-6 共同存在时,能够诱导RORγt 的表达,促进初始T 细胞分化为Th17细胞[11]。因此,调节Th1、Th2、Th17 和Treg 细胞间的平衡可成为治疗RA 的新方法。
本研究采用鸡Ⅱ型胶原诱导BALB/c 小鼠关节炎模型,在发病机制、疾病症状和病理特征上与RA 都具有共同点,是研究人类RA 较为经典、成熟的实验动物模型,在国际上广泛应用于治疗RA 药效评价和作用机制的研究[12]。结果发现,经通迪胶囊干预后的CIA 小鼠关节肿胀度明显降低,提示了该药的抗炎效果。CIA 小鼠模型与人RA 相似,细胞免疫和体液免疫变化明显,可表达TNF-α、CRP 等促炎细胞因子,ELISA 结果表明通迪胶囊能够显著的降低CRP 和TNF-α 血清因子水平,进一步证明了通迪胶囊的抗炎作用。病理切片的研究结果还发现,虽然在通迪胶囊给药组的CIA 小鼠踝关节组织内有少量炎症细胞浸润,但较模型组轻,重要的是组织细胞排列相对整齐,血管翳生成减少,关节软骨结构正常,说明了通迪胶囊不仅具有炎症抑制作用,更可以保护CIA 小鼠的关节软骨,具有较好的骨保护作用。
RA 的骨质破坏进程是该病致残的主要原因,目前的西医常规治疗策略无法有效抑制RA 骨破坏进程,而新型药物如生物模拟物对骨破坏是否具有有效抑制作用仍有待进一步的研究观察[13]。本研究中,通迪胶囊对CIA 小鼠血管翳生成的抑制作用及对关节软骨的保护作用提示了该药作为RA 骨保护药物的开发价值,是中药复方治疗作用的一个亮点,值得重视和深入挖掘。
为了进一步探讨通迪胶囊治疗关节炎的作用机制,本研究结合RA 的免疫学机制,进一步探索了通迪胶囊对CIA小鼠脾脏Th1、Th2、Th17 和Treg 淋巴细胞的影响。在Ⅱ型胶原诱导性关节炎模型中Th1/Th2、Th17/Treg 细胞的比例及其分泌的细胞因子较空白实验组明显升高,表明在Ⅱ型胶原诱导性关节炎形成中Th 处于高度活化状态,这与RA的研究结果报道一致[14-15]。研究结果发现通迪胶囊灌胃给药能够升高Ⅱ型胶原诱导性关节炎小鼠Th2 和Treg 细胞的水平,同时下调Ⅱ型胶原诱导性关节炎小鼠的Th1 和Th17的水平,从而调节Th1、Th2、Th17、Treg 功能性细胞间的相互作用,诱导Ⅱ型胶原诱导性关节炎小鼠产生免疫耐受。另一方面经过给药后Ⅱ型胶原诱导性关节炎小鼠的Th1/Th2 与Treg/Th17 细胞比例下降,提示通迪胶囊通过调控Ⅱ型胶原诱导性关节炎小鼠脾脏Th1/Th2、Th17/Treg 细胞比例失衡,重新诱导Ⅱ型胶原诱导性关节炎小鼠的免疫平衡,从而达到治疗疾病的目的。鉴于Th17 活化在其他自身免疫病中的重要作用,以及新上市的针对IL-17 的生物制剂在银屑病关节炎和强直性脊柱炎治疗中的显著疗效[16-17],通迪胶囊在其他自身免疫病治疗中的应用价值值得进一步探讨。
综上所述,本研究表明通迪胶囊对Ⅱ型胶原诱导性关节炎小鼠的抗炎和骨保护作用,并探讨了其免疫学的机制与调控Th1/Th2、Th17/Treg 失衡有关。研究结果进一步提示了通迪胶囊对自身免疫病的治疗作用,值得深入开展机制研究和临床观察。

